乳腺癌是中国女性常见的恶性肿瘤之一,其中遗传性乳腺癌占5%~10%,BRCA1/2基因突变是最主要的遗传易感因素。近年来,尽管多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂等靶向药物的应用改善了BRCA突变乳腺癌患者的预后,但在临床实践中仍存在诸多亟待解决的问题,包括突变检测的规范化、精准治疗策略的优化及长期管理的完善等。针对这些临床问题,本共识专家组基于《中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018年版)》及国内外最新循证医学证据,结合中国临床实践特点,对BRCA1/2基因检测的适用人群、检测方法、结果解读、治疗策略和风险管理等关键环节进行了系统评估和深入讨论,最终形成《中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2025年版)》。主要更新内容包括: ① 增加BRCA1/2基因突变与程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)表达的关系,以及BRCAness类型的相关内容;② 规范基因检测的应用,如增加临床检测的意义、时机及样本选择、优化BRCA检测人群;③ 更新治疗策略,如BRCA1/2基因突变的非药物治疗、BRCA1/2基因突变三阴性乳腺癌(triple-negative breast cancer,TNBC)患者的治疗、BRCA1/2基因突变激素受体(hormone receptor,HR)+/人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)-乳腺癌患者的治疗决策、PARP抑制剂的临床使用及不良反应管理;④ 增加长期风险管理的相关内容,如涵盖随访管理、预防性手术指征、新增基因检测的质量控制与要求、更新基因检测流程、报告内容及解读等。本共识旨在为临床医师提供规范化的诊疗指导,推动BRCA基因突变乳腺癌的精准医疗发展,最终改善患者生存及预后。随着研究的深入,本共识今后将持续更新以纳入最新的循证医学证据。

王红霞, 殷咏梅, 胡夕春. 中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2025年版)[J]. 中国癌症杂志, 2025, 35(7): 710-734.
国家癌症中心发布的2022年中国恶性肿瘤数据[1]显示,乳腺癌是中国女性第2常见的恶性肿瘤,居女性癌症相关死因的第5位,2022年中国乳腺癌发病例数为35.72万例,中国人口年龄标准化发病率为35.30/10万;死亡例数为7.50万例,中国人口年龄标准化死亡率为6.27/10万。中国人群乳腺癌诊断时年龄主要集中在45~55 岁[2],而美国81%的乳腺癌患者年龄大于50岁,平均诊断年龄为62岁,中国乳腺癌患者总体患病年龄比欧美女性更低[3-4]。5%~10%的乳腺癌患者具有明确的遗传基因突变,称之为遗传性乳腺癌(hereditary breast cancer,HBC)[5-6],其中BRCA1/2基因突变占15%[7],其他主要易感基因包括TP53、CDH1、LKB1、PTEN、CHEK2、ATM和PALB2等[4]。近期研究[8]显示,BRCA1、BRCA2和PALB2等基因在乳腺癌患者中的突变率较高。值得注意的是,不同基因突变与乳腺癌分子亚型存在特异性关联:ATM、CDH1及CHEK2突变与雌激素受体(estrogen receptor,ER)+乳腺癌的患病风险增加相关,而BARD1、BRCA1、BRCA2、PALB2、RAD51C及RAD51D突变则与ER-乳腺癌的患病风险关联性更强[8-10]。本共识旨在为临床医师提供规范化的诊疗指导,推动BRCA基因突变乳腺癌的精准医疗发展,最终改善患者的生存及预后。
共识制定情况
共识专家构成
《中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2025年版)》专家组由乳腺外科、肿瘤内科、病理科等领域的58名专家组成。
审核专家组组长和执笔专家基于近年来国内外已发表的高质量文献证据,并结合临床经验整理出共识初稿,后经过多轮专家组会议的讨论和修改,最终形成共识推荐内容。
共识级别定义标准
具体投票结果见附录一,共识证据级别参照附录二。基于专家投票结果,最终形成本共识。
共识的目标人群与使用人群
本共识的目标人群为乳腺癌患者,使用人群为从事乳腺癌治疗的医务工作者。
共识的传播与更新
共识专家组将采取多种形式对共识进行宣传和普及,具体包括:① 在权威医学期刊上进行全文发表;② 依托全国性的学术会议进行共识发布;③ 通过专业医学媒体进行多维度传播分享;④ 分阶段召开全国各区域共识分享讨论会议,确保不同地域医务工作者能充分理解并正确运用共识内容。共识专家组未来将根据循证医学证据的累积和临床实践需求的变化,定期对共识内容进行修订和更新。
BRCA基因突变与乳腺癌
BRCA1/2基因突变种类和突变位点
BRCA1和BRCA2均属于肿瘤抑制基因,分别于1990和1994年被鉴定出来[11-12]。其中BRCA1位于人类染色体17q21上,含有23个外显子,编码由1 863个氨基酸残基构成的蛋白质[11];
而BRCA2位于人类染色体13q12上,含有27个外显子,编码由3 418个氨基酸残基构成的蛋白 质[12]。BRCA1/2编码的蛋白质作用于多种细胞生命活动过程,包括DNA损伤修复、基因转录调控和细胞周期调节等[13-15]。
BRCA基因突变分为两种类型:一种为胚系BRCA突变(germline BRCA mutation,gBRCAmut),是指来源于精子或卵母细胞的生殖细胞突变,导致机体所有细胞都带有突变,可以遗传给后代[16];另一种为体细胞BRCA突变(somatic BRCA mutation,sBRCAmut),是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变[17]。截至2017年12月,乳腺癌信息中心(Breast Cancer Information Core,BIC)报道约 1 800个BRCA1和2 000多个BRCA2基因突变位点,其中53%~55%是个体突变,仅在个别家族中发现,致病突变大多是小片段缺失、插入及非同义突变,导致蛋白质功能缺陷,除BRCA基因编码区突变外,内含子发生的一些突变亦可能通过干扰RNA剪切等方式影响蛋白质功能,尤其是靠近剪接位点附近的突变[18-19]。
BRCA1/2基因突变的流行病学、种族及地域差异性
这些致病突变分散遍布于整条基因序列,很难找到固定的突变热点,并且即使存在突变热点,在不同地域及不同种族之间差异也很大,但在特定人群中存在“始祖突变”现象。最著名的“始祖突变”出现于德系犹太人中,表现为BRCA1 185delAG(携带率为1.00%)、BRCA1 5382insC(携带率为0.13%)和BRCA2 6174delT(携带率为1.52%)位点突变[20-21]。关于中国人群BRCA突变的数据,一项纳入8 085例中国乳腺癌患者的研究[22]显示,BRCA总突变率为5.3%,其中5589del8突变共检测到28次,占总突变的6.5%。复旦大学附属肿瘤医院胡震等[23]在177例家族性和早发性乳腺癌患者及426例散发性乳腺癌患者中发现3例5589del8突变携带者。当前正在进行的一项针对2万多例中国散发性乳腺癌患者的大样本研究[24]发现,BRCA总阳性突变率为5.37%,其中BRCA1阳性突变率为2.14%,BRCA2阳性突变率为3.23%。图1列出已知的中国人群相对高频突变位点,其中5589del8位点突变率高达0.17%,占总突变的3%,由此推测BRCA1 5589del8位点在汉族人群中可能具有部分始祖效应,而该位点突变频次在欧美国家中极低,表明突变热点在不同人群、不同地域之间存在显著差异[24]。
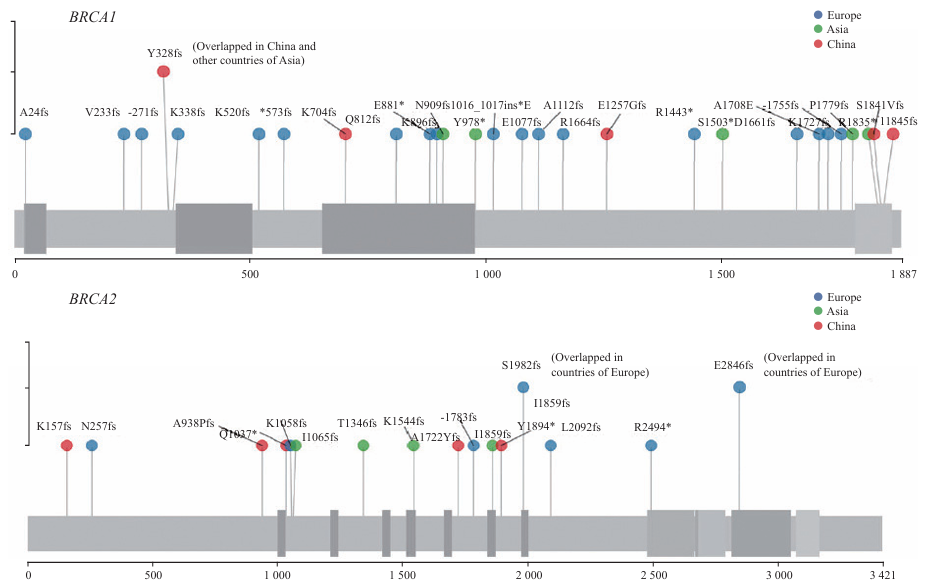
BRCA1/2基因突变携带者的乳腺癌患病风险
携带BRCA1/2基因突变的女性不仅乳腺癌患病风险增加,其他如卵巢癌、输卵管癌、胰腺癌、胃肠癌及黑色素瘤等患病风险也增加,男性罹患乳腺癌、前列腺癌的风险增加[25-28]。
欧美国家研究数据[29-32]显示,女性BRCA1基因突变携带者70岁前发生乳腺癌累积风险为57.0%~60.0%,70岁前发生卵巢癌累积风险为40.0%~59.0%,女性BCRA2基因突变携带者风险分别为49.0%~55.0%和16.5%~18.0%,相较于一般人群,BRCA1和BRCA2基因突变携带者的乳腺癌患病风险提高了10~20倍。男性BRCA1基因突变携带者的乳腺癌患病风险增加10~50倍,BRCA2基因突变携带者的乳腺癌患病风险增加50~100倍[32-33]。中国人群数据[34]显示,BRCA1基因突变携带者的乳腺癌发生风险在79岁前为37.9%,BRCA2基因突变携带者为36.5%。
BRCA1/2基因突变乳腺癌的临床病理学特征
BRCA1/2基因突变相关性乳腺癌的临床病理学特征与非BRCA1/2关联的散发性乳腺癌相比有很大的不同。三阴性乳腺癌(triple-negative breast cancer,TNBC)的BRCA1/2基因突变率约为12%[35],激素受体(hormone receptor, HR)+/人表皮生长因子受体2(human epidermal growth factor receptor2,HER2)-乳腺癌的BRCA1/2基因突变率为4%[36]。60%~80%的BRCA1基因突变乳腺癌为TNBC,超过75%的BRCA2基因突变乳腺癌为Luminal型[37-38]。总体而言,这部分患者往往分期较高,分化较差。HR+乳腺癌虽然BRCA1/2基因突变率较低,但该部分患者占整个乳腺癌人群的70%[38],不可忽视,尤其对于有家族史的患者。
BRCA1/2基因突变与PD-L1表达的关系
临床广泛应用的免疫检查点抑制剂(immune checkpoint inhibitor,ICI)包括程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂/程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)抑制剂和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)阻断抗体等。
DNA损伤应答(DNA damage response,DDR)通路可以监测外源性或内源性DNA损伤,通过同源重组修复(homologous recombination repair,HRR)在内的多种修复机制,保护细胞免受基因组变化的影响[39]。具体而言,DDR通路缺陷通过环状GMP-AMP合酶(cyclic GMP-AMP synthase,cGAS)-干扰素基因刺激因子(stimulator of interferon genes,STING)途径感知细胞质内的异常双链DNA,产生干扰素(interferon,IFN)(尤其是Ⅰ型IFN)、白细胞介素-6(interleukin-6,IL-6)等,激活固有免疫系统;cGAS-STING通路的激活通过Ⅰ型IFN介导,诱导CD8+ T淋巴细胞浸润,产生抗肿瘤免疫应答;DDR通路缺陷亦可增强适应性免疫系统对肿瘤细胞的识别能力,并重塑肿瘤微环境。与此同时,DDR通路缺陷,无法修复的DNA损伤能够诱导肿瘤细胞PD-L1 mRNA的表达,从而上调肿瘤细胞表面PD-L1的表达,抑制T淋巴细胞的增殖活化和细胞因子的产生,促成肿瘤细胞的免疫逃逸。
HRR是DNA双链断裂(double strand break,DSB)后的首选修复方式,具有遗传信息高保真性、损伤修复高准确率等特点。HRR是一条涉及多个复杂步骤的信号通路,最关键的基因是BRCA1/2。作为HRR通路上的基因,BRCA1/2是一种肿瘤抑制基因。HRR缺陷(HRR deficiency,HRD),即BRCA1/2等HRR相关基因突变的细胞DNA DSB的修复机制不完全,可以显著上调PD-L1的表达[40]。
多腺苷二磷酸核糖聚合酶[poly (ADP ribose) polymerase,PARP]家族在DNA单链修复方面发挥重要作用。PARP是DNA断裂的“传感器”和“信号换能器”,可以特异性地识别并结合DNA单链断裂末端,是重要的DNA修复酶。在PARP抑制剂(PARP inhibitor,PARPi)的作用下,DNA单链断裂不断积累,如果进入DNA复制叉,DNA单链断裂可以转变为DNA DSB。此时正常细胞启动HRR途径修复断裂的DNA双链,而gBRCAmut的肿瘤细胞存在HRD,DNA DSB的修复机制不完全,导致肿瘤细胞死亡[41-42]。
PARPi诱导的DNA DSB等损伤效应诱导肿瘤新抗原产生、增加肿瘤细胞突变负荷,激活免疫通路,上调PD-L1的表达,提高肿瘤细胞对ICI的应答率。具体而言,PARPi增加了肿瘤细胞的基因组不稳定性,DNA损伤不断积累,细胞质中产生双链DNA,与cGAS结合后形成cGAMP,结合STING,诱导表达Ⅰ型IFN,产生杀伤肿瘤细胞的效应。cGAS-STING通路激活机制提示PARPi联合ICI的合理性[41-42]。
综上所述,DNA损伤信号、包括HRD在内的DDR通路缺陷及外源性PARPi都可以上调肿瘤细胞表面PD-L1的表达。
PARPi与ICI联合可以进一步促进免疫系统的复活、募集并提高淋巴细胞浸润等,从而发挥更强大的抗肿瘤效应[39]。临床上PARPi与ICI联合使用可以改善长期单独应用PARPi的获得性耐药和免疫治疗的结局,具有广阔的应用前景。基于DNA损伤和修复的新治疗策略在乳腺癌免疫治疗领域具有很大的潜力。例如,MEDIOLA研究[43]已经证实奥拉帕利(olaparib)联合度伐利尤单抗(durvalumab)在gBRCAmut转移性乳腺癌的治疗中可以产生协同增效作用。
BRCAness类型
对于BRCA1/2基因生物学功能的理解推动了针对HRD的肿瘤治疗方法的发展,特别是PARPi。由此很容易令人联想到某些同样具有BRCA1/2基因突变分子特征的肿瘤,即BRCAness类型的肿瘤[44],BRCAness是指在不存在gBRCAmut的情况下,肿瘤细胞存在其他的HRD,可以定义为HRR通路DSB修复(DSB repair,DSBR)中的基因缺陷,用来描述类似于BRCA1/2mut的HRD的特征。这些基因包括ATM、ATR、CHEK1/2、DSS1、RAD51、NBS1、FANC、CDK12等。BRCAness可能与HRR通路上除BRCA1/2mut外的其他基因突变相关;也可能涉及HRR相关基因的表观遗传学修饰,如DNA甲基化等。DSBR缺陷是HRD肿瘤的显著突变特征,但不同类型的BRCAness基因能够在多大程度上影响HRR的功能仍有待探索。未来不仅需要确认与HRR相关的非gBRCAmut的肿瘤类型,而且需要明确可能由BRCAness表型驱动的突变特征。随着人们对肿瘤分子谱系认识的不断深入,我们期待BRCAness类型不再局限于乳腺癌、卵巢癌、前列腺癌、胰腺癌等,其他癌症类型也可能发现BRCAness类型,进而能够从现有的靶向HRR通路药物治疗中获益。
对BRCAness类型的研究从单一的BRCA1/2mut外延到HRD,有望拓宽PARPi的适应证,扩大获益人群。对于BRCAness类型的生物标志物的探索,以及HRR通路功能性生物标志物的整合,PARPi也许可以从靶向BRCA1/2mut拓宽到整个HRR通路。例如,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南(2025年V4版)[45]推荐针对转移性前列腺癌患者进行HRR通路基因检测,包括BRCA1/2、ATM、PALB2、FANCA、RAD51D、CHEK2、CDK12等。早在2020年5月19日,美国食品药品管理局(Food and Drug Administration,FDA)批准了olaparib治疗HRR通路基因突变的转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)。充分证实除了BRCA1/2mut,PARPi对于更大范围的HRR通路相关基因突变人群也可带来临床获益。
BRCA1/2基因突变与乳腺癌患者的预后
多项研究[46-47]均显示,携带BRCA1/2基因突变的乳腺癌患者有预后更差的趋势。一项汇总13项大型研究的meta分析[48]结果显示,BRCA1基因突变乳腺癌患者的总生存期(overall survival,OS)短于未突变患者[风险比(hazard ratio,HR)=1.50,95% CI:1.11~2.04],而BRCA2基因突变与患者的OS无相关性。另一项纳入60项研究共105 220例乳腺癌患者的meta分析[49]显示,BRCA1基因突变患者的OS及乳腺癌特异性生存期(breast cancer-specific survival,BCSS)短于未突变者(OS:HR=1.30,95% CI:1.11~1.52,P=0.001;BCSS:HR=1.45,95% CI:1.01~2.07,P=0.045),BRCA2基因突变患者的BCSS短于未突变者(HR=1.29,95% CI:1.03~1.62,P=0.03),但OS差异并无统计学意义(P>0.05)。
POSH研究[50]结果显示,对于年轻时(≤40岁)确诊乳腺癌的患者,携带BRCA基因突变的患者与未携带基因突变的患者生存率相似,在TNBC患者中,携带BRCA基因突变的患者比未携带此基因突变的患者2年生存率高,但5和10年生存率差异无统计学意义(P>0.05),导致结论不一致的原因可能与临床对BRCA突变患者关注度更高、预防性切除及采用相关靶向治疗手段有关。一项纳入119例早发性乳腺癌(确诊年龄<41岁)的研究[51]发现,BRCA1/2基因突变的早发乳腺癌患者是否接受化疗与预后存在相关性(HR=3.00,95% CI:1.2~7.7,P=0.014)。一项纳入从CancerLinQ Discovery数据库中识别的3 744例HER2-转移性乳腺癌患者的回顾性研究[52]显示,伴BRCA突变的TNBC患者的中位OS为13.7个月(95% CI:11.1个月~NC),而不伴BRCA突变的TNBC患者的中位OS为14.4个月(95% CI:10.7~17.0个月),在数值上优于不伴BRCA突变患者。另一项研究BRCA突变状态与乳腺癌患者生存之间相关性的系统评价和meta分析[53]显示,BRCA1基因突变的TNBC患者的无病生存期(disease-free survival,DFS)显著更差(HR=1.65,95% CI:1.08~2.54,P=0.021 6),无论随访是否超过5年,BRCA1基因突变患者的OS均显著更差。
此外,伴BRCA突变的HR+/HER2-患者的预后也比不伴BRCA突变的差。一项根据gBRCA状态评估细胞周期蛋白依赖性激酶4和6抑制剂(cyclin-dependent kinase 4 and 6 inhibitor,CDK4/6i)治疗转移性乳腺癌效果的真实世界研究[54]表明,与gBRCA未突变患者(中位OS为37个月)相比,gBRCA突变患者(中位OS为26个月)接受CDK4/6i治疗后的结局更差。一项纳入3 744例HER2-转移性乳腺癌患者的回顾性研究[52]显示,不伴BRCA突变的HR+/HER2-患者的中位OS为55.1个月(43.5~65.5个月),数值上优于伴BRCA突变的HR+/HER2-患者(中位OS为41.1个月,95% CI:31.5个月~NC)。中国台湾一项纳入480例遗传性乳腺癌患者的研究[55]显示,携带BRCA突变的乳腺癌患者的5年DFS率更低(73.3% vs 91.1%,HR=2.42,P=0.013),远处转移风险更高。另有一项纳入402例18~40岁乳腺癌患者的研究[56]发现,年轻BRCA突变患者的3、5和10年DFS率分别为85.7%、80.9%和58.1%,而年轻BRCA未突变患者为96.8%、95.9%和91.1%(P<0.001),年轻BRCA突变患者的3、5和10年OS率分别为98.4%、95.1%和87.8%,而年轻BRCA未突变患者为100.0%、99.7%和98.0%(P=0.002)。因此,与年轻BRCA未突变患者相比,年轻BRCA突变患者在疾病复发和生存期方面的预后显著更差。
⑴ 专家组意见:BRCA1/2基因突变与乳腺癌患者的预后相关性并不十分明确,现有研究结果不一致,需要更多的前瞻性研究进一步分析(证据等级3类)。
BRCA1/2基因检测的临床应用
BRCA1/2基因检测的临床意义
BRCA1/2基因是评估乳腺癌、卵巢癌和其他相关肿瘤患病风险的重要生物标志物,BRCA1/2基因检测能够指导遗传咨询、风险评估、预后判断及临床治疗决策。
BRCA1/2基因检测的人群
目前NCCN、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)、美国乳腺外科医师学会(American Society of Breast Surgeons,ASBS)等指南[57-61]对于BRCA基因检测人群的选择主要基于以下因素:确诊乳腺癌时患者年龄较低,有高风险家族史及TNBC患者,但对于BRCA基因检测建议的具体细节仍存在较大差异(如年龄、患者乳腺癌原发灶数量及家族史的定义等)。本共识专家组结合NCCN、ESMO等国外指南,以及中国现有的临床数据,提出推荐进行BRCA基因筛查的乳腺癌患者特征,具体如下(符合以下标准中的一条或多条即应考虑进一步的风险评估、遗传咨询,以及基因检测和管理。对于仅有家族史的个体应慎重解读基因检测结果,因其可能存在明显局限性):
⑴ ≤50岁发病;
⑵ 所有TNBC;
⑶ 所有男性乳腺癌;
⑷ 有已知的家族性致病性BRCA1/2基因 突变;
⑸ 存在第二原发性乳腺癌;
⑹ 任何年龄发病,同时满足≥1项以下家族史标准:① ≥1个直系亲属有≤50岁发病的乳腺癌史或卵巢癌史;② ≥1个直系亲属确诊男性乳腺癌、卵巢癌、转移性或中高危前列腺癌、胰腺癌;③ ≥2个旁系亲属确诊乳腺癌、卵巢癌、转移性或中高危前列腺癌、胰腺癌。
BRCA1/2基因检测的时机
对于符合以上标准的患者,应在确诊乳腺癌时尽早接受BRCA检测。此外,以指导临床治疗决策为目的时,可选择以下阶段进行BRCA检测:
⑴ 早期辅助阶段:① TNBC,术后病理学分期≥pN1期或≥pT2期,或新辅助治疗后未达到病理学完全缓解(pathological complete response,pCR);② HR+/HER2-乳腺癌,术后病理学检查发现≥4枚淋巴结阳性,或新辅助治疗后未达到pCR且临床病理学分期(clinical pathologic stage,CPS)+ER分级(ER grade,EG)评分≥3分。
⑵ 转移性阶段:① TNBC,初次确诊时,或预期更换治疗方案;② HR+/HER2-乳腺癌,既往经CDK4/6i治疗后进展。
BRCA1/2基因检测的样本选择
胚系检测一般使用血液、唾液、口腔拭子等样本,目前以血液(白细胞)样本为主,检测到的BRCA1/2突变为胚系突变。肿瘤检测一般使用手术或穿刺获得的肿瘤组织样本,肿瘤样本中检测到的BRCA1/2突变既可能是胚系突变,也可能为体细胞突变。基于当前的研究证据,乳腺癌患者优先推荐胚系BRCA检测。对于优先选择肿瘤组织检测的患者,如果结果为阳性,建议再次进行胚系检测予以明确。目前,循环肿瘤DNA(circulating tumor DNA,ctDNA)检测在乳腺癌中的应用仍以临床研究为主,其可靠性仍需要进一步研究验证。
⑵ 专家组意见:所有新诊断的TNBC、确诊年龄<50岁的乳腺癌及有家族史的患者都应该尽早接受胚系BRCA检测(证据等级2A类)。
BRCA1/2基因突变乳腺癌的治疗决策
BRCA1/2基因突变乳腺癌患者的非药物治疗
1 手术治疗
gBRCAmut患者行保乳手术是否增加同侧乳腺癌的局部复发率,是影响患者选择保乳或全切手术的重要因素。针对中国人群的研究[62]显示,与全切手术相比,在随访7年时,BRCA突变患者接受保乳手术未显著增加局部复发率(3.90% vs 20%,P=0.16),但患者同侧新发乳腺癌比例显著增加(3.90% vs 0.60%,P=0.01)。生存方面,BRCA突变患者接受保乳手术和全切手术相比,BCSS和OS差异无统计学意义[63]。荷兰一项多中心研究[64]也得到同样结论。
⑶ 专家组意见:保乳手术可以作为携带gBRCAmut的乳腺癌患者的手术方式选择(证据等级2A类)。
2 放疗
随着保乳手术的增多,术后放疗在临床中越来越多地被采用,不过暂无针对携带gBRCAmut患者放疗方案选择的研究证据。值得注意的是,有研究[65]表明,携带gBRCAmut的患者接受保乳手术联合放疗的方案,其同侧/对侧乳腺癌局部复发风险均高于非突变患者,提示该部分患者应该严密随访。目前,放疗是否会增加患者对侧乳腺癌的患病风险仍不明确。一项纳入3 602例患者的前瞻性研究[66]随访超过9年,结果显示,接受术后辅助放疗患者的对侧乳腺癌的发生风险高于未接受放疗组(HR=1.44,95% CI:1.12~1.86),其中携带gBRCA2基因突变的发生风险更高(HR=1.77,95% CI:1.13~2.77)。临床前研究[67]证实,olaparib能够作为放疗增敏剂,与放疗发挥协同作用,增强疗效。一项Ⅰ期临床研究[68]证实了辅助放疗联合olaparib在早期TNBC中的初步疗效和安全性。未来,保乳手术后辅助放疗联合PARPi强化治疗可能成为BRCAmut早期患者的治疗方案选择。
BRCA1/2基因突变的TNBC患者
1 早期辅助治疗
BRCA基因编码蛋白通过同源重组参与DNA DSB修复,BRCA1/2基因突变的乳腺癌患者由于HRR功能缺陷,可能对铂类药物或PARPi等致DNA损伤药物更为敏感[69-75]。
PARP是对DNA单链断裂进行有效修复所必需的。当PARPi与DNA相关的PARP活性位点结合,能够抑制其酶活性,同时将其捕获在DNA上,从而阻滞修复。当复制叉遇到PARP DNA复合物时,会引起DNA DSB。在BRCA1/2基因突变导致的HRR功能缺陷肿瘤中,DNA DSB无法得到准确或有效的修复,替代性和易错配通路被激活,如典型的非同源性末端连接(non homologous end joining,NHEJ)通路,引起基因组的不稳定性增加,从而导致肿瘤细胞凋亡[76-78]。
OlympiA试验[79-80]是首个针对携带gBRCAmut且伴高危因素HER2-乳腺癌辅助治疗,且取得OS获益的大型Ⅲ期临床研究,该研究共纳入1 836例既往接受过局部治疗和化疗(新辅助治疗或辅助治疗)的携带致病性或可能致病的BRCA1/BRCA2胚系突变的HER2-高危早期乳腺癌患者,结果显示,相比于安慰剂组,olaparib组无浸润性疾病生存期(invasive disease-free survival,IDFS)达到3年的患者比例更高(85.90% vs 77.10%),疾病复发、出现新肿瘤或死亡的风险降低42%(HR=0.58,P <0.001);olaparib组无远处转移生存期(distant disease-free survival,DDFS)达到3年的患者比例同样更高(87.50% vs 80.40%),患者的远处转移风险降低43%(HR=0.57,P <0.001);4年OS率分别为89.8%和86.4%,olaparib组死亡风险降低32%(HR=0.68,P=0.009),差异均有统计学意义。2024年圣·安东尼奥乳腺癌会议(San Antonio Breast Cancer Symposium,SABCS)公布了OlympiA试验中位随访6.1年的结果[81],长期随访带来持续的IDFS、DDFS及OS疗效获益且未观察到新的安全性信号,6年IDFS率差值为9.4%(HR=0.65,95% CI:0.53~0.78),6年DDFS率差值为7.8%(HR=0.65,95% CI:0.53~0.81),6年OS率差值为4.4%(HR=0.72,95% CI:0.56~0.93)。此外,研究中TNBC人群超过80%,患者在新辅助治疗后未达到pCR,或辅助治疗后术后病理学分期≥pT2期或≥pN1期,TNBC亚组患者接受1年olaparib辅助治疗可以显著提高6年IDFS率(HR=0.65,95% CI:0.53~0.81),可降低近35%的疾病复发、新发及死亡风险。基于OlympiA试验的积极结果,2022年3月美国FDA批准olaparib作为携带gBRCAmut的高风险HER2早期乳腺癌患者的辅助治疗方案,2024年12月国家药品监督管理局(National Medical Products Administration,NMPA)批准olaparib早期乳腺癌的适应证,适用于接受过新辅助化疗或辅助化疗的携带有害或疑似有害gBRCAmut HER2-早期高风险成年乳腺癌患者的辅助治疗。这是目前首款也是唯一一款获批用于BRCA突变早期乳腺癌患者的治疗方法。
在早期TNBC患者的辅助治疗中,KEYNOTE-522研究[82]显示,PD-1抑制剂能够显著减少早期TNBC患者的疾病复发风险。KEYNOTE-522研究是一项随机、双盲、前瞻性、国际多中心的Ⅲ期临床试验,纳入符合条件、既往未经治疗、非转移性的TNBC患者,按2∶1的比例被随机分配至两组,1组接受帕博利珠单抗新辅助治疗,另1组为安慰剂对照组,两组均同时接受4个周期的紫杉醇联合卡铂治疗,后续接受4个周期的多柔比星或表柔比星联合环磷酰胺治疗。手术治疗后,患者继续接受9个周期的帕博利珠单抗或安慰剂辅助治疗,直至疾病复发或出现不可耐受的不良反应。结果显示,在早期TNBC患者中,帕博利珠单抗联合新辅助化疗较单纯化疗能够显著提高pCR率(64.80% vs 51.20%,P<0.001)。该研究结果支持帕博利珠单抗联合化疗作为早期TNBC患者新辅助治疗的有效方案[83]。2024年SABCS公布了HRD的pCR和无事件生存期的探索性分析结果,HRD+(n=738,78%)的HR=0.67(95% CI:0.46~0.96),HRD-(n=152,16%)的HR=0.62(95% CI:0.33~1.19),帕博利珠单抗联合化疗与单独化疗相比在HRD亚组中疗效具有优势[84]。但该研究并未针对gBRCAmut人群进行亚组分析,目前仍缺乏两药在携带gBRCAmut的TNBC人群中的直接对比,OlympiA试验仍是目前唯一针对gBRCAmut人群且取得明确OS获益证据的Ⅲ期临床试验。临床前证据显示,PARPi与ICI之间存在协同效应,且两药的不良反应并不重合,Ⅱ期研究I-SPY2[85]结果提示olaparib联合durvalumab新辅助治疗能够显著提升TNBC患者的pCR率(47% vs 27%)。未来,PARPi和ICI的联合治疗可能成为gBRCAmut伴高危早期TNBC的辅助治疗方案选择。
CREATE-X和GEICAM研究[86-88]证实了卡培他滨在TNBC术后辅助治疗中的效果,但未针对gBRCAmut进行亚组分析,病理学检查结果显示,卡培他滨对基底样肿瘤的疗效不佳,而gBRCAmut患者通常表现为基底样肿瘤,提示卡培他滨对gBRCAmut人群的疗效并不肯定。
在BRCAmut患者的新辅助化疗/辅助化疗方案选择中,GeparSixto研究[89]结果显示,在新辅助化疗中加入卡铂不能改善pCR率。一项在中国开展的多中心PATTERN研究[90]显示,与传统蒽环类药物联合紫杉类药物的方案相比,紫杉类药物联合卡铂的辅助化疗可以提高TNBC患者的5年DFS率(86.5% vs 80.3%,HR=0.65,P=0.03),且在胚系BRCA1/2基因突变亚组中观察到相似的生存获益,只是该研究的样本量较小。
目前,PARPi在新辅助治疗中的应用仍在探索之中,多项Ⅱ期研究显示出PARPi联合或不联合化疗能够达到50%~60%的pCR率,但与单纯化疗相比,并不能显著提升pCR率。2024年美国癌症研究协会(American Association for Cancer Research,AACR)年会上公布的PARTNER研究[91]显示,在含铂类药物方案的新辅助治疗中加入olaparib间隔给药,即便未能改善pCR率,但能够显著提高gBRCAmut患者的无事件生存率和OS。
⑷ 专家组意见:对于携带gBRCAmut的早期TNBC,新辅助化疗/辅助化疗是否选择含铂类药物方案仍需进一步探索;若患者新辅助治疗后未达到pCR,或手术+辅助治疗后病理学分期≥pT2期或≥pN1期,可以考虑使用olaparib进行1年辅助强化治疗(1A类证据)。
2 晚期挽救治疗
目前多项Ⅲ期临床研究已证实PARPi在携带BRCA1/2突变晚期TNBC中的疗效,包括OlympiAD(olaparib)、EMBRACA[他拉唑帕利(talazoparib)]和BROCADE3[维利帕尼(veliparib)][92-94]。其中OlympiAD研究[92]共纳入150例转移性TNBC,患者入组前最多接受两线化疗,结果显示,olaparib组与标准化疗组相比降低了gBRCAmut TNBC 57%的疾病进展风险,无进展生存期(progression-free survival,PFS)延长约2.7个月(5.6个月 vs 2.9个月,HR=0.43,95% CI:0.29~0.63)。Olaparib组客观缓解率(overall response rate,ORR)达54.7%,显著高于化疗组(21.2%),同时与对照组相比,生存质量更好。尽管OS无显著差异(17.4个月 vs 14.9个月,HR=0.93,P>0.05),但探索性分析[95]显示,作为一线治疗时,olaparib的获益更佳。EMBRACA和BROCADE3研究[93-94]均取得一致的研究结果,PARPi可以改善BRCA突变晚期TNBC的PFS,但不能改善OS。考虑到TNBC的治疗方案有限,目前美国FDA批准了Lynparza(olaparib)、Talzenna(talazoparib)用于治疗携带BRCA基因突变的HER2-转移性乳腺癌的治疗。
⑸ 专家组意见:对于伴有BRCA基因突变的晚期或复发转移性乳腺癌患者,可以选择PARPi如olaparib作为化疗的替代方案(证据等级2A类)。
有研究[44,96]显示,BRCA1/2基因突变的乳腺癌细胞对导致DNA交联的药物更加敏感,如顺铂、卡铂和丝裂霉素等。TNT研究[97]结果显示,胚系BRCA1/2基因突变患者中接受卡铂治疗组的ORR为多西他赛治疗组的2倍(68.0% vs 33.3%,P=0.030),PFS也显著延长(6.8个月 vs 4.4个月,P=0.002),但该研究中纳入胚系BRCA1/2基因突变患者数量过少(n=43)。另一项铂类单药治疗86例mTNBC患者的多中心单组Ⅱ期临床研究(TBCRC009研究)[98]也得到类似结果,BRCA1/2基因突变携带组(n=11)的ORR为54.5%,BRCA1/2非基因突变携带组(n=66)的ORR为19.7%(P=0.02)。一项针对中国人群的回顾性研究[99]也证实含铂类药物化疗在携带BRCA1/2突变晚期TNBC患者中的疗效优于不含铂类药物的方案。
目前,ICI、抗体药物偶联物(antibody-drug conjugate,ADC)等新机制的药物已经被用于晚期TNBC的治疗,但针对携带BRCA突变的患者,尚无证据表明PARPi与这些新方案孰优孰劣。一项Ⅰ/Ⅱ期研究MEDIOLA[43]证实PD-L1抑制剂durvalumab联合olaparib在BRCA突变晚期乳腺癌中具有一定的疗效,共入组18例晚期TNBC患者,结果显示,中位PFS为4.9个月,中位OS为20.5个月,ORR超过50%。多项PARPi的联合方案,包括ICI、ADC等均在进行早期临床探索。
⑹ 专家组意见:对于伴有BRCA基因突变的晚期或复发转移性TNBC,优先选择PARPi如olaparib作为化疗的替代方案(证据等级2A类);制订化疗方案时可以优先考虑铂类药物而非紫杉类药物(证据等级2B类)。
BRCA1/2基因突变HR+乳腺癌患者
1 BRCA1/2突变HR+乳腺癌的辅助治疗
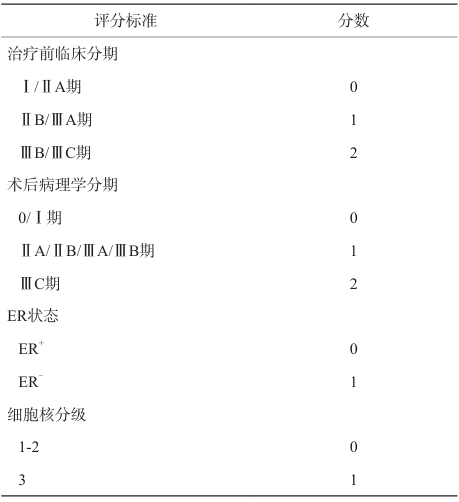
OlympiA研究[81]同样纳入部分HR+ gBRCAmut的高危人群,要求新辅助治疗后未达到pCR且CPS+EG评分≥3分(表1),或辅助治疗后≥4枚阳性腋窝淋巴结的患者可以入组,共入组325例HR+ gBRCAmut患者,约占总体人群的18%,其中超85%的患者接受联合内分泌治疗。结果显示,HR+亚组人群的临床获益与全人群保持一致,1年olaparib辅助强化治疗能够提高这部分患者的6年IDFS率(HR=0.68,95% CI:0.44~1.05),可降低近32%的疾病复发、新发及死亡风险,与研究中的TNBC患者获益相似。基于OlympiA研究的积极结果,美国FDA及NMPA均批准olaparib用于HER2-高危早期乳腺癌患者的适应证。
表1 CPS+EG评分表
在HR+早期高危乳腺癌的辅助治疗中,monarchE和NATALEE研究显示CDK4/6i辅助治疗能减少这部分患者的复发风险,但CDK4/6i对于HR+人群尚未获得OS阳性结果,monarchE研究[100]公布了gBRCAmut的IDFS率[1/20 vs 9/21,HR=0.14(0.01~1.30)],该结果为探索性结果,在这些亚组中,样本量较小,HR估计值高度不稳定,无法得出确切结论。NATALEE研究[101]尚未针对gBRCAmut患者进行亚组分析。目前仍无CDK4/6i与olaparib针对gBRCAmut HR+早期乳腺癌患者的直接对比,优选哪种药物或是否考虑两种药物联合/序贯治疗存在争议。OlympiA研究是目前唯一针对gBRCAmut人群取得明确OS获益证据的Ⅲ期临床研究。
对于部分极高危患者,最终或许可以考虑这两种药物序贯治疗。在这种情况下,注册研究中的给药时间可能有助于选择顺序。在OlympiA研究中,在初始治疗后最长间隔2个月使用olaparib,而在monarchE研究中,在根治性手术后最长间隔16个月使用阿贝西利,因此可能首先开始olaparib治疗。然而,该策略的有效性或安全性尚未得到评估,因此应谨慎考虑。
KEYNOTE-765、CheckMate-7FL[102-103]的早期数据显示,HR+早期乳腺癌患者接受新辅助治疗+ICI联合化疗,pCR率均有所改善。未来,针对携带gBRCAmut的高危患者,olaparib、CDK4/6i、ICI的选择和排列组合需要进一步研究来指导临床决策。
⑺ 专家组意见:对于携带gBRCAmut的HR+早期乳腺癌,若患者新辅助治疗后未达到pCR且CPS+EG评分≥3分,或辅助治疗后≥4枚阳性腋窝淋巴结,可以考虑使用olaparib进行1年辅助强化治疗(证据等级1A类)。
2 晚期挽救治疗
目前多种PARPi被证实在转移性HER2-且携带gBRCAmut患者中的疗效,亚组分析显示,HR+患者也能从PARPi治疗中获益[93-95]。OlympiAD和EMBRACA研究[92-93]分别比较了olaparib和talazoparib对比单药化疗在该人群中的效果。在OlympiAD研究[92]中,约50%的患者为HR+,入组要求患者转移阶段至少接受过1次内分泌治疗,结果显示,与化疗相比,尽管olaparib未能显著延长PFS,但ORR提升达29%(65.4% vs 36.4%)。而在EMBRACA研究[93]中,talazoparib能够显著延长HR+患者的PFS(HR=0.47,95% CI:0.32~0.71,P=0.000 2)。此外,BROCADE3研究[94]也进一步证实维利帕利在维持治疗中的疗效。但3项研究均未取得OS获益。LUCY研究[104]为一项前瞻性真实世界研究,其HR+组接受olaparib治疗的中位PFS为8.34个月。
CDK4/6i联合内分泌治疗是目前HR+/HER2-晚期乳腺癌患者的一线治疗选择,但相关注册研究均未预设针对gBRCAmut的亚组分析。PADA-1研究[105]的探索性分析显示,携带gBRCAmut和gPALB2mut患者接受帕博西利联合芳香化酶抑制剂(aromatase inhibitor,AI)的PFS比非突变患者更短(14.3个月 vs 26.7个月,HR=0.59,95% CI:0.20~1.02,P=0.056)。此外,真实世界回顾性研究[106]表明,与散发性乳腺癌患者相比,携带gBRCAmut的患者接受CDK4/6i治疗的治疗反应更差。
由于缺乏PARPi与CDK4/6i联合内分泌治疗在携带gBRCAmut的HR+/HER2-晚期患者中的直接比较,对于这部分患者,PARPi的最佳使用时机仍不确定。未来需要更多前瞻性研究来直接比较两种药物的疗效。此外,一项Ⅰ/Ⅱ期HOPE研究[107]正在探索olaparib联合帕博西利和内分泌治疗一线治疗携带BRCAmut的HR+/HER2-晚期患者的疗效和安全性。
⑻ 专家组意见:对于携带gBRCAmut的HR+/ HER2-晚期患者,可以考虑选择PARPi如olaparib作为化疗的替代方案(证据等级2A类)。
PARPi的临床使用和不良反应管理
目前,国内已经上市的PARPi包括olaparib、尼拉帕利(niraparib)、氟唑帕利(fluzoparib)和帕米帕利(pamiparib),均已获批用于卵巢癌的治疗;其中olaparib还获批用于前列腺癌的治疗。在全球范围内,olaparib已获批用于乳腺癌辅助强化治疗和晚期乳腺癌的治疗,fluzoparib已在国内获批用于晚期乳腺癌的治疗,talazoparib被美国FDA批准用于晚期乳腺癌的治疗。
大多数PARPi均通过肝内细胞色素P450酶(cytochrome P450,CYP)途径代谢。Olaparib也通过该途径代谢,应避免olaparib与中/强效的CYP3A抑制剂联合使用,临床必需使用时应降低剂量且密切观察;也应避免与中/强效的CYP3A诱导剂联合使用,联合使用可能会导致疗效 降低[108]。
PARPi的不良反应与其在靶效应和脱靶效应有关。PARPi靶向抑制PARP-1/2蛋白发挥抗肿瘤效应,但PARP-1/2与正常骨髓细胞生理功能相关,因此可导致贫血等在靶不良反应。脱靶效应与抑制其他多种磷酸激酶相关:抑制肾转运蛋白,可能引起肌酐异常;影响5-羟色胺,可能导致高血压;影响离子转运蛋白,可能导致低镁血症[109]。其中关于olaparib,临床前研究[110]数据表明其脱靶效应较弱,临床研究[92]也未见相关不良反应报道。
PARPi的不良反应主要包括血液学不良反应和非血液学不良反应,前者主要为贫血,后者主要包括胃肠道不良反应等。使用PARPi前1个月内应每周进行血常规检查,之后每个月进行血常规检查。当出现1~2级的贫血时,应予以支持治疗,可适当补充铁剂、叶酸和使用中药等;当出现≥3级的贫血时,应暂停治疗,给予促红细胞生成素或采取输血等措施,待血红蛋白恢复至90 g/L以上时,予以PARPi减量治疗;当出现中性粒细胞减少时,进行1~2级监测并继续PARPi治疗,3~4级时暂停用药并监测直至中性粒细胞恢复到≥1.5×109/L[111-112]。
胃肠道不良反应通常是导致早期患者依从性差的主要原因。恶心、呕吐为PARPi最常见的不良反应,多表现为1~2级;恶心的发生率约为58%,呕吐的发生率为23%~30%。尽管低级别不良反应居多,但这类药物不像静脉化疗药一样短时间使用,而是需要长期每天服用。预防措施包括提前30 min服用5-HT受体拮抗剂,不推荐使用其他呕吐预防措施,如地塞米松和NK1受体拮抗剂,前者会影响肝药酶CYP的代谢从而降低PARPi的疗效,后者阿瑞匹坦、奈妥吡坦等是CYP3A抑制剂。也可尝试临睡前30 min少量饮食后服药、药物与食物同服等方法。另外,需对症支持治疗,保持水电解质平衡[111-112]。
BRCA1/2基因突变患者和携带者的随访管理
BRCA1/2基因突变的遗传咨询
为保障对遗传高风险人员进行规范的肿瘤遗传学专业评估,共识推荐有条件的医院或肿瘤中心建立乳腺癌遗传咨询门诊。具体评估内容包括以下几个方面:
⑴ 患者需求和关注:主要向患者介绍用于癌症风险评估的基因检测,包括其益处、风险和局限性;让患者了解通过癌症家庭风险评估能够实现哪些目标;同时告知患者哪些亲属也需要进一步咨询及进行相应检测(如孕前检测)。
⑵ 家族史:对家族史的询问需要进一步拓展,这些信息主要围绕被诊断为癌症的个体,近亲包括三代亲属;了解并采集家族内癌症患者所患的癌症类型、单双侧和诊断年龄;每例患者的化学预防史和(或)降风险手术史;收集必要的医疗记录文档,尤其需要原发癌的病理学诊断报告。
⑶ 详细的医疗史和手术史:针对患者个人,采集详细的肿瘤病史,包括诊断年龄、病变组织学类型及部位;询问并记录患者致癌物暴露情况(如放疗史);个人的孕产史;激素或口服避孕药的使用情况;前期的乳腺活组织检查和病理学检查结果;是否有风险降低性输卵管-卵巢切除术(risk-reducing salpingo-oophorectomy,RRSO)史。
⑷ 专项查体:需要由有资质的内科医师实施,明确患者乳腺癌或卵巢癌的基本情况;为了鉴别诊断,同时需要进行针对多发性错构瘤综合征/PTEN错构瘤综合征(PTEN hamartoma tumor syndrome,PHTS)的专项检查,主要包括皮肤、口腔黏膜、头周长和甲状腺检查。
⑸ 其他检测:完成以上评估后,还需继续考察咨询者是否符合BRCA相关的HBC-卵巢癌综合征、利-弗劳梅尼综合征或多发性错构瘤综合征/ PHTS各自对应的靶向基因检测标准,或更适合进行多基因检测。
BRCA1/2基因突变携带者乳腺癌风险管理
乳腺肿瘤的监测以临床触诊结合影像学检查为主。影像学检查以超声、乳腺X射线摄影及磁共振成像(magnetic resonance imaging,MRI)为主要检测手段,不同影像学方法各有优缺点(表2)。鉴于中国女性乳房较致密,且HBC年轻患者相对较多,乳腺X射线摄影筛查检出率较低。多项前瞻性研究[113-116]比较BRCA基因突变者不同筛查手段,发现MRI检出率为77%,而乳腺X射线摄影为36%,超声为33%。有研究[117-118]发现,BRCA基因突变携带者每年通过MRI检测,可以显著降低晚期乳腺癌的发生率。每年1次MRI和乳腺X射线摄影检查相结合,可以使BRCA1基因突变者的生存期延长2年,使BRCA2基因突变者的生存期延长18个月[119]。虽然超声联合乳腺X射线摄影检查可提高肿瘤检出率,但有研究[120-121]结果表明,在肿瘤检出方面MRI优于超声,特别是在已知或怀疑BRCA基因突变的情况下。
表2 BRCA基因突变携带者的影像学监测建议

BRCA基因检测结束后应告知被检者及其亲属可能的癌症遗传风险及其风险评估和管理策略。如果检测到已知的BRCA致病性突变,则可按照表3中的方案进行管理及预防。
表3 不同BRCA突变阳性携带者人群对应的管理方案

⑼ 专家组意见:建议在有条件的地区,对于BRCA基因突变携带者首选MRI检查,时间间隔为6个月(证据等级1A类);对于没有条件进行MRI检查的地区或人群,可以考虑超声联合乳腺X射线摄影检查(证据等级3类);风险降低性乳腺切除术(risk-reducing mastectomy,RRM)后的患者术前可考虑行MRI检查(证据等级3类);RRM后若无明显乳腺组织残留,可不必行影像学复查(证据等级3类);对于未进行RRM的患者,可考虑使用降低乳腺癌风险的药物(证据等级3类)。
BRCA1/2基因突变携带者其他肿瘤风险管理
1 卵巢癌风险管理
卵巢癌的监测以经阴道超声和血清糖类抗原125(carbohydrate antigen 125,CA125)检查为主。经阴道超声和CA125筛查可提高早期诊断率,改善手术R0切除率;对于携带BRCA1/2基因突变的高危人群,推荐行RRSO,可能带来一定的生存获益。国际上一项纳入年轻乳腺癌BRCA携带者的研究[122]显示,风险降低性双侧乳腺切除术(bilateral risk-reducing mastectomy,BRRM)及RRSO均与OS、DFS及乳腺癌无病间隔期改善显著相关。同时超声检查者的技术和经验会在很大程度上影响筛查阳性率,并在许多情况下能提前将诊断缩窄到特定的组织学亚型[123-124]。虽然既往研究[125]表明,口服避孕药可使卵巢癌的发生率降低40%~60%,但鉴于BRCA1/2基因突变携带者在卵巢癌相关风险年龄前推荐行RRSO,目前口服避孕药作为降低卵巢癌风险措施的长期临床意义尚不清楚。
由于目前仍缺乏可靠的早期检测筛查手段,RRSO仍是最有效的预防卵巢癌和输卵管癌的手段。手术范围应包括双侧卵巢及输卵管,并应将切除组织冻存。在确定RRSO的时机之际,应考虑基因突变类型、患者的意愿和家族史,将其延迟至卵巢癌风险超过普通人群的年龄。过早进行RRSO可能对女性的健康产生负面影响,包括由提前绝经带来的后果(骨质疏松症、认知功能障碍、心血管疾病和早期死亡的风险增加),因此适当的时机选择至关重要。在BRCA2基因突变携带者中,卵巢癌发病年龄平均比BRCA1基因突变携带者晚8~10年。因此推荐在BRCA1基因突变携带者和BRCA2基因突变携带者在完成生育后,分别在35~40岁和40~45岁之间进行RRSO[126]。
⑽ 专家组意见:对于BRCA1/2基因突变携带者来说,降低卵巢癌风险最有效的策略是进行RRSO(证据等级2A类);对于已完成生育的女性,BRCA1基因突变携带者应在35~40岁进行RRSO,而BRCA2基因突变携带者应在40~45岁进行RRSO,同时应将家族史作为手术时机的参考依据之一(证据等级2B类);降低风险的单纯输卵管切除术(单独的双侧输卵管切除或双侧输卵管切除后延迟卵巢切除)在非临床研究的情况下不予推荐(证据等级3类)。
2 前列腺癌及胰腺癌风险管
理既往研究[127-128]表明,BRCA2基因突变与前列腺癌的患病风险增加有关,但目前暂无证据证明BRCA1基因突变与前列腺癌的患病风险的相关性。当设定前列腺特异性抗原(prostate-specific antigen,PSA)阈值为3.0 ng/mL时,肿瘤可能在早期阶段就被检测到,因此推荐BRCA2基因突变携带者进行前列腺癌筛查。
虽然部分指南推荐胰腺癌相关基因突变个体进行胰腺癌筛查,但暂无明确证据表明胰腺癌筛查对于BRCA1/2基因突变携带者有明显生存率改善。尽管如此,一项胰腺癌高风险患者的筛查研究[129]结果显示,绝大多数通过筛查检测到的胰腺癌为Ⅰ期,提示BRCA1/2基因突变携带者在胰腺癌筛查中有生存获益可能。
⑾ 专家组意见:推荐超过40岁的男性BRCA2基因突变携带者每年进行血液PSA筛查(证据等级2B类);BRCA1/2基因突变携带者若至少有1个一级或二级亲属患有外分泌胰腺癌,可以考虑从50岁开始(或比患病亲属年轻5~10岁)每年进行增强MRI/超声内镜筛查(证据等级3类);BRCA1/2基因突变携带者的胰腺癌筛查推荐作为临床研究的一部分进行(证据等级2A类)。
BRCA1/2基因突变乳腺癌患者的生育
临床前证据[130]表明,BRCA的功能与DNA DSBR及卵巢老化有关。虽然目前临床证据仍存在争议,但不能排除BRCA1/2基因突变对女性卵巢储备和生殖能力可能产生的负面影响。在男性BRCA1/2基因突变携带者中,虽然性腺功能表现正常,但目前数据有限,尚无定论[80]。因此鼓励在RRSO推荐年龄之前完成生育,否则推荐在年轻时进行卵子和胚胎的冷冻保存,其流程与癌症患者化疗前生育保护方案类似[131]。伴有HBC-卵巢癌综合征的BRCA1/2基因突变携带者推荐接受产前诊断或胚胎植入前遗传学检测,以避免遗传性基因突变遗传给下一代[132]。咨询过程中作出任何决定都应注意保护患者夫妻双方的自主选择权。
目前常用的避孕方式仍为基于激素的口服避孕药、避孕注射剂/植入物及孕激素宫内节育器。尽管目前无明确禁忌证,但对于未受影响的BRCA1/2基因突变携带者在有条件的情况下仍推荐使用非激素避孕方法,尽量减少外源性激素的使用时间。值得注意的是,使用他莫昔芬化学性预防的患者由于静脉血栓风险升高,应避免与口服避孕药联用。
⑿ 专家组意见:健康的女性BRCA1/2基因突变携带者鼓励在RRSO推荐年龄之前完成生育(证据等级1A类);若上述条件无法达到,推荐在年轻时进行卵子和胚胎的冷冻保存(证据等级2B类);伴有HBC-卵巢癌综合征的BRCA1/2基因突变携带者推荐接受产前诊断或胚胎植入前遗传学检测(证据等级1A类)。
BRCA1/2基因突变携带者的预防措施
BRCA1/2基因突变携带者的预防措施包括药物预防和手术预防。
药物预防
已有3项前瞻性大型临床试验(NSABP-P1试验[133]、IBIS-1试验[134]和STAR试验[135])显示,选择性ER调节剂(selective ER modulator,SERM)类药物对于乳腺癌高危人群有预防作用。NSABP-P1研究[133]结果显示,与安慰剂组(8例)相比,接受他莫昔芬治疗(3例)可使BRCA2基因致病性突变健康携带者发生乳腺癌的风险降低62%(HR=0.38,95% CI:0.06~1.56),但他莫昔芬无法降低BRCA1基因致病性突变健康携带者发生乳腺癌的风险,这可能与BRCA1基因致病性突变健康携带者发生ER-乳腺癌比例更高有关。由于该研究纳入的BRCA1/2突变患者过少(仅19例),所以证据不够充分。目前为止,尚无有力证据证明应用他莫昔芬及其类似药物预防BRCA相关性乳腺癌的有效性。最近研究[136]发现,参与雌激素依赖性调节BRCA1表达的基因ZNF423和CTSO已经检测出常见的单核苷酸多态性,且与SERM治疗期间发生乳腺癌的风险变化有关,这一研究成果可能为药物预防BRCA基因致病性突变健康携带者发生乳腺癌提供新思路。
两项大型预防性临床研究[137-138]结果显示,AI不仅可降低绝经后妇女浸润性乳腺癌的发生率,而且可用于乳腺癌早期患者对侧乳腺癌的预防。但迄今为止,尚无证据支持AI可以用于预防BRCA1/2基因致病性突变携带者发生乳腺癌。另一项回顾性研究[139]结果显示,ER+ BRCA1/2基因致病性突变的乳腺癌患者辅助治疗使用AI,可能会降低罹患对侧乳腺癌的风险。
关于口服避孕药是否会增加BRCA1/2突变携带者的乳腺癌患病风险目前尚存在争议,但有研究[140]结果显示,口服避孕药可增加BRCA1/2基因致病性突变健康携带者发生乳腺癌的风险或无相关性。
⒀ 专家组意见:目前对BRCA基因致病性突变健康携带者的药物预防效果,还需要进一步研究确认(证据等级3类)。但对于ER+ BRCA基因突变的乳腺癌患者,可以推荐使用内分泌治疗预防罹患对侧乳腺癌(证据等级2B类)。
手术预防
手术预防的方式主要包括RRM及预防性双侧输卵管卵巢切除术(prophylactic bilateral salpingo-oophorectomy,PBSO)。早期基于受试者家族史区别危险程度的回顾性分析[141-143]发现,中高危患者采取BRRM可降低约90%的乳腺癌患病风险,其中亚组分析结果显示,BRRM可降低BRCA突变基因携带者85%~100%的乳腺癌患病风险。前瞻性非随机队列研究[144]经过6.4年随访发现,BRRM可以降低BRCA基因突变者95%的乳腺癌患病风险。目前尚无明确的生存获益分析,通过分析决策模型显示,突变基因携带人群接受BRRM可获得约3年的生存获益[145]。2023年SABCS上公布的一项纳入2 482例BRCA1基因突变的乳腺癌患者的研究[146],随访超过15年,结果显示,BRRM未能显著降低乳腺癌的死亡风险(HR=0.78,95% CI:0.55~1.13,P=0.19)。北京大学肿瘤医院的一项研究[147]建立了BRCA突变乳腺癌患者的对侧乳腺癌发病率预测模型,该模型共纳入18项与乳腺癌风险相关的遗传和非遗传因素,结果表明,患者确诊年龄≤45岁、具有肿瘤家族史、突变位点靠近羟基3’端、未接受内分泌治疗是对侧乳腺癌的高危因素,该模型可用于指导临床决策中是否推荐BRRM。同时,随着重建手术的广泛使用,术后并发症也需要引起关注。有研究[148]表明,无论使用自体重建还是假体重建,预防性切除术后并发症的发生风险均增加。一项前瞻性队列研究[149]对112例BRRM后接受即刻乳房重建术的患者进行了2.8年随访,其中10%发生出血,9%发生感染,14%发生包膜挛缩,33%的女性患者需要再次手术。除此之外,社会心理学问题也应重视,手术前应进行多学科评估,也应有整形科医师共同参与。
在BRCA突变基因携带者中仅行PBSO可显著降低总死亡率和妇科癌症相关死亡率[150],但PBSO能否降低乳腺癌的患病风险和死亡率,目前结论仍不一致[151]。一项随访超过15年的登记研究[152]结果表明,BRCA1/2突变携带者接受PBSO后5年内的乳腺癌发病率均降低,但5年后对降低患病风险的影响减弱,尤其是针对BRCA2携带者。临床实践中应邀请妇科肿瘤医师进行多学科讨论,共同决策。
⒁ 专家组意见:对于携带BRCA基因突变的健康人群,预防性切除可以减少肿瘤的发生风险,但是否能改善总体生存仍需进一步观察。临床实践中,应同时考虑BRCA突变者的年龄、家族史等情况,与之充分沟通患病风险和手术并发症情况,共同决策是否进行BRRM。对于小于50岁的年轻高危患者可以推荐尽早行PBSO以取得最大获益(证据等级2B类)。
BRCA1/2基因突变的检测规范
BRCA基因检测流程
1 检测前咨询
采集全面的临床信息,包括发病年龄、民族、详细病史、手术史、用药史、分子分型、病理学亚型及单/双侧等;询问家族史信息,包括一级、二级及三级双方亲属是否有乳腺癌、卵巢癌、前列腺癌及胰腺癌病史;咨询被检者及其家族成员中是否有人已进行过BRCA1/2基因检测;评估被检者的患病风险;告知被检者关于乳腺癌遗传方式、外显率、遗传异质性及突变多样性的相关知识;告知被检者检测潜在的风险、可能的检测结果局限性(包括无法提供信息的结果或阴性检测结果以及结果可能会更新的现实)以及检测费用,并签署知情同意书。整个咨询过程应遵守自愿原则。
2 突变检测及验证
① 家族有人已进行过BRCA1/2基因检测且存在已知突变位点:建议采用一代测序技术检测家族特异位点;② 家族中未存在已知突变位点或家族中从未进行过BRCA基因检测:建议采用二代测序(next-generation sequencing,NGS)技术结合大片段缺失检测方法检测BRCA1/2基因的全部外显子以及外显子与内含子连接区域±20 bp。
3 检测后咨询
无论检测结果如何,检测后咨询都很重要。根据NCCN指南[57],检测后咨询可以当面进行,也可以远程进行。向被检者详细解释检测结果并针对检测结果制订相应的风险管理计划;向被检者推荐一些临床帮助,如参与药物临床试验及其他疾病互助资源;向有生育需求的被检者,提供产前诊断和辅助生殖的选择;评估检测结果对咨询者情感和行为的影响并针对性地给予心理疏导;建议家族中其他高风险成员进行BRCA基因检测。
BRCA基因检测的质量控制
NGS由于其低成本、高通量的特点,已成为BRCA1/2基因胚系突变(遗传性突变)和体细胞突变(获得性突变)检测的主流技术。随着NGS的广泛应用,对NGS技术进行质量控制已经成为临床实验室的迫切需求。美国病理学家协会(College of American Pathologists,CAP)于2014年发布了《二代测序实验室检测标准》[153],中国也先后发布了《临床分子病理实验室二代基因测序检测专家共识(2017年)》[154]、《二代测序技术在肿瘤精准医学诊断中的应用专家共识》[155]、《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》[156]及2023年10月开始实施的《BRCA基因突变检测试剂盒及数据库通用技术要求(高通量测序法):YY/T 1865—2002》[157]等对NGS进行规范的技术质量控制文件。
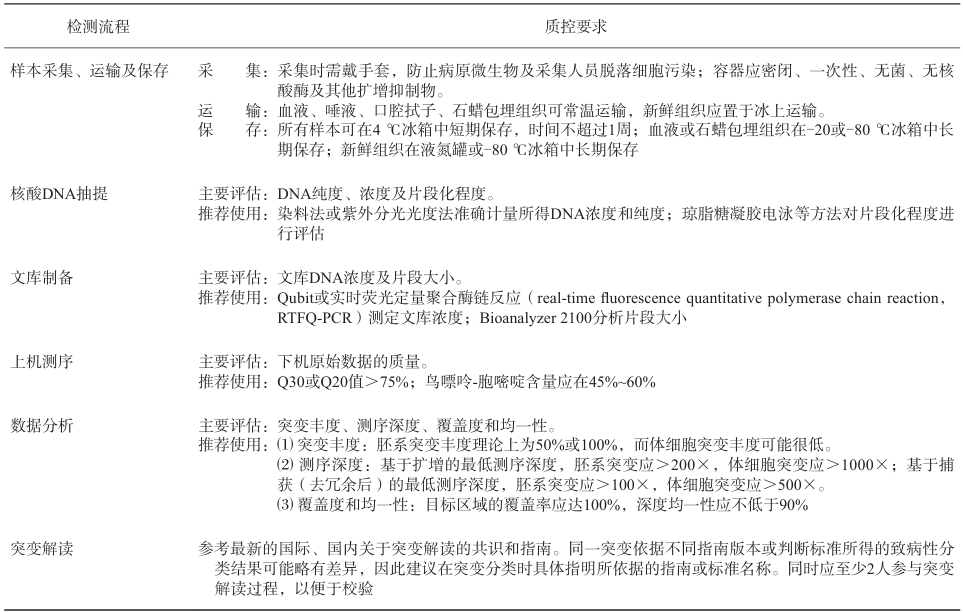
质量控制过程用于监控日常NGS检测流程的所有环节,包括试剂、样品处理、文库制备、上机测序、仪器设备性能与维护、数据处理(信息分析流程)、报告生成和临床解读等测序检测前、中、后的各个环节,以确保检测流程的顺利进行和检测结果的准确性。除此之外,进行BRCA1/2基因检测的实验室必须通过相关机构认证,有规范的实验室标准化操作流程,建立严格的质量控制体系,并定期参加国际和国内相关室间质评项目对其检测能力进行评估。BRCA1/2基因检测涉及的人员包括检测人员、生物信息学分析人员及突变解读人员,必须接受过相关的专业培训,并获得相应的资格证书。质控应该贯穿于整个BRCA1/2基因检测流程中,具体的检测流程及对应的质控要点见表4。
表4 BRCA基因检测流程及质控要点
BRCA基因检测报告内容
结合美国医学遗传学与基因组学学院(American College of Medical Genetics and Genomics,ACMG)发布的临床NGS标准[158]和《BRCA1/2数据解读中国专家共识(2021 版)》[159]、《临床基因检测报告规范与基因检测行业共识探讨》[160]等专家共识与相关文件,报告内容应至少包括以下部分:
① 被检者的基本信息:包括被检者姓名、年龄、性别、唯一标识号及肿瘤家族史情况; ② 样本信息:样本类型及样本接收日期;③ 送检机构及医师信息;④ 报告日期;⑤ 检测结果:应列出所发现的所有4/5类基因突变的名称、位点、突变的具体分类及分类的详细解释[按照ACMG/美国分子病理学会(Association for Molecular Pathology,AMP)分类标准,将分类证据逐一列出];建议列出所发现的3类基因突变,以便进行突变致病性重分析;⑥ 检测方法及适用范围:明确描述使用的BRCA检测方法及该方法覆盖的指定序列区域;⑦ 检测方法的局限性:对所使用检测方法的技术局限进行说明;⑧ 参考文献:列出突变分类证据中涉及的参考文献;⑨ 发布报告的实验室标识和联系信息;⑩ 检测人及审核者签名。若为第三方检测机构完成的检测,则应在报告中加盖第三方检测机构的“检测报告专用章”。
除上述必不可少的报告内容外,还可以附录的形式呈现下面的内容:① 突变位点Reads图;② Sanger测序图;③ 1/2类突变位点;④ 检测基因的详细介绍。
BRCA基因检测报告解读
结合《ACMG和AMP序列突变解读标准和指南(2015版)》[161]、胚系突变等位基因解读实证联盟(Evidence-based Network for the Interpretation of Germline Mutant Allele,ENIGMA)的分类系统[162]及《BRCA1/2数据解读中国专家共识(2021版)》[159],将BRCA基因突变按照风险程度由高至低划分为5类:5类-致病性(pathogenic);4类-可能致病性(likely pathogenic);3类-意义未明(uncertain signifcance);2类-可能良性(likely benign)和1类-良性(benign)。其中1~5类BRCA胚系突变的致病可能依次为<0.001、0.001~0.049、0.050~0.949、0.950~0.990、>0.990。
结果解读的责任属于临床实验室,应根据所检测的人群特征、综合临床分子诊断的实验数据和临床信息,对医师和患者描述此结果对疾病诊断的含义,为个体化用药提出建议。临床解释的责任属于临床医师,其应根据检测结果和临床信息向患者解释检测结果。
对于阳性结果(5类和4类突变)的判定解读是BRCA基因检测中最为重要的环节。BRCA基因突变解读需要依据各类信息(包括突变的类型、来自群体数据库、疾病数据库、文献和患者病史的信息、计算机预测)进行综合评判。在国外数据分析的基础之上,构建中国大样本BRCA基因突变数据库并进行规范解读,可以指导与规范BRCA基因检测在中国的临床应用,改善相应患者的治疗策略,提高高危人群的筛查和预防水平。相信随着中国人群特有的BRCA基因突变数据库的建立及BRCA基因突变的致病性理解加深,对BRCA基因检测结果的判定会越来越准确。
附录一:投票问题及投票结果汇总
第1题:与欧美人群相比,中国人群BRCA基因突变热点和致病性是否存在很大不同?
专家组的投票结果:26%选择是;15%选择否;59%选择不确认,需要更多研究
第2题:当前证据下,是否需要将BRCA基因突变乳腺癌视为独立的一类治疗亚型?
专家组的投票结果:37.8%选择是;21.6%选择否;40.5%选择不确认,需要更多研
第3题:与非突变患者相比,BRCA1/2基因突变乳腺癌是否有预后更差的趋势?
专家组的投票结果:29.7%选择是;24.3%选择否;45.9%选择不确认,需要更多研
第4题:当前证据下,携带BRCA突变的早期乳腺癌患者,其术后复发风险(包括同侧和对侧复发)较非突变患者是否更高?
专家组的投票结果:92%选择是;4%选择否;4%选择不确认,需要更多研究
第5题:携带BRCA1基因突变与BRCA2基因突变的乳腺癌患者,预后是否有差异?
专家组的投票结果:8%选择BRCA1基因突变患者预后更差;4%选择BRCA2基因突变患者预后更差;0%选择两者预后无差异;88%选择不确认,需要更多研究
第6题:以下哪些乳腺癌患者需要接受BRCA基因检测?(多选)
专家组的投票结果:70.3%选择≤50岁发病;94.6%选择三阴性乳腺癌;86.5%男性乳腺癌;97.3%有已知的家族性致病性BRCA1/2基因突变;94.6%存在第二原发性乳腺癌;81.1%任何年龄发病,同时满足≥1项家族史标准
第7题:哪个年龄段患者需要接受BRCA基因检测?
专家组的投票结果:62%<50岁;8%选择<45岁;26%选择<40岁;4%选择不确认,需要更多研究
第8题:您是否可以考虑三阴性乳腺癌患者接受BRCA基因检测?
专家组的投票结果:91.9%选择是;26%选择否;5.4%选择不确认,需要更多研究
第9题:对于符合OlympiA入组标准或晚期多线经治的HR+/HER2-乳腺癌患者,是否考虑推荐接受BRCA基因检测?
专家组的投票结果:94.6%选择是;2.7%选择否;2.7%选择不确认,需要更多研究
第10题:对于预期接受BRCA基因检测的患者,应优先推荐在哪个时间点进行?
专家组的投票结果:77%选择初次确诊乳腺癌时;4%选择局限期乳腺癌完成手术后;19%选择转移性乳腺癌预期更换治疗方案时
第11题:对于明确胚系BRCA基因突变的乳腺癌,在术后给予充分辅助治疗和随访前提下,是否可以考虑行保乳手术?
专家组的投票结果:96%选择是;0%选择否;4%选择不确认,需要更多研究
第12题:关于明确BRCA1/2基因突变的健康携带者,是否可以考虑风险降低性双侧乳腺切除术(BRRM)?
专家组的投票结果:35.1%选择是;29.7%选择否;35.1%选择不确认,需要更多研究
第13题:关于明确BRCA1/2基因突变的乳腺癌患者,是否可以考虑预防性对侧乳腺切除术(CPM)?
专家组的投票结果:54.1%选择是;16.2%选择否;29.7%选择不确认,需要更多研究
第14题:对于明确携带BRCA突变的三阴性乳腺癌,新辅助化疗是否可以考虑选择含铂类药物方案?
专家组的投票结果:91.9%选择是;0%选择否;8.1%选择不确认,需要更多研究
第15题:对于明确携带BRCA突变的三阴性乳腺癌,辅助化疗是否考虑选择含铂类药物 方案?
专家组的投票结果:51.4%选择是;10.8%选择否;37.8%选择不确认,需要更多研究
第16题:对于新辅助阶段使用PD-1抑制剂的早期TNBC,若同时满足OlympiA入组标准,辅助阶段如何治疗?
专家组的投票结果:4%选择使用奥拉帕利单药治疗1年;4%选择继续使用PD-1抑制剂满1年;55%选择奥拉帕利联合PD-1抑制剂1年;23%选择奥拉帕利和PD-1抑制剂序贯治疗;14%选择不确认,需要更多研究
第17题:对于既符合CREATE-X,也符合OlympiA入组标准的早期TNBC患者,辅助阶段如何治疗?
专家组的投票结果:30%选择仅使用奥拉帕利单药治疗1年;0%选择仅卡培他滨强化;14%选择先奥拉帕利,后卡培他滨;28%选择先卡培他滨,后奥拉帕利;19%选择奥拉帕利和卡培他滨同步强化;9%选择不确认,需要更多研究
第18题:在目前证据下,对于携带BRCA突变的新诊断或复发转移性晚期TNBC,应在何时选择PARP抑制剂治疗?
专家组的投票结果:45%选择开始化疗前;21%选择1次化疗进展后;4%选择2次化疗进展后;30%选择不确认,需要更多研究
第19题:在目前证据下,对于BRCA基因突变的晚期TNBC,是否在化疗时优先选择含铂类的化疗方案?
专家组的投票结果:84%选择是;0%选择否;16%选择不确认,需要更多研究
第20题:对于既符合CDK4/6i(monarchE或NATALEE),也符合OlympiA入组标准的HR+/ HER2-乳腺癌,您推荐内分泌治疗药物以外的哪种辅助强化策略?
专家组的投票结果:2.7%选择仅使用奥拉帕利单药强化治疗1年;2.7%选择仅使用CDK4/6i单药强化治疗2年;64.9%选择先奥拉帕利强化1年,之后序贯CDK4/6i 2~3年;10.8%选择先CDK4/6i强化2~3年,之后序贯奥拉帕利1年;2.7%选择奥拉帕利+CDK4/6i同步强化;16.2%选择不确认,需要更多研究
第21题:在目前证据下,对于携带BRCA突变的晚期激素受体阳性/HER2阴性乳腺癌,应在合适选择PARP抑制剂治疗?
专家组的投票结果:8%选择晚期一线;62%选择1次CDK4/6i治疗进展后;17%选择内分泌耐药后,化疗前;0%选择1次化疗进展后;13%选择不确认,需要更多研究
第22题:关于明确BRCA1/2基因突变携带者,是否进行预防性双侧输卵管卵巢切除术(PBSO)?
专家组的投票结果:51%选择是;13%选择否;36%选择不确认,需要更多研究
第23题:对于明确胚系BRCA基因突变的健康携带者,是否需要使用内分泌治疗药物预防乳腺癌的发生?
专家组的投票结果:9%选择是,使用他莫昔芬;4%选择是,使用AI类药物;0%选择是,使用口服避孕药;87%选择不确认,需要更多研究
第24题:对于明确胚系BRCA基因突变的激素受体阳性乳腺癌患者,内分泌治疗药物(如TAM、AI)是否可以起到预防对侧乳腺癌的发生的作用?
专家组的投票结果:10.8%选择是,使用他莫昔芬;5.4%选择是,使用AI类药物;40.5%选择是,使用他莫昔芬或AI;43.2%选择不确认,需要更多研究
附录二 CSCO诊疗指南证据级别
1A类证据:基于高水平证据(严谨的meta分析或RCT结果),专家组一致共识(支持意见≥80%);
1B类证据:基于高水平证据(严谨的meta分析或RCT结果),专家组基本一致共识(支持意见60%~<80%);
2A类证据:基于稍低水平证据,专家组一致共识(支持意见≥80%);
2B类证据:基于稍低水平证据,专家组基本一致共识(支持意见60%~<80%);
3类证据:基于低水平证据,专家组无共识且争议大(支持意见<60%)。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


