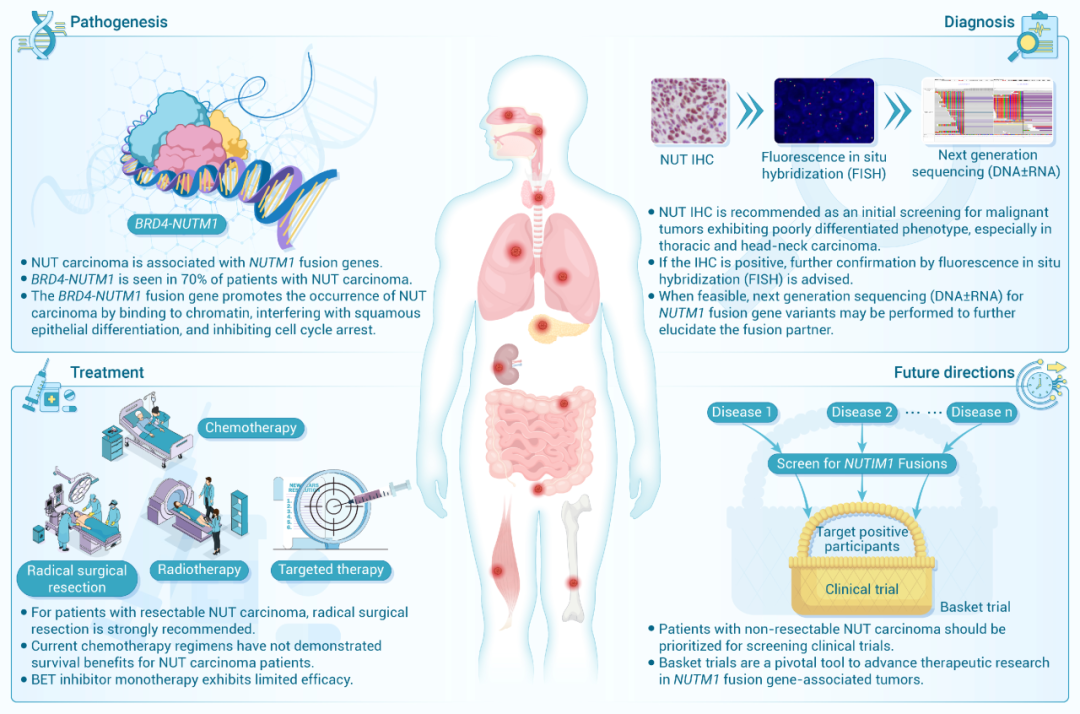
2004版的世界卫生组织(WHO)分类标准将NUT癌归类为胸腺恶性肿瘤,并因为其主要发生在中线器官并将其命名为“中线癌”,这可能是NUT癌最为大家所熟知的名称。然而,越来越多的非中线器官的NUT癌被报道后,2015年版WHO将NUT癌重新归类为独立实体“胸部 NUT 癌”。
近年来,各国陆续成立了相关的NUT癌专委会,美国创建了国际NUT癌注册中心(NMC Registry),以记录NUT癌患者的临床、遗传、病理特征和结果,涵盖了1993年至今诊断的患者。中国NUT癌研究协作组(Chinese Alliance of Research for NUT carcinoma, ChARN)在国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)罕见肿瘤委员会的支持和帮助下,于2023年开始筹建,2024年底成立,拥有112家成员单位,致力于发挥中国特色NUT癌的的各项研究(涵盖发病机制探索、病理诊断方法探索、治疗方案探索和耐药机制探索)。其中,成立之初建立的数据库为研究工作打下了坚实的基础。回顾性数据库录入了2000-2024年的NUT癌数据,为进一步加深对NUT癌的研究,前瞻性数据库于2024年底建成上线,内容涵盖人体各大器官(肺,鼻腔,腮腺,胰腺,骨,神经系统,泌尿生殖系统,软组织等)。目前启动中国首个NUT癌真实世界研究。为与世界NUT癌研究接轨,ChARN协作组基于回顾性和前瞻性数据库所发布中国NUT癌临床诊治状况,以期与相应高校或研究所研发探索发病机制,相应诊断类企业研发探索诊断特异性标志物,相应药企开展新药临床前开发及临床研究,从而相应提高患者的生存期。


NUT癌作为一种罕见肿瘤,即使是很多医务人员对其都感到陌生,更别说正确诊疗这一疾病。但全球巨大的人口基数导致即使是罕见疾病也有数以万计的患者迫切需要正确的诊断与治疗。2021年国际NUT癌注册中心(NMC Registry)首次以“Report of the First International Symposium on NUT Carcinoma”报告总结NUT癌,这算是国际上最早的NUT癌临床诊疗共识雏形,四年后我们通过中国NUT癌研究协作组(Chinese Alliance of Research for NUT carcinoma, ChARN),联合国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)罕见肿瘤专委会和国际NUT癌注册中心(NMC Registry)召集了领域内全球17个国家,141个单位,174位来自亚洲,欧洲,非洲,北美洲,南美洲,大洋洲的专家通过搜集总结现有文献证据,充分讨论形成意见,共同编撰了首部NUT癌临床诊疗国际指南V1.0,希望能帮助大家深入了解及正确诊断这一疾病,为其寻找有效的治疗方案而共同努力。以下对指南中的要点进行简要介绍。
发生率及流行病学
要点1:虽然NUT癌也可发生在非中线器官中,但其最常原发于胸部及头颈部。NUT癌常见于年轻人,男女发病率无明显差异,但是因为较低的发病率,不推荐对NUT癌患者进行影像学筛查(推荐级别:推荐)
致病机制
要点2:NUT癌的细胞来源尚未明确,NUTM1融合基因是NUT癌主要致病机制。溴结构域和末端外结构域蛋白4(Bromodomain and Extraterminal Domain protein 4,BRD4)是NUTM1基因最常见的融合伴侣,尽管近年来已经确定了更多的NUTM1融合伴侣(例如NSMCE2、BCORL1、MYXD1等),但这些新的融合伴侣对NUT癌发病机制的临床相关性和下游机制仍未完全确定。由于BRD4::NUTM1是导致NUT癌最常见的融合基因类型,推荐在临床实践对可考虑对病理类型为低分化癌患者进行BRD4::NUTM检测。(推荐级别:强烈推荐)
诊断
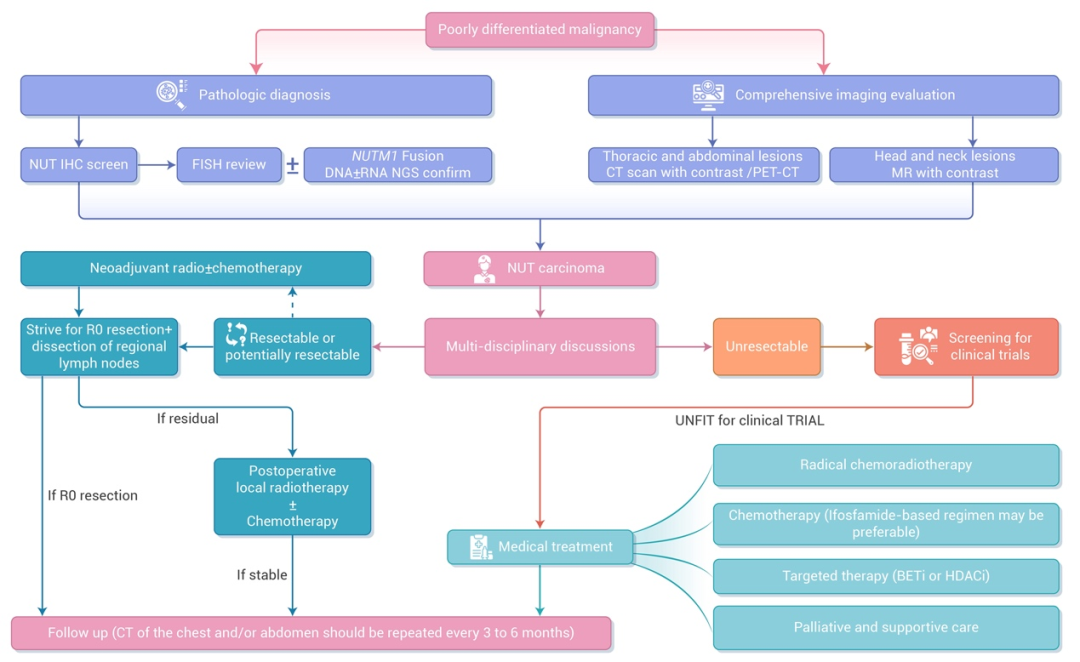
要点3:NUT癌的原发部位并不局限于中线器官,胸腔和头/颈部区域是NUT癌最常见的原发部位,但其临床症状是非特异性的,主要与这些解剖位置快速生长的肿块有关。因此,如果影像学检查发现头颈、胸腔等中线区域有快速进展的肿块,应将NUT癌纳入鉴别诊断,并及时通过组织活检进一步明确。(推荐级别:推荐)
要点4:根据原发肿瘤位置对NUT癌进行常见转移部位的综合影像学评估。胸部和腹部病变推荐使用增强CT检查,而头颈部病变则首选增强MRI检查。对于可能从根治性手术中受益的非转移或寡转移NUT癌患者,推荐进行PET-CT检查。(推荐等级:推荐)
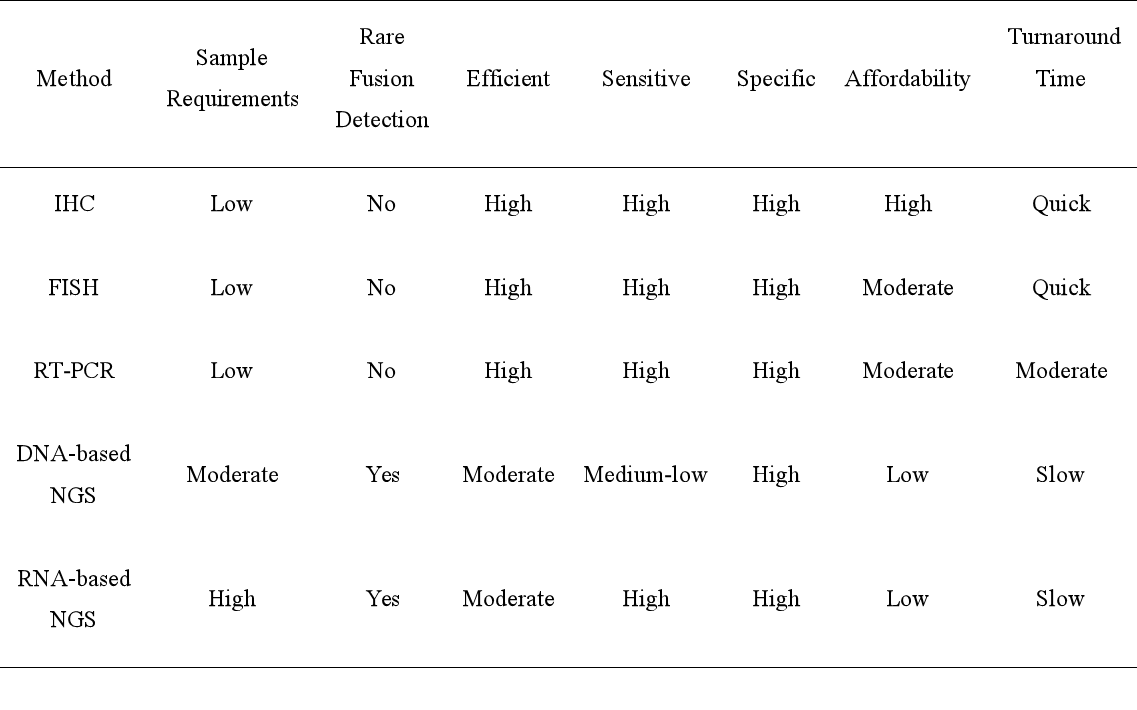
要点5:NUT癌是一种缺乏组织学特征的低分化上皮来源恶性肿瘤。建议通过NUT蛋白免疫组织化学(Immunohistochemistry,IHC)对低分化恶性肿瘤进行初步筛查,后续可使用荧光原位杂交(Fluorescence in situ hybridization,FISH)或深度测序进行确认及检测NUTM1融合变体。虽然NUT癌可能表现出一些特征性的组织学特征,例如局灶性突然角化,但这些发现是非特异性的,例如HPV相关的基底样鳞状细胞癌等其他低分化肿瘤也具有这一特点。
对于活检后发现的低分化上皮恶性肿瘤,为了减少误诊风险,建议将 NUT蛋白IHC纳入初始筛查,尤其是肿瘤位于胸部和头颈部的患者。若NUT IHC阳性表达,条件允许的情况下建议进行深度测序(DNA±RNA)或FISH检测进一步分析融合伴侣。(推荐等级:推荐)
下表总结了现有诊断方法的优缺点。(表1)
Table 1: Advantages and disadvantages of detection methods for NUTM1 fusions
治疗手段
要点6:对于可切除的NUT癌患者,应在保留原发部位关键功能的前提下尽可能进行根治性手术切除。根治性手术切除是延长NUT癌患者生存的独立阳性预后因素。鉴于NUT癌诊疗的复杂性,建议通过多学科团队(MDT)评估患者表现、手术时间点和方法等,以建立最佳手术决策。(推荐等级:推荐)
要点7:放射治疗可用于NUT癌患者的全部治疗阶段。对于体能状态良好的不可切除的NUT癌患者,针对头颈部或胸部原发病变可行同步放化疗。在不同治疗阶段应用放疗,均可对患者预后产生积极影响。然而,目前还没有针对NUT癌的标准同步化疗方案、放疗剂量及放疗靶区推荐。同步化疗方案可参考相应解剖部位的其他实体瘤的方案。强烈建议采用先进的放射治疗技术来增加肿瘤剂量,同时最大限度地减少危及器官剂量。对于体能状态良好的不可切除NUT癌患者,NUT癌患者在各个治疗阶段均可采用放疗,放疗剂量、靶区建议参考该区域其他肿瘤。(推荐等级:推荐)
要点8:现有的化疗方案为在NUT癌患者中的有效率均低于40%,且化疗未能提高NUT癌患者的总生存。基于异环磷酰胺的化疗方案在非转移性NUT癌患者的客观缓解率和无进展生存期方面显示出一定优势,且现阶段缺乏有效的全身治疗方法,对于一般情况尚可的NUT癌患者可考虑接受含有异环磷酰胺的化疗方案。(推荐等级:推荐)
要点9:BET抑制剂单药治疗对NUT癌患者的疗效低于30%,大多数患者的反应持续时间仅为2至3个月,而且具有较高的胃肠道毒性和严重血小板减少症的发生率。基于BET抑制剂较低的疗效及较高的严重血小板减少的发生率,建议患者需接受BET抑制剂联合治疗。(推荐等级:推荐)
随访及预后
要点10:原发肿瘤部位以及不同的NUTM1融合伴侣可能与NUT癌患者预后的差异行有关。根治性手术、放疗、诊断时的非转移性疾病和较低的初始乳酸脱氢酶(LDH)水平可能是NUT癌患者长期生存的阳性预测因子。因此,建议对条件允许的NUT癌患者进行根治性手术和放疗,并进行包括LDH检测在内的常规临床实验室检查。(推荐等级:推荐)
要点11:NUT患者的治疗后随访应至少每3至6个月进行一次胸部和/或腹部CT扫描,或根据症状更频繁地对已知和可能的肿瘤位置区域进行扫描(推荐等级:推荐)
未来方向
要点12:不可切除的NUT癌患者应优先进行药物临床试验的筛选。(推荐等级:推荐)
根据上述NUT诊疗的相关内容,我们制定了如下诊疗流程图供大家参考(图1)。NUT癌诊疗未来研究方向应集中在提高诊断效率、明确治疗策略和扩大技术平台等方面,以实现全面精准诊断和精准治疗。在提高诊断效率方面,NUT癌诊断依赖于病理检查,由于其罕见性和组织学异质性通常会导致误诊或诊断不足。因此,提高病理学家和临床医生的认识至关重要。除了IHC和FISH检测外,基于RNA的深度还可以验证病理诊断并发现新的融合伴侣;随诊全基因组测序和转录组测序的综合方法变得越来越普遍,这可能有助于更彻底地了解NUT癌的分子特征,有助于开发针对性的新型药物,切实提高NUT癌患者的疗效。











 苏公网安备32059002004080号
苏公网安备32059002004080号


