T细胞免疫疗法作为一种创新的治疗手段,通过激活患者自身的免疫系统,实现精准的抗肿瘤作用,从而改善患者预后。随着多款T细胞免疫疗法在全球范围内获批上市,该疗法在侵袭性B细胞淋巴瘤领域的应用日益广泛,但关于其临床规范应用尚无相关共识。因此,中国临床肿瘤学会(CSCO)淋巴瘤专家委员会结合循证医学证据和临床应用经验,讨论制定了T细胞免疫疗法治疗侵袭性B细胞淋巴瘤中国专家共识,旨在为我国医师临床规范化用药提供指导和建议。

非霍奇金淋巴瘤(NHL)是一组起源于淋巴细胞的恶性肿瘤,具有高度异质性。研究数据显示,我国NHL发病率逐年增高,2022年的年龄标准化发病率已达到5.6/10万。其中,弥漫大B细胞淋巴瘤(DLBCL)、套细胞淋巴瘤(MCL)等侵袭性B细胞淋巴瘤是NHL的常见亚型,具有恶性程度高、进展快、易耐药和复发等特点,给临床治疗带来了挑战。
研究显示,侵袭性B细胞淋巴瘤细胞可通过改变免疫微环境逃避免疫细胞如T细胞的免疫监视。这使得免疫治疗尤其是T细胞免疫疗法成为全球研究热点。不断开展的临床研究为T细胞免疫疗法在侵袭性B细胞淋巴瘤中的应用提供了数据支持,因此,2025年第2版美国国家综合癌症网络(NCCN)B细胞淋巴瘤临床实践指南优先推荐包括双特异性抗体和嵌合抗原受体T(CAR-T)细胞疗法在内的T细胞免疫疗法用于治疗复发难治侵袭性B细胞淋巴瘤。
T细胞免疫疗法是一种基于患者体内的T细胞杀伤肿瘤细胞的免疫治疗。20世纪80年代至今,科学家对T细胞免疫疗法展开积极探索。目前CAR-T细胞疗法和双特异性抗体等多种T细胞免疫疗法已在我国获批上市,随着药物可及性的不断提高,T细胞免疫疗法已成为侵袭性B细胞淋巴瘤的重要治疗手段。为了更规范地使用T细胞免疫疗法并提升侵袭性B细胞淋巴瘤的规范化治疗水平,中国临床肿瘤学会(CSCO)淋巴瘤专家委员会基于国内外研究数据和实践经验,讨论制定了本专家共识。
1 T细胞免疫疗法的作用机制
T细胞介导的特异性免疫是抗肿瘤细胞免疫的重要组成部分。基于T细胞杀伤作用的相对特异性、记忆性和持久性,T细胞免疫疗法可实现精准和长效的治疗模式。在多种T细胞免疫疗法中,CAR-T细胞疗法和双特异性抗体可通过不同的技术手段实现对T细胞的改造或重定向,从而更精准地杀伤肿瘤细胞。CAR-T细胞疗法需采集患者的单个核细胞,并在体外基于基因工程将识别肿瘤相关抗原和促进T细胞活化的信号传递结构域融合表达于T细胞表面,使得改造后的T细胞能特异识别肿瘤抗原,患者回输改造后的T细胞,其可在患者体内发挥抗肿瘤作用。双特异性抗体以1∶1、2∶1或2∶2等结构特异性靶向CD20或CD19等肿瘤细胞表面抗原和T细胞特异性抗原,诱导免疫突触的形成,促进患者体内T细胞的活化,诱导肿瘤细胞裂解死亡。
2 T细胞免疫疗法的临床应用推荐
T细胞免疫疗法在侵袭性B细胞淋巴瘤中应用广泛。自2017年以来,阿基仑赛、瑞基奥仑赛、tisagenlecleucel(tisa-cel)、brexucabtagene autoleucel(brexu-cel)和lisocabtagene maraleucel(liso-cel)等CAR-T细胞疗法及格菲妥单抗、epcoritamab和odronextamab等双特异性抗体接连获批上市,适应证涵盖复发难治(R/R)大B细胞淋巴瘤(LBCL)以及R/R MCL( 表1 )。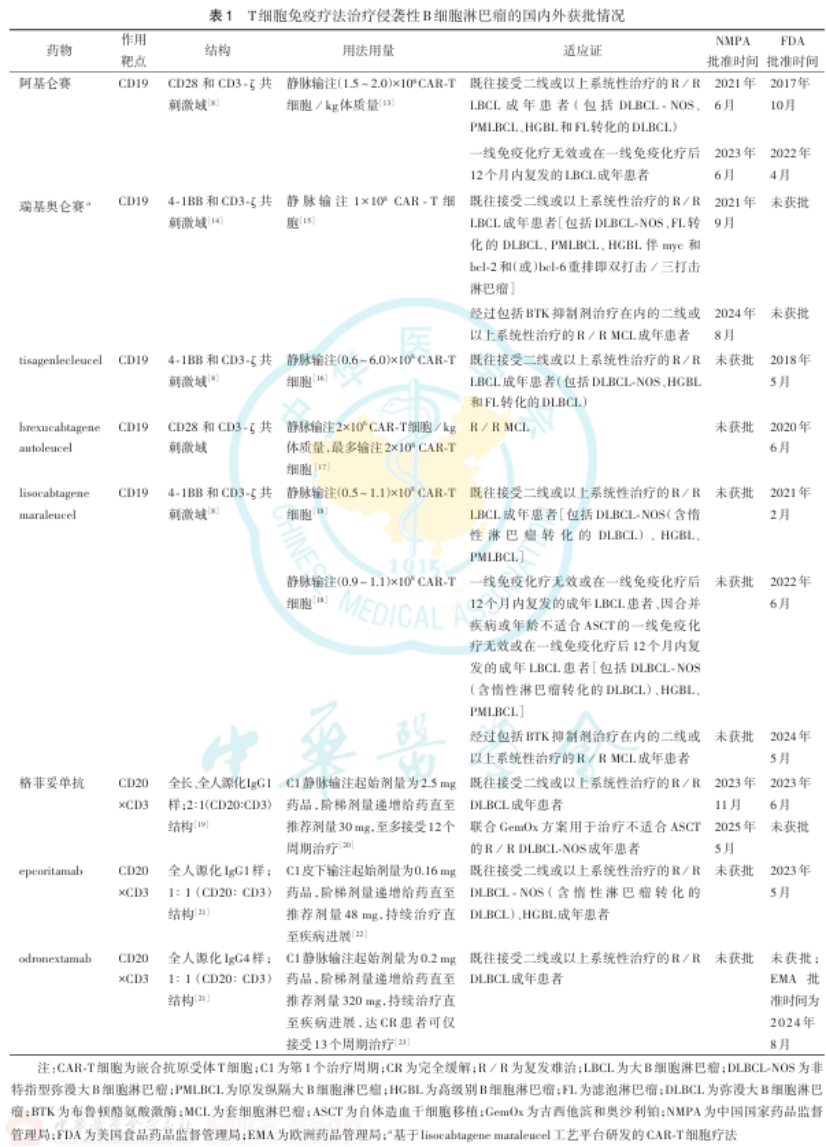
2.1 T细胞免疫疗法在R/R LBCL中的应用
LBCL最常见的亚型为非特指型弥漫大B细胞淋巴瘤(DLBCL-NOS),还包括原发性中枢神经系统LBCL等原发免疫豁免部位LBCL以及高级别B细胞淋巴瘤等亚型。此外,惰性B细胞淋巴瘤如慢性淋巴细胞白血病会转化为侵袭性B细胞淋巴瘤即Ritcher转化,其中最常见的模式是转化为DLBCL(DLBCL-RT)。大部分LBCL患者经免疫化疗治疗后能达到治愈,但约40% LBCL患者在一线治疗后出现复发或难治。R/R LBCL的主要治疗手段是自体造血干细胞移植(ASCT),但仅30%~40%患者对挽救性化疗有应答并能进行ASCT。然而,其中50%患者在挽救性化疗联合ASCT治疗后复发,这类患者预后较差,中位总生存(OS)时间为6.2个月,而伴中枢神经系统(CNS)累及的R/R LBCL预后更差,中位OS时间仅为3.4个月。
近年来,T细胞免疫疗法在R/R LBCL治疗领域展现出积极的临床结果,同时为DLBCL-RT和CNS累及等患者带来了新选择。
(1)阿基仑赛:基于ZUMA-1研究,美国食品药品监督管理局(FDA)批准阿基仑赛用于三线及后线治疗R/R LBCL。ZUMA-1研究纳入了101例R/R LBCL患者,5年无进展生存(PFS)率和OS率分别为31.8%和42.6%。一项单臂、开放性的临床研究数据显示,接受阿基仑赛治疗的24例我国R/R LBCL患者的总缓解率(ORR)为79.2%,与全球人群数据(83%)相当。ZUMA-7研究探索了阿基仑赛作为LBCL二线治疗的有效性和安全性,共纳入359例患者。相较移植组,阿基仑赛组的中位无事件生存(EFS)时间长(10.8个月比2.3个月, P<0.001),4年OS率高(54.6%比46%, P=0.03)。对于CNS累及的R/R LBCL,一项先导性研究显示,18例接受阿基仑赛治疗患者的中位PFS和OS时间分别为14.3、26.4个月,≥3级免疫效应细胞相关神经毒性综合征(ICANS)发生率为28%。
(2)liso-cel &瑞基奥仑赛:TRANSCEND NHL 001研究纳入270例患者,2年随访数据显示,liso-cel治疗既往接受过二线或以上系统性治疗的LBCL成年患者的中位PFS和OS时间分别为6.8、27.3个月,且安全性可控,未出现新的不良反应。liso-cel的关键性临床试验TRANSFORM显示其在184例适合移植LBCL的二线治疗中具有显著疗效,liso-cel组的3年EFS率为45.8%,优于移植组(19.1%)。PILOT研究则验证了liso-cel二线治疗61例不适合移植LBCL的效果,中位随访23.1个月的数据显示,liso-cel组的CR率和中位PFS时间分别为54.1%和9个月。瑞基奥仑赛的关键性注册临床研究RELIANCE入组了59例既往接受过二线或以上全身性治疗的R/R LBCL患者,随访分析显示,瑞基奥仑赛的4年OS率为66.7%。一项回顾性研究评估了瑞基奥仑赛治疗伴CNS累及R/R DLBCL的效果和安全性,数据显示患者的1年PFS率和OS率分别为64.4%和79.2%。
(3)格菲妥单抗:NP30179研究纳入155例R/R DLBCL患者,数据显示固定周期(每个周期为21 d,至多12个周期)的格菲妥单抗治疗可有效改善三线及以上DLBCL患者的生存,治疗结束时达CR患者的24个月PFS率和OS率分别为57.3%和77.2%,基于此研究,该药物于2023年获美国FDA批准。同年,我国基于NP30179研究和GLOSHINE研究批准格菲妥单抗用于R/R DLBCL成年患者三线及后线治疗。GLOSHINE研究中30例我国R/R DLBCL患者接受格菲妥单抗单药治疗,中位随访15个月,独立评审委员会评估的中位PFS时间为8.6个月,且我国人群的不良反应发生率与全球人群无明显差异。对于二线治疗不适合移植的DLBCL,一项全球随机化Ⅲ期研究STARGLO纳入274例DLBCL-NOS患者,评估格菲妥单抗联合化疗方案(每个周期为21 d,至多12个周期;具体为8个周期联合方案治疗后给予4个周期格菲妥单抗单药治疗)的疗效与安全性。中位随访20.7个月,相较利妥昔单抗联合吉西他滨和奥沙利铂(GemOx)组,格菲妥单抗联合GemOx组中位OS时间显著改善(25.5个月比12.9个月, P=0.006)。格菲妥单抗联合治疗组的细胞因子释放综合征(CRS)发生率低于格菲妥单抗单药治疗组(44%比63%)。
其他格菲妥单抗联合方案也被不断探索。GO43693研究评估了格菲妥单抗联合利妥昔单抗和化疗作为适合ASCT或CAR-T细胞疗法DLBCL的二线挽救性治疗或桥接治疗的效果和安全性,患者的ORR和CR率分别为83.3%和66.7% 。NP39488研究评估了格菲妥单抗联合维泊妥珠单抗二线治疗DLBCL的效果和安全性,中位随访28.2个月,患者的中位PFS和OS时间分别为12.3、33.8个月。
对于发生CNS累及和Ritcher转化等的患者,格菲妥单抗单药也展现出一定的疗效。一项病例系列报道显示,纳入的4例继发性CNS累及的DLBCL患者在2~4个周期格菲妥单抗治疗后,患者的脑脊液中均能检测到格菲妥单抗,其中3例患者至少达到部分缓解 。一项格菲妥单抗的Ⅰ期剂量递增研究显示,入组的11例Ritcher转化患者的CR率为45.5%,数据截止时80%患者仍持续处于CR ,而对于既往格菲妥单抗治疗失败的患者,不建议后续重复使用该方案。
此外,其他双特异性抗体如莫妥珠单抗、epcoritamab和odronextamab在R/R LBCL治疗领域也展现了积极的临床结果。研究数据显示,莫妥珠单抗联合维泊妥珠单抗二线及后线治疗R/R LBCL患者的ORR和CR率分别为59.2%和45.9%。而对于R/R LBCL的三线及后线治疗,EPCORE NHL-1研究中位随访25.1个月的数据显示,使用epcoritamab治疗的R/R LBCL队列的ORR和CR率分别为63.1%和40.1%,中位OS时间为18.5个月。ELM-2研究则显示,独立评审委员会评估的odronextamab的ORR和CR率分别为52%和31%。
多种T细胞免疫疗法的出现增加了临床治疗选择,但同时也为临床医生带来了新的难题,如何合理安排治疗顺序以达到最佳治疗效果越来越受到关注。在为R/R LBCL患者制订治疗方案时,需要综合考量患者的体能状态、年龄、肿瘤负荷和累及器官等因素,此外还需要考虑药物的疗效、安全性和可及性。
目前已有多项研究比较了CAR-T细胞疗法与双特异性抗体在R/R LBCL中的疗效。一项荟萃分析显示,在R/R DLBCL的三线及以上治疗中,双特异性抗体和CAR-T细胞疗法的CR率分别为36%和51%。但也有一项匹配调整间接比较研究显示,格菲妥单抗和阿基仑赛治疗三线及以上我国R/R DLBCL患者的CR率分别为61.3%和33.3%。上述研究的疗效差异提示,双特异性抗体和CAR-T细胞疗法在三线及以上R/R DLBCL中的疗效仍需更多研究进一步验证和明确。对于两者的安全性,荟萃分析显示,相较双特异性抗体,CAR-T细胞疗法发生≥3级CRS(8%比2%)、神经系统不良反应(11%比1%)和感染(17%比10%)的风险高。研究显示T细胞耗竭等是感染发生的重要原因,并增加淋巴瘤患者治疗中断和非复发死亡的风险,因此未来仍需探索如何改善患者免疫功能以提高疗效和安全性。此外,CAR-T细胞制备周期较长,且在治疗前需要进行淋巴细胞清除化疗,部分肿瘤负荷较高的患者还需要进行桥接治疗,而双特异性抗体无须等待制备,在真实世界中更具有可及性。
在讨论两者的治疗顺序时,需考虑到两者获批的时间差异导致了CAR-T细胞疗法失败后使用双特异性抗体的循证证据更为丰富。还需要考虑前线应用双特异性抗体或CAR-T细胞疗法是否会影响后线T细胞免疫疗法的疗效。现有的临床研究数据显示,双特异性抗体对于CAR-T细胞治疗后复发的患者仍有一定疗效。一项小样本回顾性研究显示,CAR-T细胞治疗后进展的LBCL患者接受格菲妥单抗单药治疗后,ORR为67%,其中CR率为44%,与NP30179研究结果相近,且3例患者外周血中循环CAR-T细胞在格菲妥单抗治疗后增加。对于双特异性抗体治疗是否会影响后续CAR-T细胞治疗的效果,一项回顾性研究结果显示,相比于既往未接受过双特异性抗体治疗的对照组,接受过双特异性抗体治疗的患者在CAR-T细胞治疗后ORR高(86%比55%, P=0.02),且OS存在获益的趋势( P=0.08),提示双特异性抗体治疗后使用CAR-T细胞治疗可能进一步增加患者获益。此外,无论患者既往对双特异性抗体的应答如何,其对后续CAR-T细胞治疗的应答并没有显著差异 。
推荐意见1:T细胞疗法适用于一线治疗后R/R LBCL患者。对于一线免疫化疗无效或在一线免疫化疗后12个月内复发的成年LBCL患者,基于药物在我国的获批情况,建议选择CAR-T细胞疗法;对于LBCL的三线及后线治疗,可根据患者的情况给予双特异性抗体或CAR-T细胞疗法。
推荐意见2:对于不适合ASCT的R/R LBCL患者,考虑给予GemOx方案或维泊妥珠单抗联合双特异性抗体,或CAR-T细胞疗法。
推荐意见3:双特异性抗体挽救治疗后可考虑给予ASCT巩固治疗。
推荐意见4:对于感染、CRS和神经系统不良反应发生风险较高的R/R LBCL患者,建议首选双特异性抗体治疗。
推荐意见5:对于疾病进展快、单核细胞采集失败或CAR-T细胞制备失败等的R/R LBCL患者,可考虑给予双特异性抗体。
推荐意见6:对于伴CNS累及的R/R LBCL患者,应在综合考量多种因素后视情况给予CAR-T细胞疗法或双特异性抗体。
2.2 T细胞免疫疗法在R/R MCL中的应用
MCL兼具侵袭性淋巴瘤疾病进展迅速和惰性淋巴瘤不可治愈的特点,近年来MCL患者的整体生存率有所提升,5年OS率达57%,但R/R MCL患者的5年OS率仅为36%,仍有待改善 。近年来,T细胞免疫疗法在R/R MCL的治疗中展现出良好前景。
(1)liso-cel &瑞基奥仑赛:liso-cel在其关键性临床试验TRANSCEND NHL 001研究的MCL队列中展现出积极的结果。中位随访16.1个月的疗效数据显示,88例R/R MCL患者的缓解深度和长期生存均得到改善,CR率为72.3%,中位PFS和OS时间分别为15.3、18.2个月。一项开放标签的Ⅱ期临床研究(NCT04718883)验证了瑞基奥仑赛在R/R MCL三线及后线治疗中的效果和安全性。瑞基奥仑赛治疗后3个月,66例患者的最佳ORR和CR率分别为78.57%和66.67%。在安全性分析集中,78.57%患者发生≥ 3级治疗相关的治疗期间不良事件(TEAE)。
(2)格菲妥单抗:NP30179研究中60例既往至少接受过一线治疗的R/R MCL患者在格菲妥单抗治疗后,78.3%患者达CR,数据截止时57.4%患者仍处于CR。研究者评估的中位PFS和OS时间分别为16.8、29.9个月。格菲妥单抗也可改善既往布鲁顿酪氨酸激酶(BTK)抑制剂暴露、Ki-67阳性指数>50%和p53阳性率>50%亚组的疗效,CR率分别为71%、68%和67%。
推荐意见7:对于经过包括BTK抑制剂治疗在内的二线及以上系统性治疗的R/R MCL患者,考虑到药物在我国的获批情况,建议选择瑞基奥仑赛治疗。
推荐意见8:基于双特异性抗体在R/R MCL中的良好疗效,为改善预后,可考虑给予格菲妥单抗。
3 T细胞免疫疗法的不良反应和处理
T细胞免疫疗法通过改造T细胞或将T细胞重定向至肿瘤,从而发挥抗肿瘤作用。然而,当大量T细胞被激活时,细胞因子释放量也随之增加,同时部分肿瘤抗原在正常细胞上也有表达,这些因素均可能导致不良反应的发生。
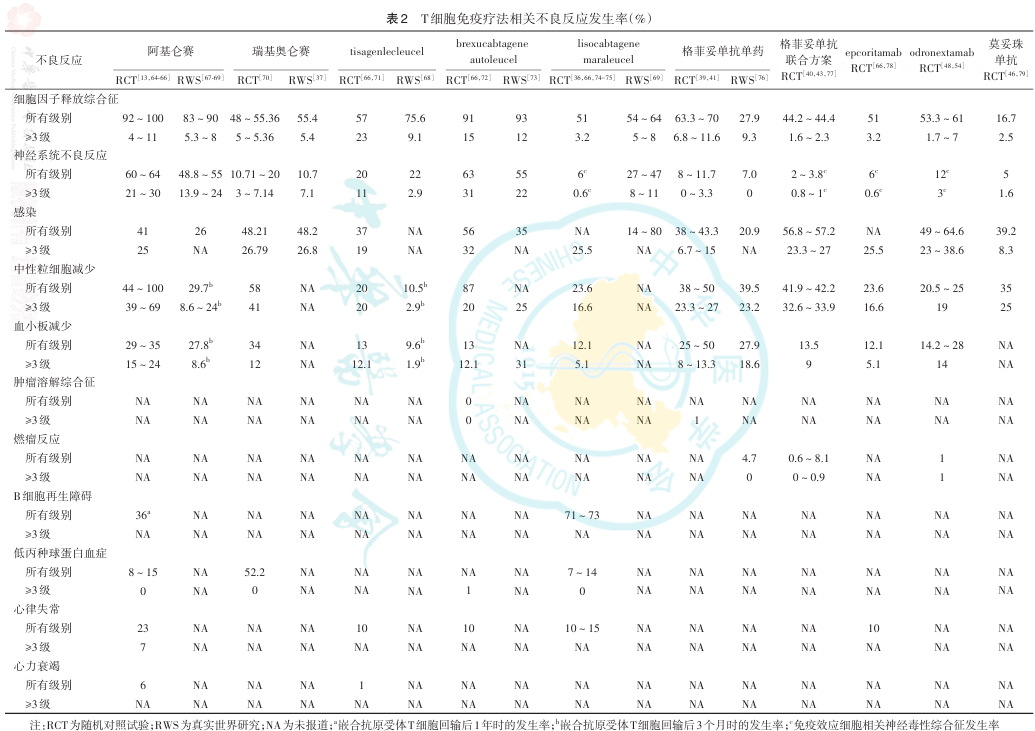
T细胞免疫疗法常见的不良反应包括CRS、神经系统不良反应、感染和骨髓抑制如中性粒细胞减少和血小板减少等( 表2 )。此外,尽管肿瘤溶解综合征(TLS)、燃瘤反应、B细胞再生障碍和低丙种球蛋白血症以及心律失常和心力衰竭等心脏不良反应发生率相对较低,但对其管理也不容忽视。在治疗期间,需密切监测以上不良反应,积极预防或给予支持治疗,必要时可调整治疗方案。具体的治疗措施可参考药物说明书和相应药物的临床应用指导原则,CAR-T细胞相关的不良反应管理可参考《2024中国临床肿瘤学会(CSCO)CAR-T细胞治疗恶性血液病指南》。
3.1 CRS
CRS是T细胞免疫疗法的常见不良反应,其中阿基仑赛和brexu-cel的CRS发生率相对较高( 表2 ),而双特异性抗体在不同疾病或不同治疗方案中的CRS发生率和安全性特征存在较大差异。CRS常见表现为发热、肌痛、缺氧、低血压等。CRS的危险因素包括肿瘤负荷高、体能状态差等,因此这类患者须在治疗时接受密切监测。为降低CRS的发生风险,双特异性抗体治疗前可使用对应的预处理和前驱用药方案,如在第1个周期第1天(格菲妥单抗治疗开始前7 d)给予奥妥珠单抗。此外,患者的前驱用药包括皮质类固醇、口服镇痛和(或)解热药或抗组胺药。具体的预处理及前驱用药剂量和时机须严格按照说明书。若治疗后考虑患者发生CRS,应排除其他并发症如发热、低血压和感染等。双特异性抗体治疗期间,大多数CRS发生在治疗的第一个周期。双特异性抗体或CAR-T细胞输注后应密切监测,可基于美国移植和细胞治疗协会(ASTCT)的CRS分级量表分级后进行管理。不同等级CRS的管理方案详见表3 。

3.2 神经系统不良反应
神经系统不良反应是T细胞免疫疗法另一常见的不良反应,这可能与T细胞免疫疗法治疗后细胞因子或免疫细胞通过血脑屏障进入脑脊液有关。临床研究的安全性数据显示,相较双特异性抗体,CAR-T细胞疗法的≥3级神经系统不良反应发生风险更高( 表2 )。患者常表现为注意力下降、谵妄、表达性失语、反应迟钝、癫痫和脑水肿等。神经系统不良反应可根据免疫效应细胞相关脑病(ICE)评分、意识状态、癫痫、运动障碍和颅内压增高/脑水肿分为1~4级。具体的分级管理方案见表4 。

3.3 感染
感染是T细胞免疫疗法的另一常见不良反应,约37%~64.6%侵袭性B细胞淋巴瘤患者在T细胞免疫疗法治疗后出现感染,其中CAR-T细胞治疗中多为细菌感染,双特异性抗体治疗中多为病毒感染。伴有活动性感染的患者应避免使用T细胞免疫疗法。而在应用靶向B细胞的CAR-T细胞治疗时,患者可能发生乙型肝炎病毒(HBV)再激活,部分病例可能发生暴发性肝炎、肝衰竭和死亡,应在采集细胞以制备CAR-T细胞时,筛查HBV、丙型肝炎病毒和人类免疫缺陷病毒。T细胞免疫疗法治疗期间,患者可能出现巨细胞病毒再激活、卡氏肺孢子菌感染和2019新型冠状病毒(SARS-CoV-2)感染或再激活,临床应用时须重视并考虑给予抗病毒治疗、磺胺类药物或在治疗前接种SARS-CoV-2疫苗。T细胞免疫疗法治疗前后需要监测患者的感染症状和体征,并及时给予抗病毒治疗。
3.4 骨髓抑制
因骨髓抑制而导致的中性粒细胞减少和血小板减少是T细胞免疫疗法常见的不良反应( 表2 ),患者在接受淋巴细胞清除化疗和CAR-T细胞回输后可能发生持续数周的中性粒细胞减少和血小板减少。在T细胞免疫疗法治疗期间,需要对患者进行风险评估和规范性防治。出现中性粒细胞减少的患者可考虑使用粒细胞集落刺激因子(G-CSF),若患者持续出现中性粒细胞减少,可考虑增加G-CSF的给药剂量。若患者出现发热性中性粒细胞减少症,应评估是否发生感染,并根据医嘱使用广谱抗生素、输液和其他支持治疗。
对于发生血小板减少的患者,可结合患者的体能状态、耐受性和症状给予治疗。对于出血的患者,可输注血小板或联合重组人血小板生成素,若患者持续出现血小板减少,可考虑给予血小板生成素受体激动剂。双特异性抗体的给药方案需根据对应药物的说明书或临床应用指导原则进行管理,必要时可考虑停用双特异性抗体。
3.5 TLS
TLS是大量肿瘤细胞内容物迅速释放到全身而引起的一组综合征,包括高尿酸血症、急性肾损伤、心律失常等。T细胞免疫疗法的相关研究显示约1%~2%患者出现TLS。肿瘤负荷高、肿瘤细胞增殖快、肾功能不全、脱水或尿酸升高的患者TLS发生风险更高,这类患者可考虑治疗前24 h开始水化和碱化治疗,必要时可使用利尿剂。对于出现TLS的患者须密切监测心电图、血压及血氧饱和度,并给予纠正电解质异常和抗高尿酸血症等治疗。
3.6 燃瘤反应
T细胞免疫疗法有导致燃瘤反应的风险,发生率约0.6%~8.1%( 表2 ),大多数发生在双特异性抗体治疗的第1个周期和CAR-T细胞输注后的第2天至第8天。燃瘤反应的特征是病灶短期内体积增大,伴有红斑、疼痛和发热,并可导致局部压迫或器官功能障碍。对于气道或纵隔附近有巨大肿瘤病灶的患者,须密切监测,可考虑住院并给予皮质类固醇、呼吸道管理、减压、气管造口术或支架置入术等。
3.7 B细胞再生障碍和低丙种球蛋白血症
接受CAR-T细胞治疗的患者可能发生B细胞再生障碍和低丙种球蛋白血症,增加了感染发生风险。B细胞再生障碍和低丙种球蛋白血症的管理可参考《2024中国临床肿瘤学会CAR-T细胞治疗恶性血液病指南》 和2022年抗CD19 CAR-T治疗B细胞NHL不良反应临床管理中国专家共识与指南。
3.8 心脏不良反应
CAR-T细胞疗法还可能导致各种器官系统不良反应,如心律失常和心力衰竭等心脏不良反应等,导致治疗中断或延迟,并损害患者的心脏功能。心脏不良反应的管理和监测可参考2022年欧洲心脏病学会肿瘤心脏病指南。
4 特殊人群用药
在T细胞免疫疗法应用于各类特殊人群的临床实践中,应特别关注其安全性和有效性。在双特异性抗体治疗期间,其在轻度肝功能不全[总胆红素>正常值上限(ULN)~1.5倍ULN,或天冬氨酸氨基转移酶>ULN]、轻度或中度肾功能不全(肌酐清除率30~90 ml/min)患者中的药代动力学无显著差异。目前尚缺乏双特异性抗体或CAR-T细胞疗法在妊娠期或哺乳期女性患者和儿童患者中应用的数据。
5 结语
T细胞免疫疗法通过激活患者自身的T细胞等效应细胞,实现对肿瘤细胞的精准杀伤,显著改善了侵袭性B细胞淋巴瘤患者的预后。目前,多款CAR-T细胞疗法和双特异性抗体已在全球范围内获批上市,并在我国得到应用,为R/R LBCL和R/R MCL患者提供了新的治疗选择。然而,T细胞免疫疗法的应用也伴随着一系列挑战,如长期安全性、T细胞耗竭及耐药问题等。期望未来有更多的研究进展,为临床医生提供更加坚实和全面的循证证据,从而优化治疗方案。随着相关临床数据的不断更新和临床实践经验的不断积累,后续将对本共识进行补充和更新。











 苏公网安备32059002004080号
苏公网安备32059002004080号


