2025年7月2~5日,在西班牙巴塞罗那举行的ESMO胃肠道肿瘤大会(ESMO GI)上,美国纪念斯隆·凯特琳癌症中心(MSKCC)胃肠道肿瘤科主任Yelena Y. Janjigian教授,以“免疫疗法在胃/胃食管结合部癌治疗中的作用”为题进行了一场精彩的专题报告,系统梳理了胃/胃食管结合部癌免疫治疗的最新进展、生物标志物的应用、耐药机制及未来方向。

核心要点
免疫检查点抑制剂(ICI)已重新定义了胃/胃食管结合部癌的治疗,尤其是在生物标志物富集的人群中。
胃癌一线治疗方案现已常规联合抗PD-1药物与化疗±靶向药物(针对HER2、CLDN18.2、FGFR2b)。
基于ctDNA的MRD检测为MSI-H肿瘤的个体化辅助免疫治疗提供了新策略。
针对Treg介导的抑制和血管生成等耐药机制,正在通过Fc工程化抗体、双特异性抗体和细胞疗法加以应对。
胃癌免疫治疗未来前景广阔,合理的联合方案和生物标志物驱动的临床试验设计是改善长期预后的关键。
胃食管癌的分子分型与治疗策略基础
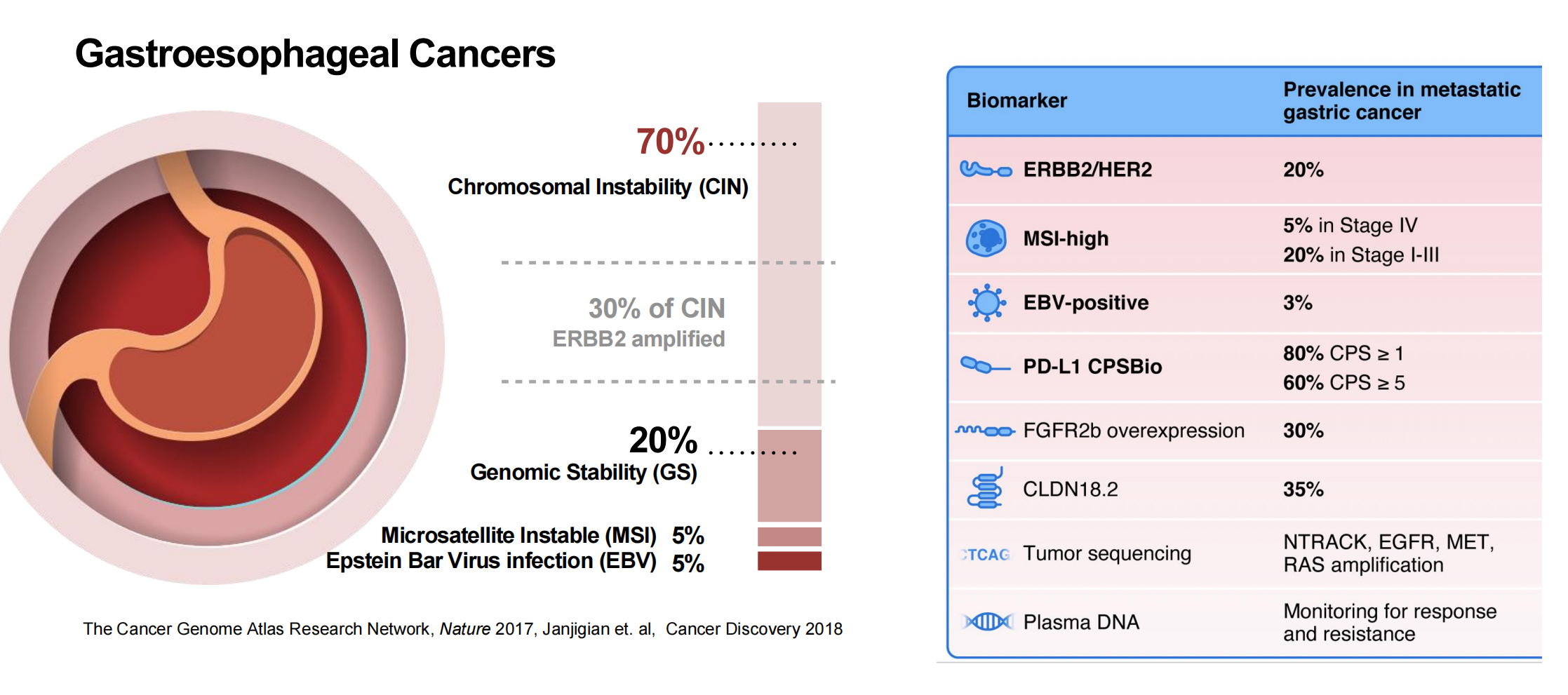
Yelena Y. Janjigian教授的演讲始于对胃食管癌复杂生物学背景的深刻剖析。她指出,根据TCGA分子分型,胃食管癌可被划分为四大亚型,其中染色体不稳定型(CIN)最为普遍,占比高达70%。这一亚型对单一免疫疗法的反应相对有限,构成了临床治疗的主要挑战。其余亚型包括基因组稳定型(GS)(占比20%)、微卫星不稳定型(MSI)(占比5%)和EBV感染型(占比5%)(图1),各自具有独特的分子特征。
在这样的异质性背景下,生物标志物的检测与应用成为精准治疗的基石。Yelena Y. Janjigian教授详细列举了当前转移性胃癌中的关键生物标志物及其发生率,如HER2(约20%)、MSI-H(IV期占5%,I-III期达20%)、PD-L1(约80%的患者CPS≥1,60%的患者CPS≥5)、以及新兴的FGFR2b过表达(约30%)和CLDN18.2(约35%)(图1),强调了基于这些标志物进行患者分层和治疗选择的重要性。
术后辅助治疗:ctDNA指导下的个体化免疫治疗
此次专题报告的一大亮点是关于循环肿瘤DNA(ctDNA)在微小残留病灶(MRD)检测及其指导个体化辅助免疫治疗中的应用。既往发表于《自然·医学》(Nature Medicine)的研究已证实,术后ctDNA阳性是复发的强预测因子,其生存曲线与ctDNA阴性患者存在显著差异(HR=10.0)。
基于此,Yelena Y. Janjigian教授团队开展了一项研究,旨在探索对术后ctDNA阳性的MSI-H实体瘤患者进行帕博利珠单抗辅助治疗的有效性。研究对接受标准手术和/或化疗后的MSI-H实体瘤患者进行ctDNA检测。ctDNA阴性患者进入观察队列,而ctDNA阳性患者则接受帕博利珠单抗辅助治疗。关键研究结果显示:
第一,在174例入组患者中,11%在标准治疗后ctDNA阳性,其中胃食管癌的阳性率最高(35%)。
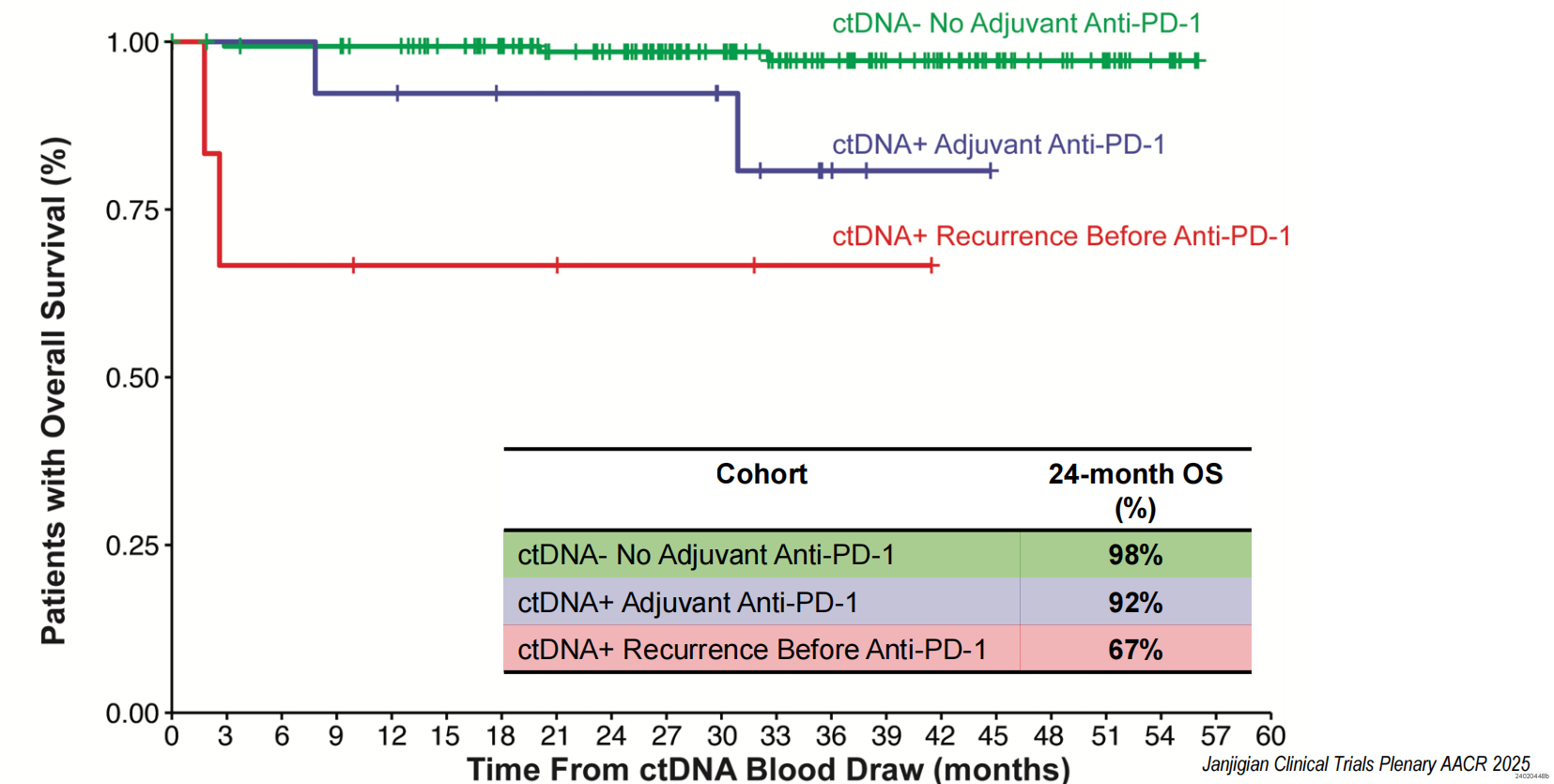
第二,ctDNA阴性队列的24个月无复发生存(RFS)率达94%。相比之下,ctDNA阳性并接受帕博利珠单抗辅助治疗的队列,24个月RFS率为64%,展现出明确的治疗获益;而那些在接受治疗前即影像学复发的患者,RFS率为0%(图2)。24个月OS率同样证实了该策略的价值,ctDNA阴性组为98%,ctDNA阳性辅助治疗组为92%,而未及时治疗的复发组仅为67%(图3)。
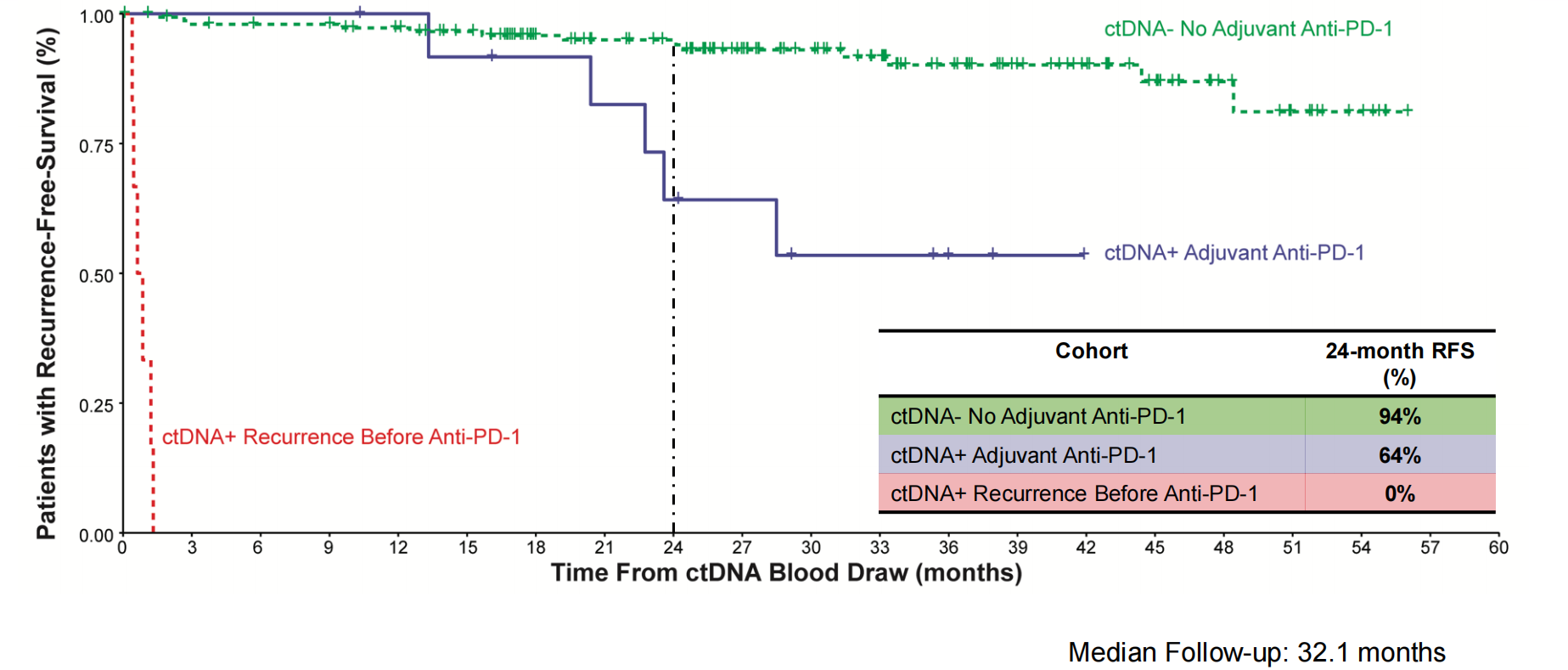
图2 不同ctDNA表达患者的RFS
第三,在接受帕博利珠单抗辅助治疗的患者中,6个月ctDNA清除率为85%(11/13),至9个月时ctDNA清除率达到100%。
第四,尽管ctDNA清除率很高,但仍有38%(5/13)的患者在ctDNA转阴后出现了影像学复发。这表明ctDNA检测虽为高危MSI-H实体瘤患者提供了个体化辅助治疗的新策略,但仍需进一步研究以优化治疗方案。
胃癌一线治疗的演进:从化疗到“化疗+免疫±靶向”
在晚期胃癌一线治疗方面,Yelena Y. Janjigian教授通过一张清晰的时间轴,回顾了胃癌治疗的变革(图4)。从1994年的5-FU化疗,到2010年曲妥珠单抗开启的HER2靶向时代,再到2021年以纳武利尤单抗联合化疗(CheckMate-649研究)和帕博利珠单抗+曲妥珠单抗+化疗(KEYNOTE-811研究)成为新标准,直至2023年及之后对CLDN18.2(佐妥昔单抗,SPOTLIGHT/GLOW研究)和FGFR2b(贝玛妥珠单抗)等新靶点的突破,每一步都标志着治疗理念的深化。
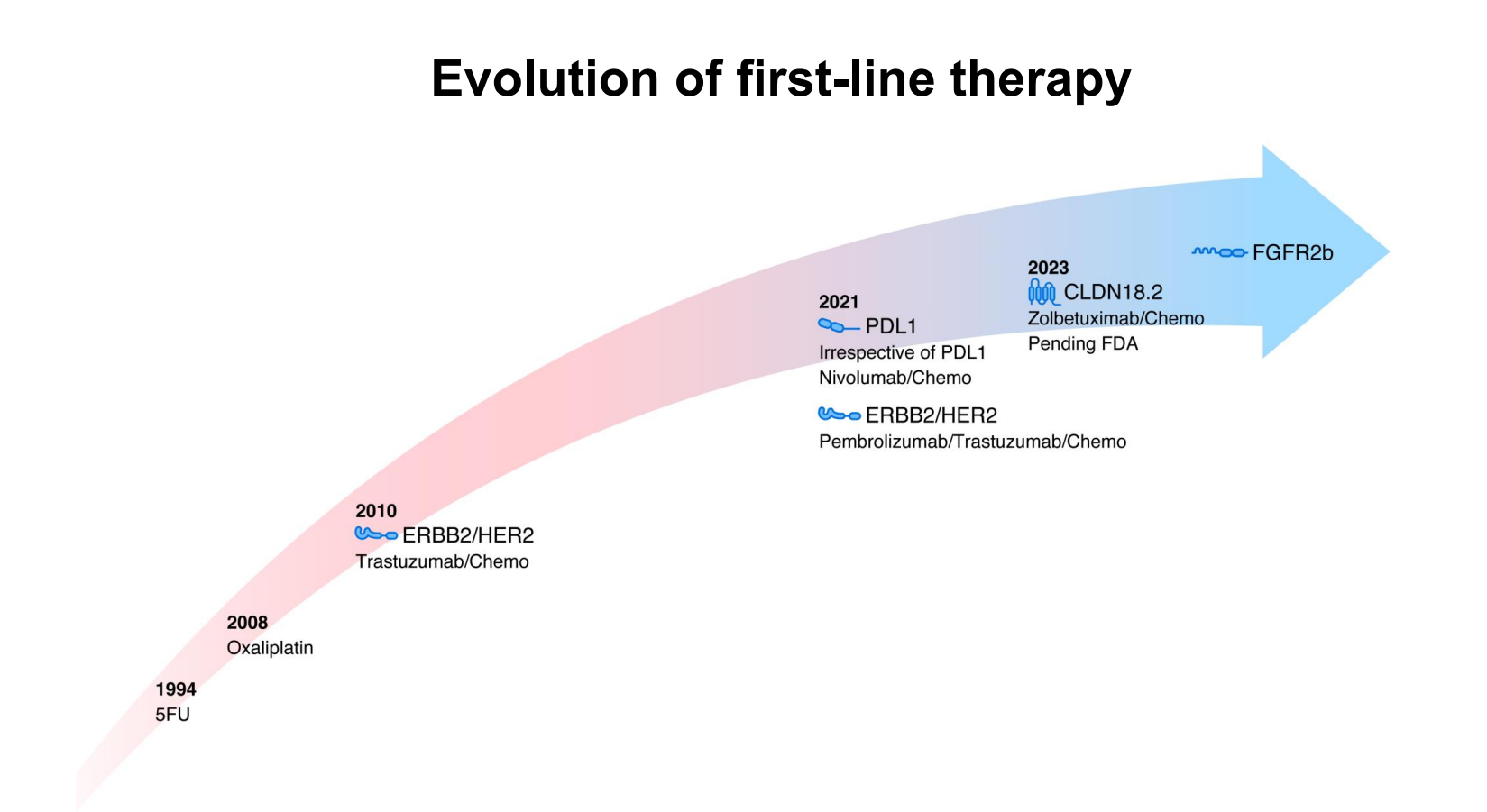
目前,免疫联合化疗已在全球范围内成为转移性胃食管结合部腺癌的一线标准。Yelena Y. Janjigian教授通过展示上述里程碑式研究的生存曲线,阐述了“化疗+免疫±靶向”方案已将患者的中位总生存期(mOS)从不足一年提升至14~20个月,3年OS率达到20%~28%,5年OS率达到16%。
美国食品药品监督管理局(FDA)的ODAC(肿瘤药物咨询委员会)会议分析强调了PD-L1 CPS评分的重要性。汇总分析显示,免疫治疗的疗效与PD-L1 CPS水平密切相关。具体而言,CPS≥10的患者从免疫治疗中获益最大(HR<0.7),而CPS<1的患者几乎无获益(HR 0.91)。基于此,ODAC投票支持将PD-1抑制剂仅用于CPS≥1的患者,这使得生物标志物检测在临床决策中不可或缺。
克服耐药与未来方向:探索联合治疗新模式
尽管ICI取得了巨大突破,但耐药性,特别是CIN亚型中的原发性和继发性耐药,仍然是巨大挑战。Yelena Y. Janjigian教授阐述了未来的研究方向,重点在于通过创新的联合疗法,靶向并重塑免疫抑制的肿瘤微环境。
靶向Treg细胞
抗CTLA-4与抗CCR8:数据显示纳武利尤单抗+伊匹木单抗联合方案在所有患者中的客观缓解率(ORR)为23%,虽未能显著改善OS,但在Treg+亚组中的潜力值得关注。而新型抗CCR8抗体LM-108,能选择性清除肿瘤浸润性Treg,在PD-1抑制剂经治患者中展现了36%的ORR(二线患者中ORR高达64%),mPFS达6.5个月,前景可期。
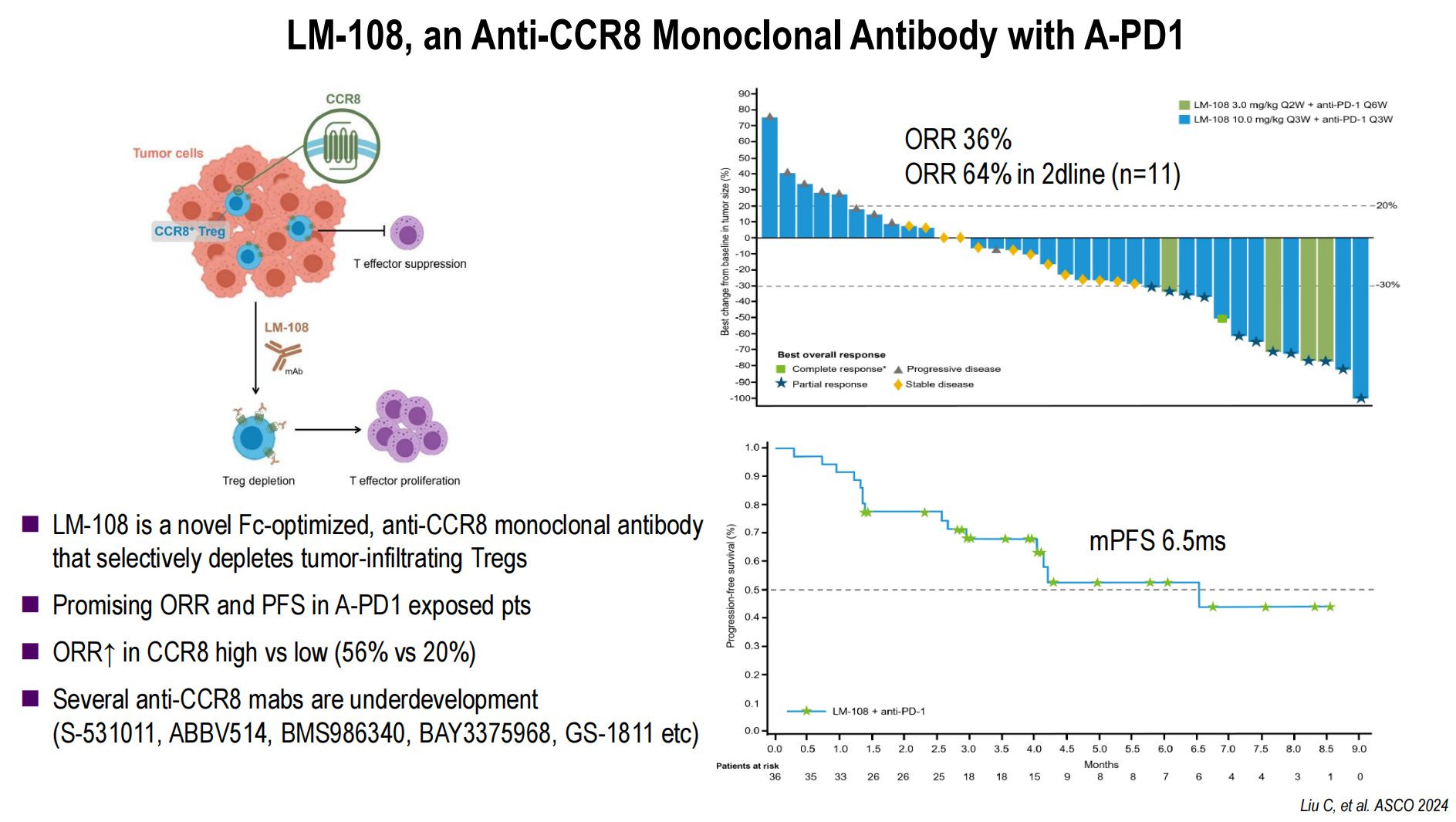
双特异性抗体
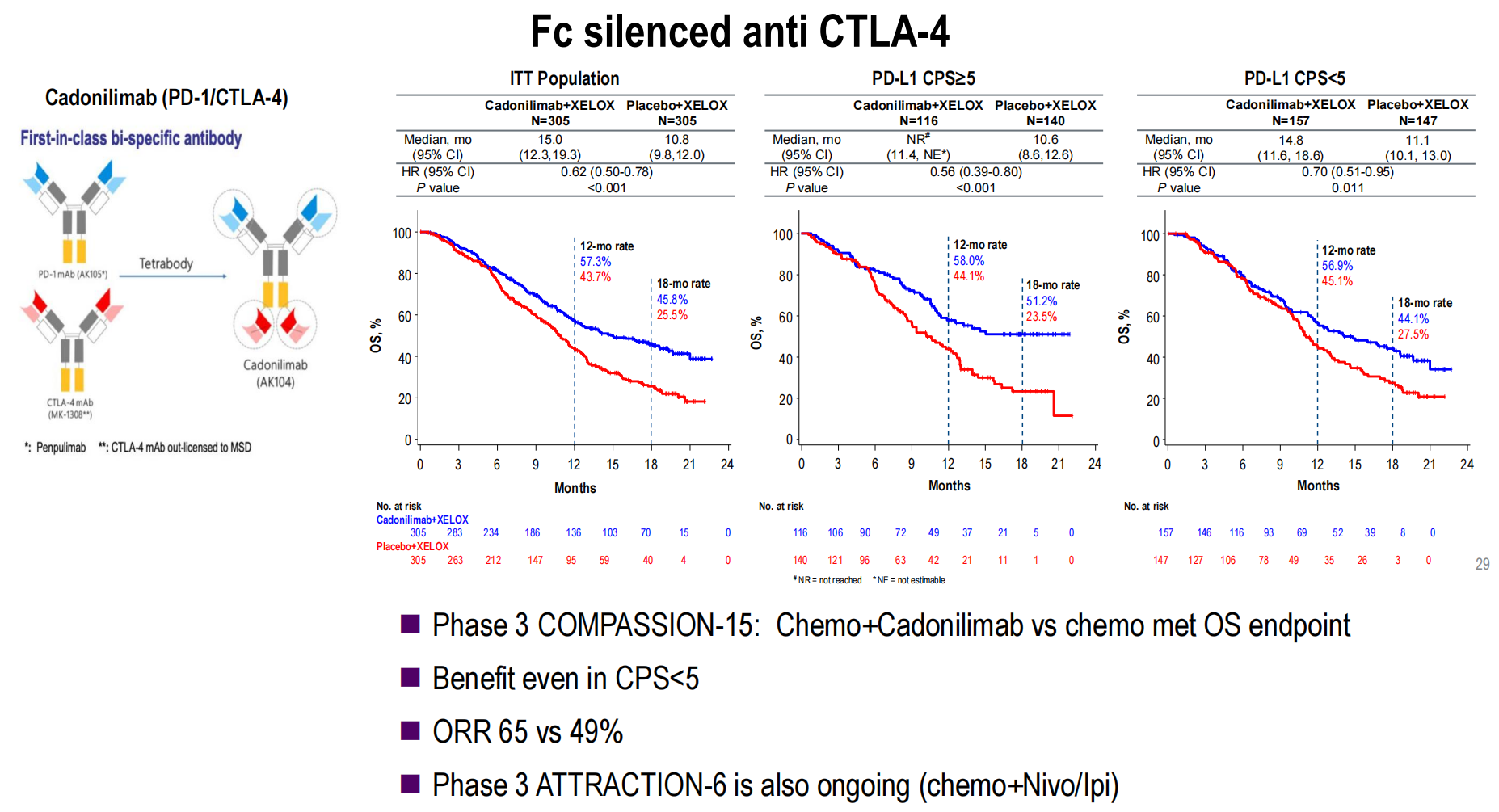
卡度尼利单抗(PD-1/CTLA-4):III期COMPASSION-15研究达到OS主要终点,卡度尼利单抗联合化疗对比单纯化疗显著改善了所有患者的OS(mOS 15个月 vs 10.8个月, HR=0.62, P<0.001),且在PD-L1 CPS<5的人群中同样观察到获益(HR=0.70,P<0.011),显示出优秀的疗效和良好的耐受性。
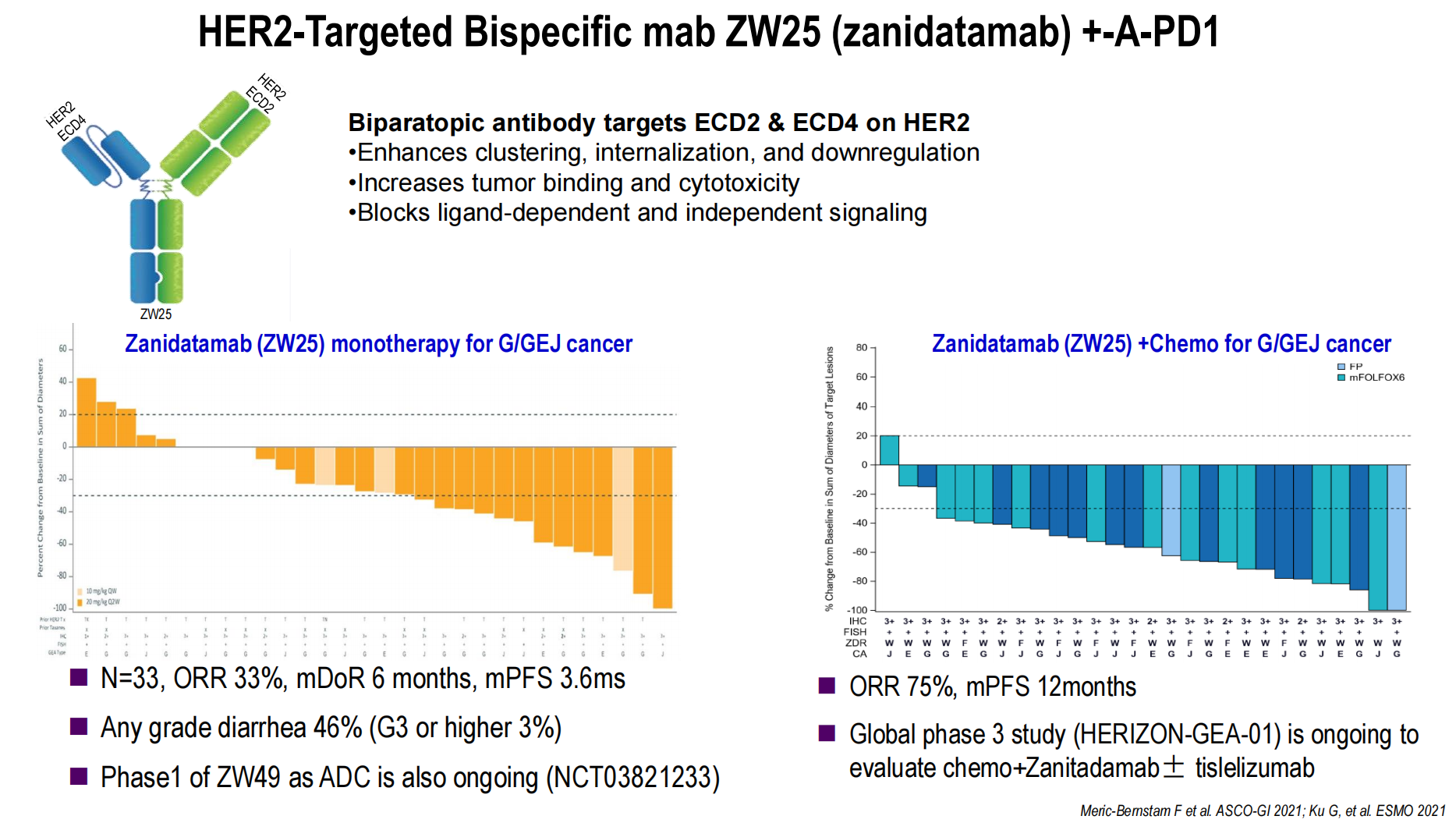
泽尼达妥单抗(ZW25,HER2双抗):该药物可同时结合HER2的两个不同表位,增强抗肿瘤活性。泽尼达妥单抗联合化疗的数据显示ORR高达75%,mPFS达12个月。其全球III期研究(HERIZON-GEA-01,泽尼达妥单抗联合化疗±替雷利珠单抗)正在进行中。
抗体药物偶联物(ADC)
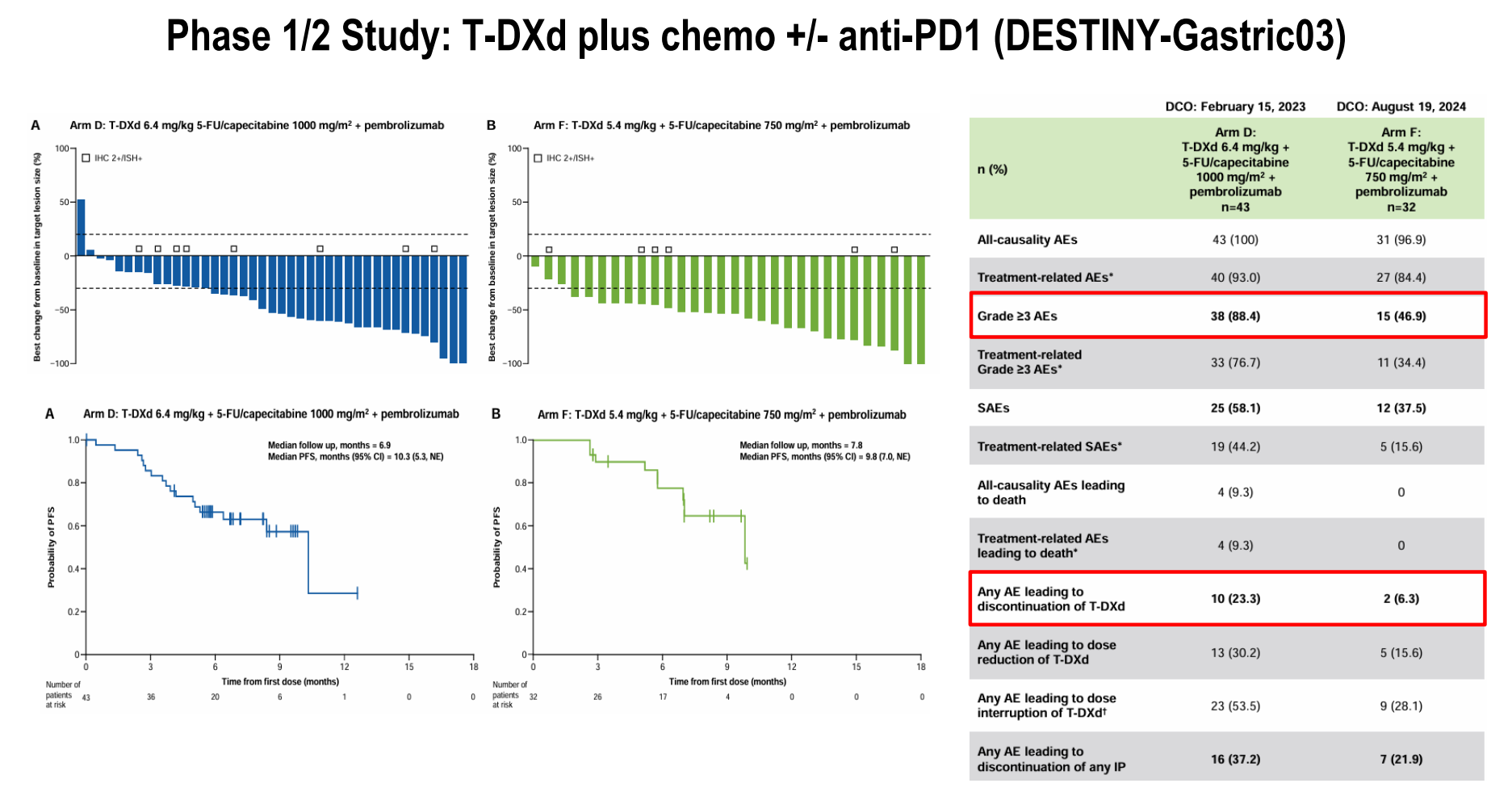
德曲妥珠单抗(T-DXd):不同剂量德曲妥珠单抗(5.4mg/kg或6.4mg/kg)联合化疗及帕博利珠单抗一线治疗的I/II期DESTINY-Gastric03研究展示了出色疗效(ORR、PFS)。这一积极结果为正在进行的III期研究DESTINY-Gastric05奠定了基础,其结果非常值得期待。
抗TIGIT抗体
Fc端沉默的抗TIGIT抗体Domvanalimab联合PD-1抑制剂(Zimberelimab)和化疗的II期研究显示ORR达59%,相关的III期研究(STAR-221)正在进行中。
细胞疗法
iNKT细胞疗法(agenT-797):这是一种同种异体的iNKT细胞疗法,通过CD1d介导的细胞毒性并激活IFN-γ等免疫反应,在联合Fc增强的抗CTLA-4抗体(BOT/BAL)时,可明显增加肿瘤内的免疫细胞浸润,并促进三级淋巴结构(TLS)的形成。
排版编辑:肿瘤资讯-Marie











 苏公网安备32059002004080号
苏公网安备32059002004080号


