肝内胆管癌(ICC)靶向和免疫治疗的快速发展对其病理诊断提出了更高的要求,为了充分应用新型的靶向治疗手段、帮助患者更大生存获益,精准检测已成为ICC领域大势所趋。为此,《肝内胆管癌精准检测专家共识(2024版)》1和《Guideline of precisional testing in intrahepatic cholangiocarcinoma: an international expert consensus》2应运而生,为临床实践提供了规范化指引。值此契机,本文特邀两部共识的通讯作者、复旦大学附属中山医院纪元教授接受专访,对共识进行共识解读,并以必检靶点IDH1为例分享检测策略优化之道,畅谈精准检测的“中山经验”。
复旦大学附属中山医院
博士,主任医师, 博士生导师复旦大学附属中山医院分子病理中心主任、病理科副主任、实验中心副主任、肝胆胰病理亚专科主任
上海市肝病研究所病理学平台主任
中国抗癌协会肝癌专业委员会病理学组组长
中国食品药品监督研究院医用高通量测序标准化技术归口单位专家组成员
国家癌症中心国家肿瘤质控中心肝癌质控专家委员会委员
美国Hans Popper 肝脏病理学会committee member
作为主要撰稿人执笔多部国内指南及共识
精准需求使然,患者获益所向
ICC精准检测共识为临床和病理提供重要实操指引
请您谈谈《肝内胆管癌精准检测专家共识(2024版)》和《Guideline of precisional testing in intrahepatic cholangiocarcinoma: an international expert consensus》制定的背景、过程和意义。
纪元教授:
随着学术界对肿瘤生物学行为认识的深入,ICC已被作为与肝细胞癌完全不同的肝癌类型进行诊治。文献数据显示,40%~50%的ICC存在潜在可干预靶点。2022年,中国抗癌协会(CACA)肝癌专业委员会病理学组组织国内相关专家制定发表了《肝内胆管癌病理诊断专家共识(2022版)》,总结了ICC靶向和免疫治疗的生物标志物及相应药物,强调了大、小胆管分型及不同病理亚型临床预后和分子靶点上的差异。
时隔两年,精准检测和治疗快速发展,检测手段及药物的可及性也有了较多变化,业内相关经验更加丰富。鉴于ICC患者亟待改善的预后现状以及精准诊治日益明确的获益价值,CACA肝癌专业委员会病理学组和CACA肿瘤病理专业委员会肝脏病理学组在前期工作基础上,综合国内外最新指南/共识和研究数据,结合中国国情,制定了《肝内胆管癌精准检测专家共识(2024版)》,聚焦ICC重要靶点,围绕ICC分子检测的对象、内容和技术,形成了15条基本共识,旨在进一步规范和优化临床实践。
期间历经多次讨论和修订,广泛吸纳多学科专家意见,不断完善,从启动到发表历时1年余方才面世,可谓凝集了一众专家智慧和心血的匠心之作。该共识于2025年初见刊后,受到了业内专家、同道高度关注,印证了该领域极为迫切的需求,希望共识能为大家提供有益、实用的指导。
而国际专家共识的形成同样是源于需求、基于实际。国内外同行在交流中发现,国际上对于ICC的诊断和治疗,同样有很多空白和争议之处,精准检测共识亦是业之所需。因此,该共识与上述中国共识同步启动,两大学组牵头,并邀请了来自新加坡、澳大利亚、美国等多位国际专家共同撰写,集思广益,已于前期发布和见刊,并于国际学术会议中亮相,引发了国际同行广泛关注,希望我们的经验和智慧能惠及全球更多患者。

您认为目前临床在精准检测方面的主要困难有哪些?这两份共识将如何帮助医生更好地应对这些挑战?
纪元教授:
目前ICC分子检测的困难主要体现在三大方面,一是取材,涉及到标本类型及病灶的选择;二是分子检测策略的制订,包括检测项目和方式的选择;三是临床与病理医生的“默契”配合。取材的困难源于疾病特点和临床医生对样本要求的掌握度。可手术患者的取材相对容易,但临床中70%~80% 的ICC患者在确诊时已失去手术机会,样本获取相对困难,且组织量往往很少,如需进行多种检测,则更是“捉襟见肘”。
检测策略需要临床与病理共同制订,全面考量患者个体化需求、送检标本类型、标本质量、基因特点、平台可及性、检测周期及费用等因素。这些问题在两份共识中都有相应的讨论和推荐意见,相信能够为临床提供比较清晰的指引。此外,临床与病理医生的密切协作至关重要,通俗言之,就是彼此应知道对方想要什么,临床医生应知道病理医生想要什么样的标本,而病理医生应知道临床医生想要哪些有价值的信息,如此才能事半功倍、高效诊治。共识中不仅推荐了检测靶点,也阐述了相应的靶向和免疫治疗药物现状,便于临床与病理的“双向奔赴”。对于检测平台有限的单位,如果有些检测项目尚无法开展,可以让患者将样本递送到大型中心进一步检测,以寻找更好的治疗方向。
值得注意的是,2024版中国共识和国际共识遵循的循证医学证据和证据质量评估标准是一致的(均为GRADE系统),但推荐等级会根据国内外检测手段的可及性差异因地制宜进行调整,因此中国共识更加符合我们目前的国情。以IDH1检测为例,逆转录-聚合酶链反应(RT-PCR)和DNA-二代测序(NGS)在国外都可以常规应用,但国内尚无获批的PCR试剂可用,因此国内和国际共识对PCR的推荐强度各异。未来,随着检测手段和治疗药物的进展,共识将持续更新,力求与时俱进、紧密贴合实际。
优化检测策略,推动试剂可及
让IDH1必检靶点真正应检尽检
IDH1突变是ICC的重要生物标志物之一。在实际工作中,应如何提高ICC中IDH1突变的阳性检出率?
纪元教授:
要提高ICC中IDH1突变的阳性检出率,首先需要临床医生主观重视这一靶点的价值。根据文献报道,中国ICC的IDH1突变率为4.9%~20%,尤其是小胆管型ICC中发生率更高。针对IDH1突变的靶向治疗,目前已有艾伏尼布获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于IDH1突变晚期胆管癌的治疗,并被中国临床肿瘤学会(CSCO)、美国国立综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)等多部国内外权威指南Ⅰ级推荐用于二线治疗,其关键性研究已证实能为患者带来显著生存获益。因此,IDH1已成为共识中ICC的必检靶点(表1)。临床中对已确诊ICC的患者应积极送检寻找获益机会。
表1. 肝内胆管癌必检和可检生物标志物及检测方法
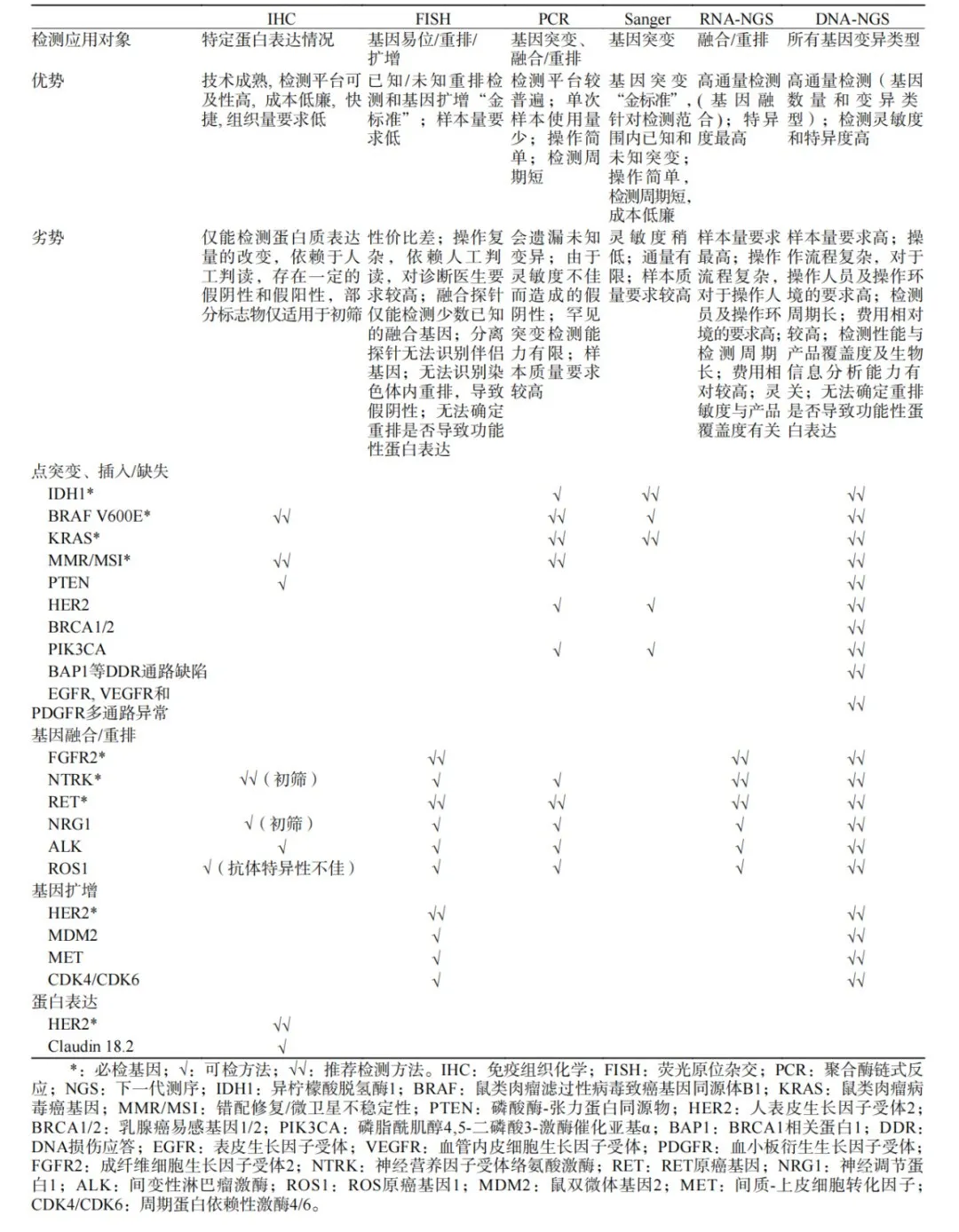
选择合理的检测方法是提高检出率的关键。IDH1突变的检测方法包括RT-PCR、Sanger测序和NGS。其中RT-PCR的检测灵敏度高于Sanger测序,但如前面提到的,用于ICC中IDH1检测的RT-PCR试剂国内尚不可及,因此共识中仅作为可检方法(表1)。尽管国内IDH的PCR检测在胶质瘤中应用已十分成熟,但由于突变类型差异和可及性问题,其试剂并不适用于ICC。免疫组织化学(IHC)检测同样缺乏可及的特异性抗体。因此,对于IDH1这一ICC中极为重要的靶点,迫切需要临床可及的检测试剂,从而提高检出率。高通量测序的灵敏度和特异度最高,可涵盖ICC中IDH的常见突变,如R132C、R172K等,能够更全面地发现异常,例如共突变和其他基因变异,更有利于找到可用的靶向治疗机会,尤其是对于不可切除/转移性ICC患者,有效的系统治疗是他们唯一的生存获益希望。但任何事物都是“一体两面”的,有利亦有弊,高通量测序也不例外,其对样本量的要求较高,费用也相对较高。
国内共识对IDH1检测的推荐意见是:“IDH1突变是ICC的重要生物标志物,强调ICC患者、特别是小胆管型ICC患者行IDH1突变检测的重要临床意义;推荐选择NGS法,可同时检出多种形式的IDH1突变位点。若NGS不可及,可采用Sanger法,但灵敏度有限(证据级别:高,推荐级别:强)”。
值得强调的是,检测工具可及性依然是目前国内ICC的IDH检测中一大突出局限,极大限制了这一必检靶点“应检尽检”的落地,也就间接限制了相应靶向治疗的获益人群。美国FDA已批准基于NGS平台的Oncomine Dx Target Test(Thermo Fisher Scientific)作为胆管癌、非小细胞肺癌和甲状腺癌患者进行艾伏尼布用药的伴随诊断,但国内并不可及。作为病理科医生,我们迫切希望国家能够尽早出台相应政策,以填补ICC中IDH检测可及性的局限,譬如允许医疗机构自行研制使用体外诊断试剂(HDT);也希望有相应企业与大型病理中心合作开发ICC的IDH检测试剂,而选择本中心这类ICC收治病例数多、已获得ICC的HDT三类备案的机构合作,能够明显缩短开发周期、加速产品获批上市。此外,试剂也可作为伴随诊断参与到靶向药物的临床研究中,验证药物有效性与安全性的同时,也可同步验证诊断试剂对药物获益人群的预测价值,从而加速试剂获批上市。
样本类型的选择亦在很大程度上影响检测的阳性率。例如ICC患者只能取到骨转移灶组织时,由于骨样组织需要脱钙,造成很多核酸被破坏而难以检测,此时可用外周血液体活检作为补充。一项大样本晚期胆管癌患者的NGS研究显示,循环肿瘤DNA(ctDNA)与其配对的组织样本中IDH1突变的一致性高达87%,表明当ICC组织学和细胞学样本不可及时,液体活检是一种获得肿瘤分子谱的有效参考依据。
开发空白领域,开设远程通道
复旦中山病理的先进经验与行业担当
在精准检测的研究和应用方面,中山医院有哪些宝贵经验?
纪元教授:
了解尚未被满足的临床需求,并充分发挥平台优势、积极填补领域空白是大型病理中心应当承担的行业责任。本中心已积累了较丰富的试剂开发经验,这一过程是循序渐进、环环相扣的。前期需要一些回顾性研究论证科学性;形成专利后,转化到有三类试剂生产资质的企业生产;之后需要回到本中心实验室进行试剂性能和临床的验证。性能的验证包括精密度、准确度、检测下限等。临床验证主要在本院的手术患者中开展。
以ICC的IDH检测为例,本中心验证的突变率约为12%~14%,突变类型以R132C最多,其他还包括R172K等,这些特点都与文献报道一致。之后需要将相关数据和试剂呈交国家药品监督管理局医疗器械技术审评中心和医疗器械检验研究院审查、检验,审定达到三类试剂注册证要求后,就可在本中心用于临床患者检测,应用范围可拓展至前瞻性样本,积累真实世界数据,后续用于体外诊断(IVD)注册的临床证据审查。若能获批IVD试剂,就有机会在全国范围内推广应用,使更多患者受益。
前面提到,对于分子检测技术和资源有限的中心,患者可将样本送至上级大型中心进一步检测。本中心就开设了这样的远程通道,具有检测样本的异地患者,可通过我院的互联网基因检测咨询门诊进行咨询,请本中心的病理专家帮助制订合适的检测方案,一方面从病理的角度更加准确地甄别ICC病理亚型(如大、小胆管型),另一方面有助于寻找更有效的系统治疗机会。样本以组织学最佳,无法获取时也可尝试体液样本。关于样本质量是否满足检测要求、检测结果等,我们都会向患者及时反馈,尽量不耽误诊疗进程。
总的来讲,精准检测是ICC诊治大势所趋,而规范和优化临床实践势在必行,共识的面世为这一领域的发展奠定了良好基础。未来,希望业内专家同道多多贡献宝贵建议使共识不断修订完善,也希望相关企业界积极参与到检测试剂的开发中来,各方合力推动精准检测真正广泛落地,让好药价值能够物尽其用,让广大患者最大化生存获益!
审校:复旦大学附属中山医院 纪元教授
整理:中国医学论坛报 林颖
1. 中国抗癌协会肝癌专业委员会病理学组,中国抗癌协会肿瘤病理专业委员会肝脏病理学组,上海市抗癌协会肿瘤病理专业委员会.肝内胆管癌精准检测专家共识(2024版)[J].临床肝胆病杂志, 2025, 41(3):432-441.
2. Xin Zhang, Jing Han, Ruoyu Shi, et al. Guideline of precisional testing in intrahepatic cholangiocarcinoma: an international expert consensus. Clinical Cancer Bulletin, 2025, 4(1): 9.
本资料的内容仅作为科学信息参考,并仅用于医疗卫生专业人士间的学术交流之目的,请勿转发或用于任何其他用途。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
审批号:M-TIBSO-CN-202507-00005
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


