弥漫性大B细胞淋巴瘤(DLBCL)作为最常见的侵袭性非霍奇金淋巴瘤,其治疗在过去十年经历了从化疗为主到CAR-T细胞疗法带来革命性突破的转变。而双特异性抗体作为一种新型免疫治疗药物,凭借独特的作用机制和显著的临床疗效,正成为该领域的研究热点。在 2025 年欧洲血液学协会(EHA)大会上,哥本哈根大学国家医院Martin Hutchings教授发表了题为 “Bispecific antibodies in diffuse large B-cell lymphoma” 的专题讲座,系统阐述了双特异性抗体在DLBCL治疗中的研究进展、临床应用及未来方向。本文将详细梳理讲座核心内容,深入解析双特异性抗体的作用机制、临床数据、联合治疗策略及相关争议,为血液肿瘤领域的临床医生和研究者提供全面参考。

DLBCL免疫治疗现状
尽管近年来新药层出不穷,但在CAR-T细胞疗法出现之前,复发/难治性(R/R)DLBCL患者的预后仍然极差。以瑞典2007~2018年间的真实世界数据为例,即使在医疗体系高度发达的国家,R/R DLBCL患者的生存率依然不容乐观。
CAR-T细胞疗法的问世,尤其是Axicabtagene ciloleucel(Axi-cel)、Tisagenlecleucel(Tisa-cel)和Lisocabtagene maraleucel(Liso-cel)等产品的获批,标志着DLBCL治疗格局的改变。在ZUMA-1等关键研究中,CAR-T细胞疗法在既往接受过大量治疗的R/R DLBCL患者中实现了超过50%的完全缓解(CR)率,并在二线治疗中优于传统化疗联合自体造血干细胞移植的标准方案。
然而,CAR-T细胞疗法仍存在可及性、制造周期、毒性管理等方面的限制。因此,双特异性抗体作为一种“现货型”免疫治疗手段,逐渐成为研究热点。
双特异性抗体的作用机制
双特异性抗体能够同时结合效应细胞(主要是T细胞表面的CD3)和肿瘤细胞(目前获批的针对淋巴瘤的双特异性抗体多靶向CD20),从而激活T细胞,通过释放细胞毒性颗粒杀伤肿瘤细胞,同时还能促进 T 细胞的局部增殖和募集,引发进一步的细胞因子和趋化因子释放,增强抗肿瘤效果。在体外实验中,与活性双特异性抗体共孵育的肿瘤细胞在数小时内几乎完全消失,而与灭活抗体共孵育的肿瘤细胞则未受明显影响,这直观地证明了其抗肿瘤活性。
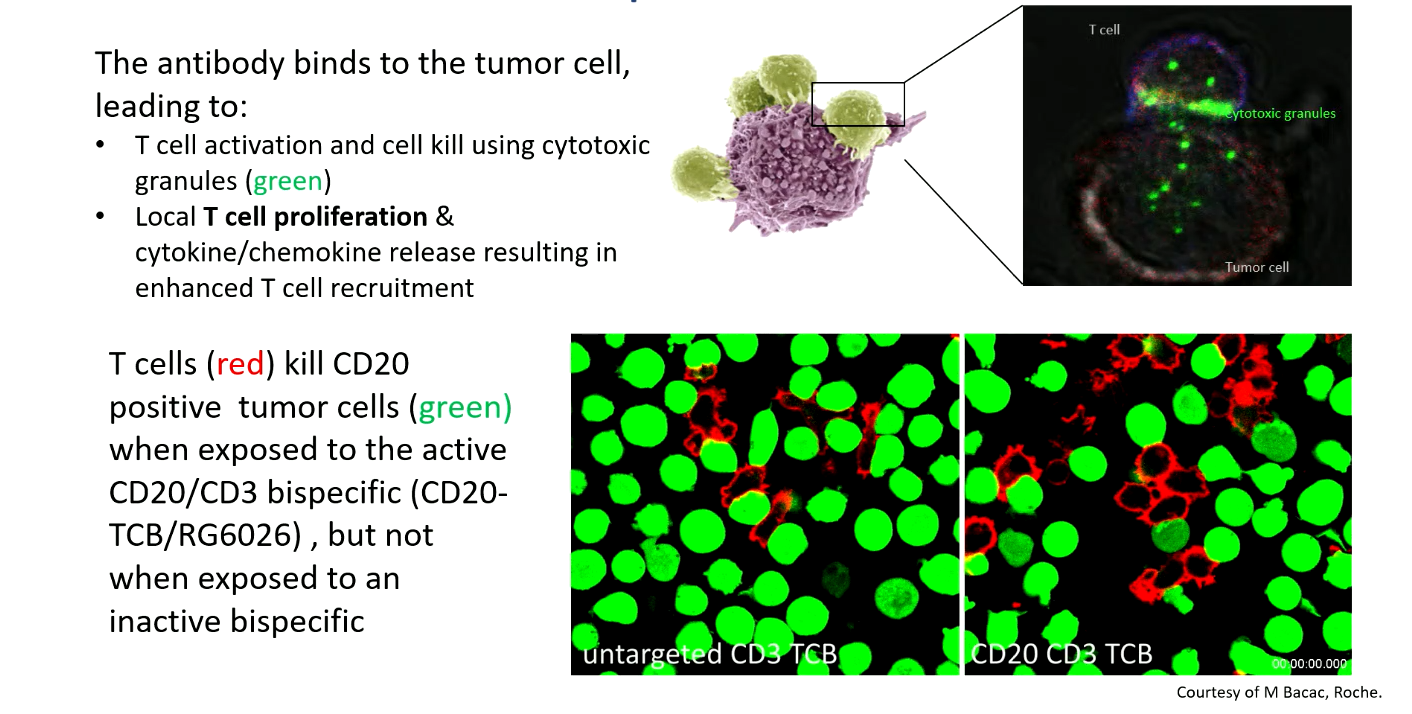
目前,已获批用于DLBCL的双特异性抗体主要包括:
Epcoritamab(CD3×CD20)
格菲妥单抗(CD3×CD20,双CD20结合位点)
莫妥珠单抗(CD3×CD20)
Odronextamab(CD3×CD20)
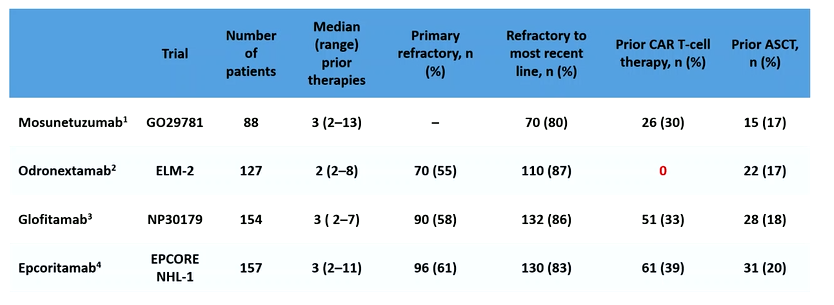
不同双特异性抗体产品治疗≥2线治疗后R/R DLBCL的研究数据如表1所示。
表1. ≥2线治疗后R/R DLBCL的CD20×CD3双特异性抗体研究:登记时的既往治疗
关键临床研究数据解析
不同双特异性抗体的设计特点和给药方案各具特色。例如,Epcoritamab采用皮下给药方式,需逐步递增剂量以减少细胞因子释放综合征(CRS)风险,治疗持续至疾病进展;而格菲妥单抗采用静脉给药方式,具有2:1的结构设计(两个CD20结合域和一个CD3结合域),并固定12个周期的治疗时长;odronxtamab则采用了更为复杂的逐步递增给药方案来控制CRS。这些差异虽未导致疗效的显著区别,却为临床实践提供了多样化的选择。
目前已有多项临床研究数据证实了这几款双特异性抗体在DLBCL中的突破性进展:
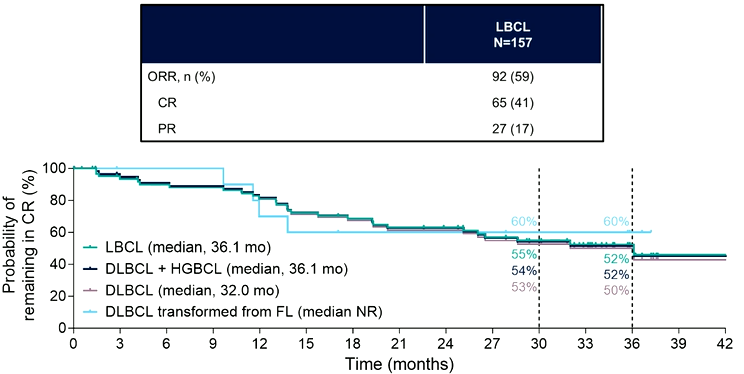
Epcoritamab:一项针对复发/难治性LBCL的Ⅱ期研究显示,其总体缓解率(ORR)达59%,CR率为41%,中位CR持续时间约为3年。在安全性方面,超过50%的患者出现CRS,但多为1~2级,严重CRS罕见。
格菲妥单抗:一项Ⅱ期研究中,其ORR为52%,CR率为40%,中位CR持续时间为29.8个月,约有56.4%的CR患者在24个月时仍处于缓解状态。在安全性方面,CRS发生率为63%,但严重CRS极少。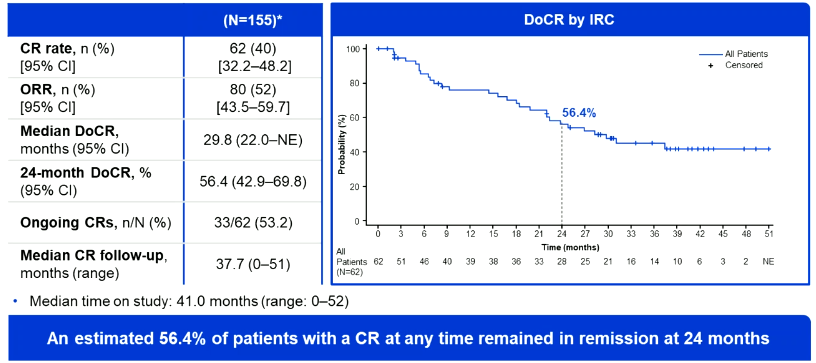
Odronxtamab:一项Ⅱ期研究显示,其ORR为52%,CR率为31.5%。中位缓解持续时间为17.9个月。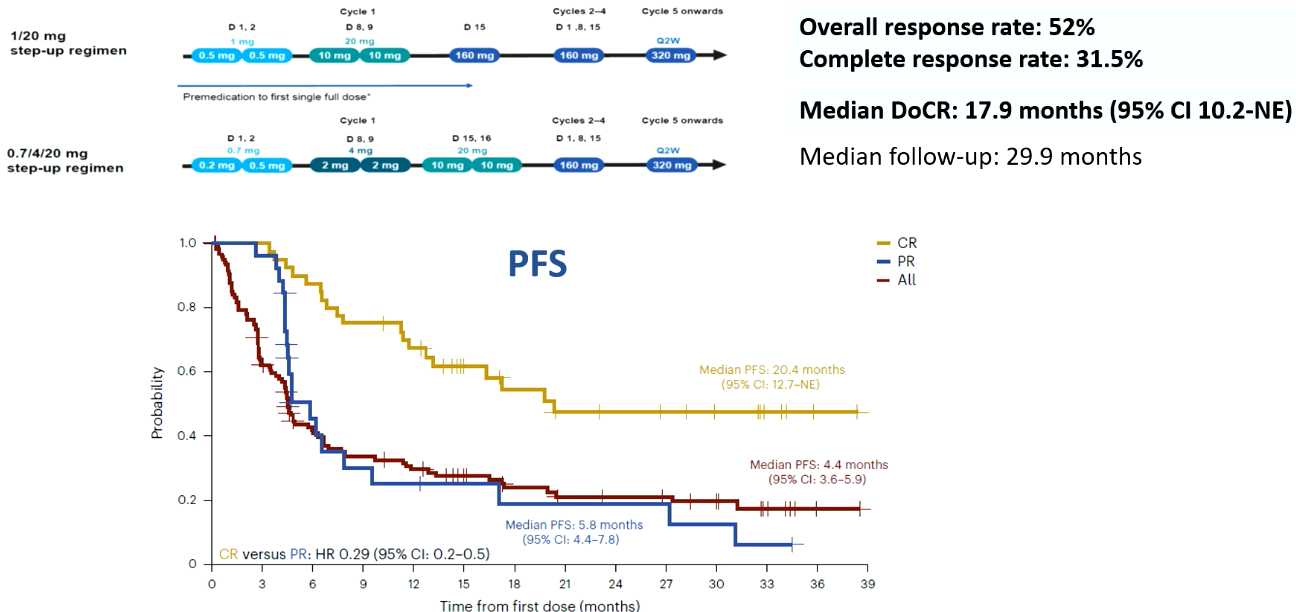
新型CD3×CD19双特异性抗体(AZD0486):其初步研究数据显示更高的剂量依赖性反应率,尽管伴随更高的免疫相关毒性(如ICANS),但其疗效令人期待。
值得注意的是,对于既往接受CAR-T细胞治疗的患者,双特异性抗体同样显示出相当的活性,打破了传统认为的“CAR-T失败后选择有限”的观念。法国DESCAR-T登记系统的回顾性分析进一步证实,双特异性抗体治疗后的患者,后续接受CAR-T治疗时仍可获得与未接受过双抗治疗者相当的疗效,这为治疗顺序的合理安排提供了重要依据。
联合治疗策略的创新探索
单药治疗的成功仅是双特异性抗体发展的起点,而这类药物的真正价值在于其卓越的联合治疗潜力。由于其独特的作用机制和良好的安全性特征,双特异性抗体联合多种抗淋巴瘤药物具有协同作用。
一项Ⅰb/Ⅱ期研究探索了格菲妥单抗联合抗体药物偶联物(ADC)维泊妥珠单抗方案的疗效。结果显示,在R/R LBCL患者中,该联合方案的ORR为80.6%,CR率达到62%,中位CR持续时间为37.8个月。中位无进展生存期(PFS)为12.3个月,24个月PFS率为41.8%。
另一项创新性策略是将格菲妥单抗与englumafusp alfa(CD19-4-1BBL,一种新型的免疫治疗药物)联用,主要研究目标是评估这种联合治疗在延长侵袭性非霍奇金淋巴瘤(aNHL)患者的PFS、总生存期(OS)等关键指标方面的效果。研究数据显示,最佳ORR为68.6%,缓解持续时间为25.9个月。中位PFS为9.9个月,12个月和18个月的PFS率分别为45.8%和40.4%;中位OS为20.4个月,12个月和18个月的OS率分别为61.1%和51.9%。此外,研究还发现,englumafusp alfa能够限制耗竭T细胞的形成,并促进记忆T细胞的形成,显示出良好的抗肿瘤活性,尤其是在接受过CAR-T治疗的患者中。该研究为R/R aNHL患者提供了一种有前景的无化疗、可即用的治疗选择,进一步评估仍在进行中。
更为“传统”但同样重要的是双特异性抗体与传统化疗方案的联合应用。STARGLO研究对比了格菲妥单抗联合GemOx(Glofit-GemOx)方案与利妥昔单抗联合GemOx(R-GemOx)方案在既往接受过至少一线治疗且不适合移植的R/R DLBCL患者中的疗效。结果显示,随访2年,试验组在OS和PFS方面均显著优于对照组[风险比(HR)分别为0.6和0.41],这一优势不受后续治疗影响。总之,STARGLO研究的2年随访数据,进一步证实了Glofit-GemOx方案在R/R DLBCL患者中的长期生存优势。
当前挑战与未来方向
尽管双特异性抗体在DLBCL治疗中已取得重大突破,仍有许多问题亟待解决。治疗顺序的优化便是核心议题之一——现有证据支持CAR-T作为二线治疗首选,双特异性抗体更适合三线治疗或CAR-T不可及的情况,但这一模式是否需要调整,仍需随机对照研究验证。此外,如何识别最可能从双抗治疗中获益的生物标志物,以及如何预防和管理抗原逃逸导致的耐药,都是未来研究的重点。
未来,有望将双特异性抗体向更前线治疗的拓展。目前已有多项将epcoritamab或格菲妥单抗联合标准R-CHOP方案用于初治中高危DLBCL的Ⅲ期研究正在进行,这些试验结果可能进一步改变DLBCL的一线治疗格局。同时,针对不同分子亚型的精准化治疗策略,以及双特异性抗体与其他新型药物(如双表位靶向药物、免疫调节剂等)的创新组合,也代表着未来的发展方向。
讨论环节亮点
在随后的讨论环节中,参会专家围绕以下几个问题展开了深入交流:
复发患者的救治策略:复发患者常见CD20抗原丢失,限制了双特异性抗体的再次使用。专家建议开发靶向其他抗原的药物,如CD19、CD22等。
双特异性抗体的再使用问题:与利妥昔单抗不同,双特异性抗体治疗失败后CD20丢失率较高,限制了其再使用的可能性。
激素使用的差异:Epcoritamab因皮下给药和每周给药方案,需长期使用激素以预防CRS,可能增加感染风险。其他静脉给药的双特异性抗体则无需长期激素干预。
总结
双特异性抗体作为新型免疫治疗手段,已在DLBCL中展现出显著的疗效和良好的安全性。其“现货型”特性、便捷的给药方式以及与多种药物的联合潜力,使其成为CAR-T细胞疗法的重要补充。未来,随着更多临床数据的积累和联合策略的优化,双特异性抗体有望在DLBCL的治疗中扮演更加核心的角色,甚至改变现有的治疗格局。
对于临床医生而言,如何合理选择治疗顺序、识别最佳获益人群、管理不良反应,将是未来实践中的关键问题。而对于科研人员,探索新靶点、优化结构设计、揭示耐药机制,将是推动该领域持续进步的重要方向。
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


