肺癌是全球癌症相关死亡的主要原因。在过去几十年里,免疫治疗为肺癌治疗领域带来了革命性突破,其中以靶向PD-1/PD-L1和CTLA-4抑制剂为代表的免疫检查点抑制剂显著改善了患者的生存预后。然而,临床实践中仍面临两大关键挑战:部分患者存在原发性耐药(对免疫检查点抑制剂无应答),以及大多数初始应答者最终出现获得性耐药导致疾病复发。针对免疫耐药问题,目前多种具有不同靶点和作用方式的免疫疗法正在肺癌的临床试验中开展。

2025年6月17日,中山大学肿瘤防治中心张力教授团队在顶级期刊Nature Reviews Clinical Oncology发表题为 “The next-generation of immunotherapies for lung cancers”(《肺癌新一代免疫治疗》)的重磅综述。该综述系统总结了肺癌免疫治疗的耐药机制,并全面梳理了新一代免疫治疗策略的最新进展,包括新型免疫检查点调节剂、新型免疫细胞衔接器、过继细胞疗法和治疗性肺癌疫苗等,为肺癌新一代免疫治疗指明了研究方向。
通讯作者

张力
▶ 中山大学肿瘤防治中心内科 主任导师、肺癌首席专家,博士生导师,二级教授
▶ 中国抗癌协会癌症康复与姑息治疗专业委员会主任委员
▶ 中国抗癌协会肿瘤药物临床研究专业委员会候任主任委员
▶ 中国临床肿瘤学会免疫治疗专家委员会主任委员
▶ 中国临床肿瘤学会非小细胞肺癌专家委员会副主任委员
▶ 中国临床肿瘤学会肿瘤支持与康复治疗专家委员会副主任委员
▶ 广东省医学会临床研究学分会主任委员
▶ 广东省临床医学会精准医学分会主任委员
第一作者

赵珅
▶ 副主任医师、副研究员、硕士生导师
▶ 中山大学临床医学八年制
▶ 广东省临床医学会肺癌精准治疗与临床研究专业委员会秘书
▶ 广东省抗癌协会化疗专业委员会青委会委员
▶ 2023年CSCO“35位最具潜力青年肿瘤医生”
▶ 研究方向:肺癌靶向治疗、免疫治疗的临床及转化研究
▶ 主持课题:国家自然科学基金、中国博士后基金、中山大学肿瘤防治中心优秀青年人才项目、中国科协科技智库青年人才计划。

赵洪云
▶ 教授、主任医师、博士生导师
▶ 中山大学肿瘤防治中心I期病房主任、临床研究部副主任
▶ 广东省杰出青年医学人才、岭南名医
▶ 中山大学肿瘤防治中心高层次人才特殊支持计划“临床医学科学家”
▶ 广东省临床医学学会肺癌精准治疗及临床研究专委会主任委员
▶ 中国抗癌协会肿瘤药物临床研究专业委员会青年委员会副主任委员
▶ 《健康中国2030》肿瘤健康之“肺癌规范化诊疗”项目组专家顾问
肿瘤微环境(TME)是由多种细胞、细胞外基质及可溶性成分构成的复杂生态系统,而TME的动态变化是目前抗肿瘤免疫治疗面临的一项重大挑战。根据免疫细胞浸润和功能状态,肺癌的免疫微环境可分为三类:
1、免疫炎症型(“热肿瘤”):以高表达TMB和PD-L1为特征,对免疫检查点抑制剂反应率高,如KRAS突变或驱动基因阴性的非小细胞肺癌。
2、免疫荒漠型(“冷肿瘤”):低表达TMB和PD-L1,对免疫检查点抑制剂应答率较低,如EGFR/ALK突变的非小细胞肺癌。
3、免疫排斥型:尽管高表达TMB和PD-L1,但对免疫检查点抑制剂疗效仍较差,如KRAS和STK11/KEAP1/SMARCA4共突变非小细胞肺癌。
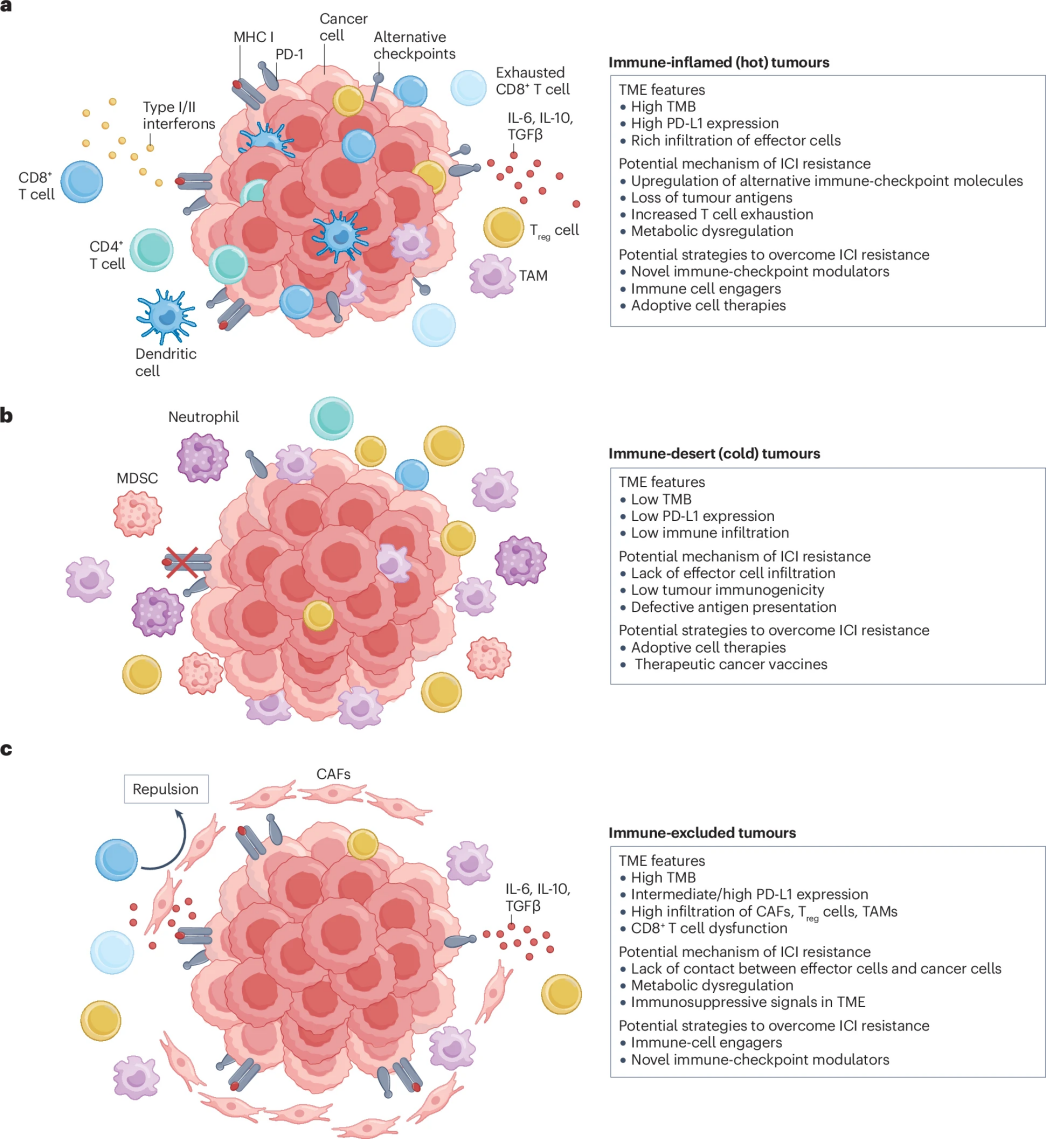
图1.不同类型的肿瘤微环境
这种免疫分型为精准治疗策略的选择提供了重要依据。目前,大量创新性免疫治疗药物已进入临床前和临床研究阶段。
新型免疫检查点调节剂
抗PD-(L)1抑制剂的临床应用成功极大地推动了免疫检查点调节剂的研发进程。目前,通过免疫检查点调节来增强T细胞抗肿瘤活性的策略主要可分为两大类:一类是联合其他免疫调节靶点以增强治疗效果;另一类是靶向其他免疫检查点分子来补充PD-(L)1阻断的不足。
1、PD-(L)1联合靶向治疗策略
在增强PD-(L)1阻断效果的策略中,联合抗血管生成治疗以及转化生长因子-β(TGF-β)展现出显著的效果。例如,同时靶向PD-(L)1和VEGF通路的双特异性抗体ivonescimab和同时靶向PD-(L)1 x TGF-β的双特异性抗体SHR-1701。
HARMONi-A 3期研究数据显示,ivonescimab联合化疗方案显著延长TKI治疗失败的EGFR突变型NSCLC患者的中位无进展生存时间,推动其在中国获批上市。随后的HARMONi-2研究进一步证实,在PD-L1阳性的初治患者中,ivonescimab单药治疗的客观缓解率显著高于pembrolizumab。目前,同类机制的PM8002(抗PD-L1×VEGF)双特异性抗体也已在NSCLC中显示出初步疗效。在一项针对不可切除III期NSCLC患者的概念验证性2期试验中,SHR-1701显示出良好的疗效和安全性,手术转化率较高。SHR-1701单药治疗在PD-L1阳性、EGFR突变或PD-(L)1获得性耐药的晚期NSCLC患者中也表现出抗肿瘤活性。其他同类药物如JS201和Y101D目前仍处于临床开发早期阶段。
2、其他免疫检查点联合策略
在补充PD-(L)1阻断的策略中,CTLA-4靶向治疗最具代表性。CTLA-4在效应T细胞和Tregs表面高表达,其阻断可同时增强T细胞活化和减轻免疫抑制。CheckMate 227、CheckMate 9LA和POSEIDON等研究证实,PD-(L)1/CTLA-4联合方案在晚期NSCLC中具有确切的临床获益。为优化治疗策略,多种靶向PD-(L)1×CTLA-4的双特异性抗体,包括volrustomig、cadonilimab、QL1706和erfonrilimab等正在研发。其中,QL1706联合bevacizumab和化疗方案在EGFR-TKI耐药患者中取得了54.8%的客观缓解率和8.5个月的中位无进展生存时间,展现出良好的应用前景。除此之外,新一代CTLA-4靶向药物在克服PD-(L)1耐药方面展现出独特优势。例如,新型靶点保留型抗CTLA4抗体gotistobart,其通过优化pH敏感性来避免溶酶体降解,从而促进CTLA4循环利用。临床前模型显示,该药物能选择性耗竭Treg细胞并降低毒性。在首次人体1/2期试验中,gotistobart单药治疗在抗PD-(L)1抑制剂经治的NSCLC患者,客观缓解率达27%,疾病控制率为82%。目前3期试验正在开展中。
除CTLA-4外,LAG-3、CD73和NKG2A等靶点也展现出临床潜力。LAG-3抑制剂relatlimab联合nivolumab在PD-L1阳性非鳞NSCLC一线治疗中显示出优于nivolumab单药的疗效,3期临床试验正在进行。CD73靶向治疗方面,oleclumab联合durvalumab在3期NSCLC维持治疗中显示出优于单药的无进展生存时间获益,3期临床研究正在进行。NKG2A抑制剂monalizumab联合durvalumab在3期NSCLC中显示出协同效应,同样被纳入PACIFIC-9研究评估。在肺癌中发现的其他免疫检查点还包括OX40、4-1BB、TIM3和TIGIT。目前,靶向TIM3和TIGIT抑制剂的多项临床研究正在进行。
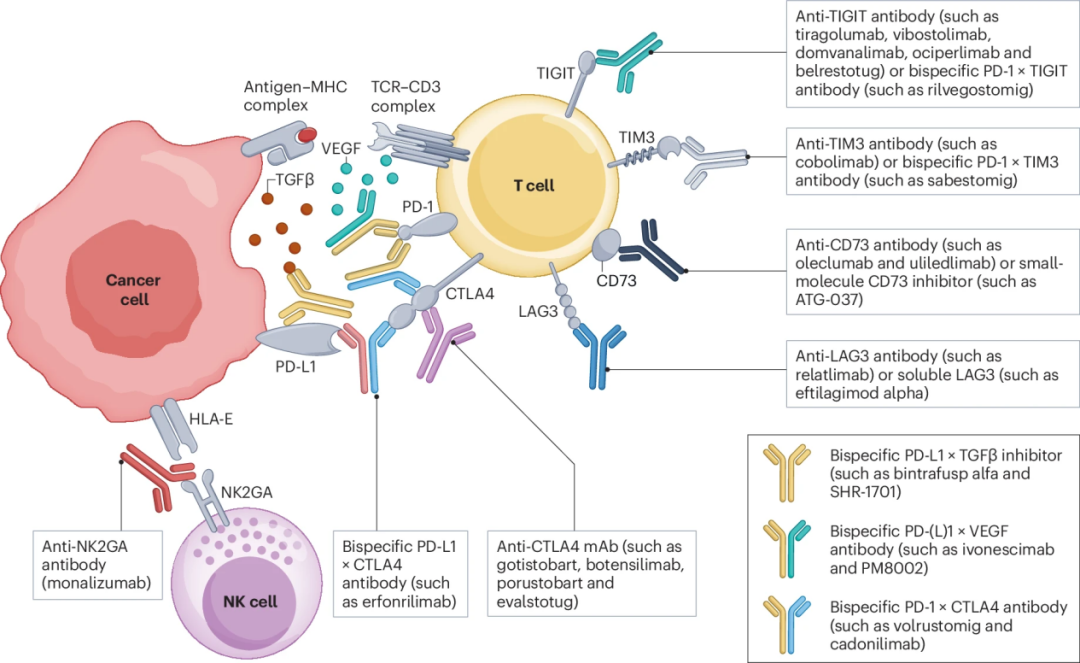
图2.代表性新型免疫检查点抑制剂及作用机制
新型免疫细胞衔接器
免疫细胞衔接器是一类通过工程化抗体技术重新定向免疫细胞(特别是T细胞)以特异性识别和清除肿瘤细胞的治疗药物。该领域的开创性药物是靶向CD3和CD19的双特异性T细胞衔接器blinatumomab。典型的T细胞衔接器由两部分组成:一个靶向T细胞表面CD3复合物的结合域和一个靶向肿瘤特异性抗原(TSA)的结合域,通过同时结合这两种分子激活T细胞介导的细胞毒性。然而,大多数实体瘤主要表达肿瘤相关抗原(TAA),这些抗原在正常组织中也有不同程度表达。因此,如何平衡抗肿瘤活性和靶向/非靶向毒性是开发针对实体瘤的免疫细胞衔接器面临的主要挑战。目前主要通过以下三种策略解决这一难题:
1、提高肿瘤选择性:
具体方法包括:①选择更具肿瘤特异性的靶抗原,如DLL3、Claudin18.2、前列腺特异性膜抗原(PSMA)和EGFRv3等;②同时靶向多个肿瘤抗原;③采用XmAb等技术增加抗原结合价数;④靶向肽-MHC复合物;⑤开发需要肿瘤微环境特异性激活的前药。
例如,同时靶向CD3和DLL3的双特异性抗体tarlatamab。DLL3在神经内分泌肿瘤中高表达而在正常组织中表达受限,是理想的治疗靶点。DeLLphi-301研究显示,tarlatamab在经治SCLC患者中的客观缓解率达32%-40%,中位无进展生存时间为3.9-4.9个月。目前正在开展多项3期临床试验(DeLLphi-304、DeLLphi-305和DeLLphi-306)。其他针对肺癌开发的T细胞衔接器包括靶向CEA的RO6958688、靶向SSTR2的tidutamab、靶向PSMA的CC-1和靶向PSCA的GEM3PSCA等。靶向肽-MHC复合物的免疫动员单克隆T细胞受体(ImmTAC)技术则代表了新一代T细胞衔接器设计。与常规双特异性抗体不同,ImmTAC通过工程化TCR识别由MHC分子呈递的肿瘤抗原肽,可靶向细胞内抗原。brenetafusp是靶向PRAME的ImmTAC,目前正在进行用于治疗PRAME阳性晚期实体瘤的1/2期研究和黑色素瘤的3期试验。此外,最新研究策略聚焦于靶向由突变癌基因产生的新抗原,将进一步提升T细胞衔接器的肿瘤特异性与抗肿瘤活性。
2、调节T细胞活化水平:
具体方法包括:①调整结合亲和力;②优化分子结构;③开发条件性激活系统等。三特异性T细胞激活构建体(TriTAC)是该领域的代表性分子,其特点是包含CD3结合域、人血清白蛋白结合域和肿瘤抗原结合。HPN328(MK-6070)是一种靶向CD3/HSA/DLL3的TriTAC,正在SCLC和其他DLL3过表达肿瘤患者中进行1/2期临床试验。
3、靶向其他免疫效应细胞:
除T细胞外,靶向NK细胞和髓系细胞的衔接器也逐渐展现出临床潜力。AFM24是一种靶向CD16A和EGFR的双特异性NK细胞衔接器,其联合atezolizumab在经治EGFR野生型NSCLC患者中显示出26.7%的客观缓解率。免疫刺激抗体偶联物(ISAC)则是髓系细胞衔接器的代表,它将靶向抗体与免疫刺激剂(如TLR或STING激动剂)偶联,通过重编程肿瘤相关巨噬细胞发挥抗肿瘤作用。已在临床试验中的代表性ISACs包括TAC-001(抗CD22抗体与TLR9激动剂)和TAK-500(抗CCR2抗体与STING激动剂)等。
过继细胞疗法
肺癌领域的过继细胞疗法发展较为缓慢。目前,研究最多的有嵌合抗原受体(CAR)T细胞疗法、T细胞受体(TCR)T细胞疗法和肿瘤浸润淋巴细胞(TIL)疗法。
1、CAR-T细胞疗法
在肺癌治疗领域,研究者已开发出靶向EGFR、MUC1、间皮素、PSCA、CEA、HER2、GPC3、ROR1和PD-L1等多种CAR-T细胞产品。临床研究显示,EGFR CAR-T和间皮素CAR-T在EGFR阳性肿瘤患者以及恶性胸膜间皮瘤中显示出一定的临床活性。然而,ROR1 CAR-T和PD-L1 CAR-T由于治疗窗较窄和毒性问题,其临床开发已被终止。CAR-T疗法在肺癌治疗中也面临诸多挑战。首先,肺癌相关抗原多为肿瘤相关抗原而非肿瘤特异性抗原,在正常组织中也有表达,导致"on-target, off-tumor"毒性风险。其次,肿瘤异质性使得同一肿瘤内可能存在不同抗原表达亚群,增加了治疗难度。此外,TME的免疫抑制特性、物理屏障阻碍CAR-T细胞浸润、制备工艺复杂且成本高昂等因素都限制了CAR-T疗法的临床应用。为应对这些挑战,下一代CAR-T疗法正在发展中。
2、TCR-T细胞疗法
与CAR-T细胞相比,TCR-T细胞具有可靶向细胞内抗原、抗原识别灵敏度更高、信号传导更接近生理水平等优势。靶向黑色素瘤相关抗原4(MAGE-A4)的TCR-T疗法ADP-A2M4是首个获得FDA批准用于治疗不可切除或转移性滑膜肉瘤的TCR-T产品。其改良版ADP-A2M4CD8在HLA-A02阳性实体瘤(包括NSCLC)患者中显示出35.6%的客观缓解率。其他在研的TCR-T疗法还包括靶向KRAS G12V和TP53 R175H等驱动基因突变的产品。TCR-T疗法的主要限制包括HLA限制性、靶抗原局限性和安全性风险。为解决这些问题,研究者开发了多种创新方法,如TCR融合构建体通过改造信号传导域实现HLA非依赖识别;基于患者肿瘤突变谱设计新抗原特异性TCR-T细胞的个性化治疗方案;以及使用CRISPR/Cas9基因编辑技术精确调控TCR表达等。
3、TIL治疗
TIL疗法利用从肿瘤组织分离的天然肿瘤反应性T细胞,经体外扩增后回输患者体内。lifileucel在NSCLC中的2期临床研究显示,单药治疗PD-1耐药患者的客观缓解率为21.4%,与pembrolizumab联合治疗初治患者的客观缓解率达64.3%。然而,TIL疗法面临制备工艺复杂、最佳细胞亚群不确定和支持性治疗毒性等挑战。新一代TIL技术通过表达膜结合IL-15(如OBX-115)、基因修饰(如PD-1敲除的IOV-4001)以及优化快速扩增工艺等方法,显著提升了治疗效果和安全性。
治疗性癌症疫苗
根据靶向抗原的特性,肺癌治疗性疫苗可分为三类:靶向共享抗原的疫苗、个性化抗原疫苗和匿名抗原疫苗。
1、靶向共享抗原的疫苗
早期开发的疫苗多采用TAA如MUC1、MAGE-A3和NY-ESO-1等作为靶点。由于这些抗原在肺癌发生发展中的生物学功能不明确,其在3期随机对照试验中均未能显著改善患者生存。相比之下,靶向功能明确的抗原疫苗展现出更好的临床前景。CIMAvax-EGF作为靶向EGF的肽疫苗,在3期试验中作为NSCLC一线化疗后的维持治疗,显著延长了患者总生存期。PD-(L)1-Vaxx则通过模拟PD-1的B细胞表位诱导多克隆抗PD-1抗体产生,在PD-(L)1抑制剂耐药的NSCLC患者中观察到客观缓解。
近年来,共享抗原疫苗的研发策略主要聚焦于两个方向:多靶点疫苗设计和新型树突状细胞激活策略。OSE2101作为靶向CEA、p53、HER-2、MAGE-A2和MAGE-A3五种抗原的多价疫苗,在3期研究中显著改善了经治HLA-A2阳性NSCLC患者的总生存。目前正在开展OSE2101联合多西他赛治疗免疫耐药NSCLC的3期研究。基于mRNA技术的多靶点疫苗如BI1361849(编码6种NSCLC相关抗原)、mRNA-4359(靶向PD-L1和IDO1)和BNT116(靶向6种TAA)也显示出良好的安全性和初步疗效。值得注意的是,新一代疫苗更倾向于靶向TSA而非TAA,如靶向KRAS G12D/G12R突变的ELI-002 2P疫苗和靶向EGFR突变的ABOR2013 mRNA疫苗,这些疫苗在早期临床试验中已展现出令人鼓舞的抗肿瘤活性。
2、个性化抗原疫苗
个性化抗原疫苗代表了精准医疗在肿瘤疫苗领域的实践。这类疫苗基于患者个体肿瘤突变谱,通过生物信息学预测免疫原性新抗原进行定制化设计。V940(mRNA-4157)可编码多达34种个体化新抗原,在1期研究中成功诱导了新抗原特异性T细胞应答,目前正在开展治疗NSCLC的3期临床试验。然而,这类疫苗面临诸多挑战:新抗原预测算法的准确性受限于肿瘤异质性和微环境复杂性;疫苗制备周期长(通常需要4-8周);监管审批流程复杂等。这些因素都限制了其临床转化效率。
3、匿名抗原疫苗
匿名抗原疫苗采用同种异体肿瘤细胞或基因修饰的树突状细胞作为抗原来源,理论上能够涵盖更全面的肿瘤抗原谱。Belagenpumatucel-L、Tergenpumatucel-L、Viagenpumatucel-L等同种异体肿瘤细胞的疫苗在早期研究中显示出一定疗效,但在3期试验中未能证实生存获益。树突状细胞疫苗如Ad-CCL21-DC和DCVAC/LuCa通过不同机制增强抗肿瘤免疫,在1/2期研究中显示出延长无进展生存时间的效果。此外,Fms样酪氨酸激酶3配体(Flt3L)等树突状细胞激动剂联合局部放疗,在部分NSCLC患者中诱发了远隔效应,为联合治疗策略提供了新思路。
本综述主要梳理了肺癌免疫治疗领域的最新进展,概括上述新型治疗策略的作用机制和临床转化前景。通过对现有研究成果的整合分析,首次基于分子机制和临床应用提供新型免疫治疗发展的全面视角,将有助于推动肺癌精准免疫治疗的研发及临床转化。
中山大学肿瘤防治中心赵珅副主任医师、赵洪云教授为该文章的共同第一作者,中山大学肿瘤防治中心张力教授为该文章的通讯作者。











 苏公网安备32059002004080号
苏公网安备32059002004080号


