病史摘要:患者,女性,59岁,患者为胃混合型神经内分泌肿瘤伴多发转移(部分胃中分化腺癌,Lauren分型肠型;部分为神经内分泌癌,形态学倾向小细胞癌),一线治疗给予免疫联合化疗(信迪利单抗+奥沙利铂+替吉奥)治疗,2周期疗效评价稳定,后转入我科,继续原方案治疗,4周期后疗效评价稳定(SD),6周期后进展(肝部病灶增大/增多)。行肝穿病理示转移性神经内分泌癌(小细胞型),调整治疗方案(依托泊苷+卡铂)治疗2周期后,病情再次PD(肝转移病灶增多、增大),调整治疗方案为“紫杉醇(白蛋白结合型)+阿帕替尼”,2周期后疗效评价稳定,4周期后,病情再次进展;后行介入联合HAIC灌注化疗(FOLFIRI方案),病情再次进展(PD)。
症状体征:入院时神志清,精神可,生命体征平稳,诉腹胀,进行性加重,伴纳差、恶心、巩膜及皮肤黄染,KPS 90分。
诊断方法:CT,MRI,胃镜,CT引导下肝穿刺。
治疗方法:初诊由于活检标本,未能明确腺癌和神经内分泌癌成分占比,综合评估患者当前病情,经过MDT,兼顾两种肿瘤,选择免疫联合化疗方案,同时密切观察不良反应,及时影像学检查,必要时再次穿刺,明确诊断,多次MDT,及时调整治疗方案,提高患者的生活质量和总生存期。
临床转归:患者黄疸好转,于当地医院姑息治疗,随访已故。
适合阅读人群:肿瘤科,胃肠外科,消化内科
关键词:胃癌;神经内分泌癌;腺癌;血小板减少;海曲泊帕
引言
胃混合性腺-神经内分泌癌(gastric mixed adenoneuroendocrine carcinoma, G-MANEC)是一种以腺癌和神经内分泌癌成分混合为病理学特征、罕见的消化道恶性肿瘤,腺癌和神经内分泌癌两种成分所占比例均> 30%,其恶性程度高,容易远处转移,预后极差[1] 。2010年WHO病理分类诊断建议,神经内分泌癌可与任何比例的非神经内分泌癌成分混合,诊断时需注明混合癌的类型、占比和分化程度,手术后病理还需注明淋巴结转移情况(混合性肿瘤需标明哪种成分转移),由于G-MANEC的罕见性及异质性,目前尚未形成规范化的辅助治疗方案[1-2]。Lin J等[3]进行的一项研究比较胃神经内分泌癌、胃混合性腺神经内分泌癌和胃腺癌的预后和复发模式,结果显示胃神经内分泌癌或胃混合性腺神经内分泌癌患者的预后较胃腺癌患者差,且更容易远处复发。G-MANEC中神经内分泌癌成分的肿瘤分级和腺癌类型与预后密切相关[4]。并且,肿瘤治疗所致血小板减少症(Chemotherapy-Induced Thrombocytopenia,CTIT)是临床高发的血液学相关不良事件,系统性治疗药物多伴有3~4级CTIT发生风险,联合应用时CTIT发生风险及严重程度加剧。CTIT的发生可对癌症患者造成一系列不良影响,如化疗延误、剂量减少限制治疗效果,甚至终止治疗,引发出血甚至死亡等严重后果。
因而,如何制定不同的治疗策略,以提高G-MANEC患者的长期生存率,成为临床亟待解决的问题。我们团队结合1例G-MANEC患者的全程治疗,由于是活检病理,未能明确腺癌和神经内分泌癌成分占比,经过多次MDT会诊,共同探讨G-MANEC的综合治疗策略。
临床资料
一般资料
59岁女性,1年余前因“腹胀”于我院消化内科行胃镜病理活检示:(胃体活检)癌,部分为中分化腺癌,Lauren分型肠型;部分为神经内分泌癌,形态学倾向小细胞癌。于2022.10.19给予“信迪利单抗+奥沙利铂+替吉奥”方案治疗2周期,疗效评价SD。转入我科后,继续原方案治疗至6周期,期间出现III度血小板减少,给予对症治疗后改善,后给予海曲泊帕乙醇胺片二级预防。6周期后疗效评价为SD,进一步治疗后疗效PD(肝转移病灶增多、增大)。于2023.4.5行肝穿刺活检病理示:(肝穿刺活检)小蓝圆细胞恶性肿瘤,结合形态学、免疫组化及同一患者既往病理,可符合转移性神经内分泌癌(小细胞型)。于2023.4.7、2023.5.4 给予“依托泊苷+卡铂”方案化疗2周期,1周期后出现发热性中性粒细胞减少,后给予长效升白(PEG-rhG-CSF)二级预防治疗。2周期后疗效PD(肝转移病灶增多、增大)。再次沟通病情,拒绝再次肝穿刺活检,再次建议行NGS基因检测,指导后续治疗,均拒绝。建议行介入联合HAIC灌注化疗,拒绝,后于2023.6.2、2023.6.25给予“紫杉醇(白蛋白结合型)+阿帕替尼”方案治疗,1周期后出现IV度骨髓抑制及口腔黏膜溃疡,对症治疗后好转。沟通后第2周期白蛋白紫杉醇分d1、d8应用,后分别于2023.7.17、2023.8.15行“白蛋白紫杉醇+阿帕替尼”治疗2周期。2周期后疗效评价稳定,4周期后复查评估病情进展(肝转移病灶增多、增大),MDT会诊后,再次与患者及家属沟通病情和治疗的风险获益。于2023.9.4行介入和HAIC灌注化疗(FOLFIRI方案),2周前无明显诱因出现腹胀,呈进行性加重,伴纳差、恶心、巩膜及皮肤黄染。
检查
入院后CT检查
肝内多发转移灶,考虑转移,较前增大
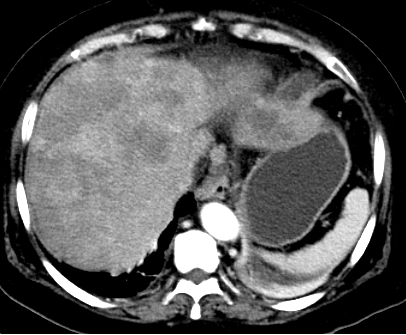
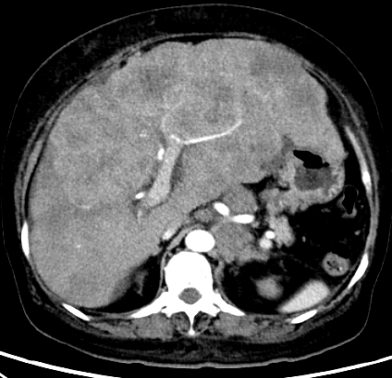
图1. CT检查结果 入院后血生化
肝功示:谷丙转氨酶 39U/L,谷草转氨酶 466↑U/L ,谷氨酰转肽酶 442↑U/L ,总胆红素 167.50 ↑μmol/L ,直接胆红素 148.20 ↑μmol/L ,间接胆红素 19.3 ↑μmol/L。
诊断
综合症状,体征、实验室检查及影像学检查,诊断为:1. 胃恶性肿瘤(部分为腺癌,部分为小细胞癌)肝、多部位淋巴结转移,IV期,HER2(0),pMMR;2. 黄疸待查。
治疗
首诊于消化内科,行“免疫联合化疗”治疗2周期,疗效评价SD,转入我科后,行MDT第1次会诊,CT和MRI等影像检查提示胃周淋巴结、肝多发转移。胃肠外科评估暂无手术指征。进一步完善检查,免疫组化示:HER2(0),PD-1(肿瘤+约40%),PD-L1检测(CPS 30),MLH1(+),MSH2(+),MSH6(+),PMS2(+)。结合既往胃腺癌家族史,与患者及家属沟通病情、治疗可能获益和风险后,继续原方案治疗,4周期后疗效评价SD,继续治疗6周期后疗效评价PR。第2次MDT后,行肝新发病灶穿刺,病理示转移性神经内分泌癌(小细胞型),调整治疗方案(依托泊苷+卡铂)治疗2周期后,病情再次PD(肝转移病灶增多、增大)。第3次MDT,再次沟通病情,拒绝再次肝穿刺活检,建议行介入联合HAIC灌注化疗,拒绝,再次建议行NGS基因检测,指导后续治疗,拒绝。后给予“紫杉醇(白蛋白结合型)+阿帕替尼”方案治疗。2周期后疗效评价稳定,4周期后复查评估病情进展。MDT第3次会诊,再次与患者及家属沟通病情和治疗的风险获益。于2023.9.4行介入和HAIC灌注化疗(FOLFIRI方案)。患者本次入院,体质较差,黄疸,暂积极对症治疗。
治疗结果、随访及转归
经积极对症治疗,症状改善,后于当地医院治疗,已故。
讨论
深入研究G-MANEC的病理发生和转移机制,对于其制订针对性的治疗策略具有重要意义。Nie L等[4]进一步研究发现MANECs中神经内分泌癌成分的肿瘤分级和腺癌类型与预后密切相关,胃癌MANECs合并低分化腺癌的生存率明显低于胃癌MANECs合并分化相对较好的腺癌或粘液腺癌的生存率(P = 0.0008),神经内分泌癌占比大,临床预后较差。MANEC的基因组特性和进化克隆起源尚不清楚,Gao R等[5]分析36例胃混合性腺神经内分泌癌(G-MANEC)的临床病理特点,发现其主要发生在食管胃交界和胃窦,多数患者分期较高,且多有淋巴结转移,预后较差。Qiu MZ等[6]对33例患者的101个样本进行了全外显子组和多区域测序分析,发现四个显著突变的基因:TP53, RB1, APC和CTNNB1。神经内分泌癌成分比腺癌显示出更具侵略性的基因组特性。该病例初诊由于是活检标本,未能明确腺癌和神经内分泌癌成分占比,遗憾的未作NGS基因检测,不能更好的研究其较差的预后的潜在基因突变状态。
如何对G-MANEC患者制定个体化治疗策略非常重要,尤其是同时性肝多发转移,目前还没有高级别证据推荐治疗模式,但大多数肿瘤中心的报道认为积极的手术切除依然是最有效的治疗手段。Yamaguchi E等[7]报道一例TTF-1阳性表达的无远处转移的G-MANEC患者手术后获得较好疗效。Lin JP等[8]研究评估辅助化疗是否与可切除胃神经内分泌癌(G-NECs)或混合性腺神经内分泌癌(G-MANECs)患者的生存率相关,依托泊苷加顺铂或伊立替康加顺铂与G-MANEC患者更好的OS无关。国内外指南推荐依托泊苷联合铂类作为晚期胃肠胰腺NEC的一线治疗,但该例患者行“依托泊苷+卡铂”化疗2周期后PD,获益有限。因而,对于G-MANEC的一线治疗,需要结合具体的神经内分泌癌和非神经内分泌癌的病理类型,综合评估,制订个体化的治疗方案。
对于G-MANEC的治疗,结合已经报道的病例和笔者的临床经验,1. 首选外科治疗:可参考实体瘤同时性转移外科治疗,能手术者尽可能外科手术治疗,遵循肿瘤外科治疗的两大基本原则,即最大限度地切除肿瘤组织,同时最大限度地保留正常组织。2. 不能手术者,结合患者具体的病理类型,MDT会诊,综合评估选择治疗方案。内科治疗方案选择原则:1)最好能同时兼具两种恶性肿瘤成分,选择均有效的治疗方案;2)选择针对恶性程度相对较高的肿瘤成分有效的治疗方案。患者总体耐受可,取得较好的临床疗效。多学科团队(MDT)在临床治疗中的指导价值是多方面的,尤其是在处理复杂和罕见的病例,MDT模式将在临床治疗中发挥越来越重要的作用,尤其是在提高治疗质量、促进创新和改善患者预后方面。随着医疗技术的不断进步和医疗模式的变革,MDT将成为现代医疗体系中不可或缺的一部分。
利益冲突声明:所有作者均声明本研究不存在利益冲突。
[1]. Ahmed M. Gastrointestinal neuroendocrine tumors in 2020[J]. World J Gastrointest Oncol. 2020,12(8):791-807
[2]. Yoshimachi S, Ohtsuka H, Aoki T, et al. Mixed adenoneuroendocrine carcinoma of the ampulla of Vater: a case report and literature review[J]. Clin J Gastroenterol,2020,13(1):37-45.
[3]. Lin J, Zhao Y, Zhou Y, et al. Comparison of Survival and Patterns of Recurrence in Gastric Neuroendocrine Carcinoma, Mixed Adenoneuroendocrine Carcinoma, and Adenocarcinoma[J]. JAMA Netw Open,2021,4(7):e2114180.
[4]. Nie L, Li M, He X, Feng A, et al. Gastric mixed adenoneuroendocrine carcinoma: correlation of histologic characteristics with prognosis[J]. Ann Diagn Pathol,2016 ,5:48-53.
[5]. Gao R, Chen XY, Jin L. Gastric mixed adenoneuroendocrine carcinoma: a clinicopathological analysis of 36 cases[J]. Zhong Hua Bing Li Xue Za Zhi,2019,48(10):767-771.
[6]. Qiu MZ, Chen Q, Zheng DY, et al. Precise microdissection of gastric mixed adeno-neuroendocrine carcinoma dissects its genomic landscape and evolutionary clonal origins[J]. Cell Rep,2023, 42(6): 112576.
[7]. Yamaguchi E, Sato Y, Oe T, et al. Gastric mixed adenoneuroendocrine carcinoma with thyroid transcription factor-1-positive neuroendocrine component[J]. Clin J Gastroenterol, 2015,8(2):82-7.
[8]. Lin JP, Zhao YJ, He QL, et al. Adjuvant chemotherapy for patients with gastric neuroendocrine carcinomas or mixed adenoneuroendocrine carcinomas[J]. Br J Surg,2020,107(9):1163-1170.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


