病史摘要:患者,女性,65岁,4年前因左乳肿块行左乳癌保乳术+术中放疗,术后病理提示激素受体阳性,Her-2阴性,术后辅助内分泌治疗2年后出现骨转移、肝转移,肝转移灶穿刺活检考虑乳腺来源,激素受体转阴,后续反复多次化疗导致频发血小板减少症。
症状体征:入院时神志清,精神良好,诉右侧肩部及肝区疼痛不适。
诊断方法:PET-MRI、CT、SPECT。
治疗方法:结合患者病情、年龄、体力状态评分及经济状况,在多学科会诊后,予以肝转移灶动脉介入栓塞和介入化疗治疗,在局部治疗基础上联合全身化疗。在出现2次化疗所致血小板减少症(CIT)后予以海曲泊帕二级预防用药,后续化疗疗程能正常进行。
临床转归:目前患者病情稳定,无疾病进展,未见明显化疗相关不良反应。
适合阅读人群:肿瘤科,放射肿瘤科,血液科
关键词:化疗所致血小板减少症(CIT);二级预防;海曲泊帕
引言
肿瘤化疗所致血小板减少症(chemotherapy induced thrombocytopenia,CIT),是指抗肿瘤化疗药物对骨髓产生的抑制作用,尤其是对巨核系细胞产生抑制作用,导致外周血中血小板计数低于正常值的一种常见的肿瘤治疗并发症,是临床常见的血液系统毒性反应[1]。肿瘤治疗所致血小板减少症,会导致患者的治疗延迟、药物剂量降低,甚至终止治疗,同时3-4级血小板减少症可能会增加出血风险进而危及生命,并影响治疗效果、增加医疗费用[2]。目前血小板减少症不仅出现于化疗后,越来越多的靶向或免疫治疗相关的血小板减少症在临床上被观察到,且血小板减少症有持续时间长、难以恢复的特点,影响肿瘤患者治疗的强度和时间。目前国内被国家药品监督管理局(NMPA)批准用于治疗CIT的药物只有重组人血小板生成素(rhTPO)和白介素11(rhIL-11),两种药物均为皮下注射,给药方式限制了部分患者的使用。海曲泊帕目前已被NMPA批准用于原发免疫性血小板减少症及重型再生障碍性贫血患者的治疗,既往临床研究数据证实了此类药物在CIT中的治疗潜力,但是目前尚未获批CIT方面的适应症。我们在海曲泊帕二级预防化疗所致血小板减少症方面做了探索工作,期望能够对类似病例诊治提供参考。
临床资料
一般资料
患者为65岁女性,4年前因左乳癌行左侧乳腺保乳术+即刻乳房修复术+肿物探查术+近距离放疗施源器植入术+术中放疗,放疗剂量20Gy/25min,术后规律口服阿那曲唑内分泌治疗。2年前出现右侧肩部疼痛,复查CEA较前增高,遂至当地医院查骨扫描示右侧肩峰区骨转移灶,右侧肩峰区骨质代谢异常活跃,给予放射治疗(30Gy/15F)合并唑来膦酸抗骨转移治疗。2022年10月改用派柏西利+氟维司群治疗。1年前(2023.3月)查CT示肝脏多发占位,行肝占位穿刺活检,病理首先考虑乳腺癌肝脏转移可能性大,免疫组化:Ki67(+约90%),ER(-),PR(+,热点区约3%),Her2(+)。于2023.3.20给予“紫杉醇脂质体240mg d1、顺铂30mg d2-4”方案化疗1周期。
检查
2023年4月因肝脏病灶较前进展至我院,入院后完善CT及PET-MRI检查,下图为治疗前后增强CT和PET-MRI检查结果:均提示在接受全身及肝脏局部介入治疗后肿瘤较前缩小,病情得到有效控制。
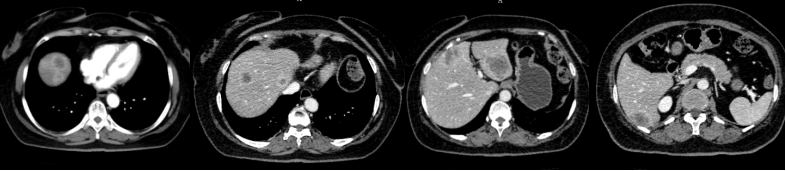
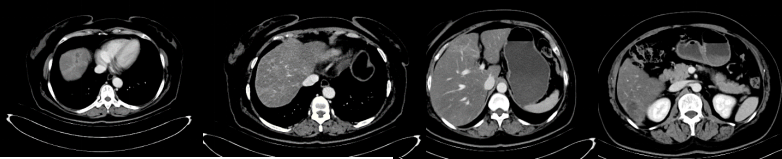
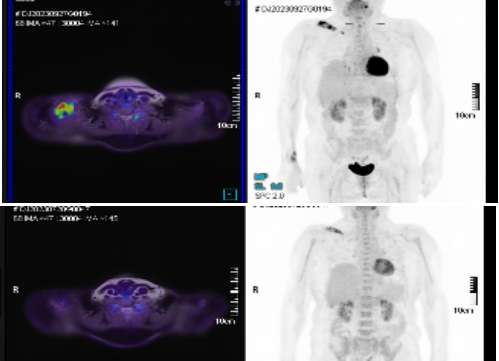
诊断
对肝穿刺组织病理切片进行病理会诊,重新检测激素受体及Her2表达情况,最终结果提示ER(-)PR(-)Her-2(1+)KI67(70%),结合病史、检查及病理结果考虑目前诊断为三阴性乳腺癌(IV期)。
治疗
予以“载药微球(载THP60mg)肝动脉栓塞”及“艾立布林2mg d1.d8+贝伐珠单抗500mg d1”方案治疗,治疗前基线血常规结果示:中性粒细胞绝对值(ANC)4.78×109/L(参考范围3.5-9.5×109/L)、血红蛋白(Hb)116g/L(参考范围125-350 g /L)、血小板(PLT)208×109/L(参考范围125-350×109/L);2次化疗后复查血常规示:ANC 2.73×109/L、Hb 120g/L、PLT 79×109/L。鉴于血小板计数在75×109/L以上,继续予以原方案化疗,化疗后1周复测PLT 51×109/L;予以海曲泊帕2.5mg qd po治疗,治疗后10天检测PLT恢复至148×109/L,继续原方案治疗1周期后,监测血常规示PLT下降至71×109/L,再次予以海曲泊帕2.5mg qd po 治疗,此次动态监测PLT计数变化,发现PLT上升速度减缓,在海曲泊帕治疗后3周PLT恢复至97×109/L,导致化疗时间延迟。该患者在接受“艾立布林+贝伐珠单抗”方案治疗8周期后再次出现疾病进展(PD),后续更换治疗方案为德曲妥珠单抗(DS8201),3周期后病情评估为PD,更换为“长春瑞滨30mg d1, d8+贝伐珠单抗500mg d1”治疗方案。
治疗结果、随访及转归
鉴于患者前次化疗中反复多次出现血小板减少,此次予以海曲泊帕二级预防,具体方案为:自化疗前3天开始海曲泊帕2.5mg qd po,持续口服给药至化疗结束后1周,动态监测血小板计数变化,PLT维持在82-127×109/L之间,未再出现因血小板减少导致化疗延迟的情况。目前患者病情控制良好。
讨论
肿瘤治疗所致血小板减少症(Cancer therapy induced thrombocytopenia, CTIT)是指在应用某种可能引起血小板减少的化疗或靶向、免疫、放疗等抗肿瘤治疗手段后出现外周血血小板计数<100×10⁹/L,且停药后血小板减少所致症状与体征逐渐减轻或血小板计数恢复正常,重新使用同种抗肿瘤药物后血小板减少症再次出现的现象[1]。
血小板的正常寿命为8~10天,一般在化疗后第5天开始下降,第14天达到低谷,在第28~35天恢复到基线水平[3]。晚期肿瘤治疗日趋于去化疗化,但是越来越多的研究结果证明,不只化疗药物会导致血小板减少症的出现,靶向及免疫药物治疗同样会诱发血小板减少。化疗药物引起血小板减少的主要原因是化疗药物对巨核系细胞的抑制作用所导致的血小板生成不足和/或免疫及非免疫因素导致的血小板过度损坏[3]。许多化疗药物和联合化疗方案均可导致不同程度的血小板减少[4],通常在化疗后3~4天开始出现。靶向治疗药物导致血小板减少的原因研究的相对较少,目前观察到的有贝伐珠单抗导致的免疫性血小板减少可能是由于免疫介导的血小板外周破坏[5, 6],PARP抑制剂导致的血小板减少与巨核细胞增殖和成熟的可逆性减少有关[7]。免疫药物导致的血小板减少症发生机制尚不清楚,可能与活化的T细胞还有免疫检查点的潜在移除有关[8]。而化疗与靶向或免疫治疗的联合应用,可能会增加血小板减少的发生风险。目前血小板减少症治疗的指南日趋规范,在CSCO的CTIT诊疗指南中明确规范了其治疗原则,按照血小板计数及有无合并出血,给予了明确推荐级别的治疗指导[1]。目前推荐的治疗方式有输注血小板和促血小板生长因子,TPO受体激动剂(TPO-RA)属于促血小板生长因子的一种,其中海曲泊帕已被CSCO指南纳入CTIT治疗和二级预防的II级推荐[9]。但是目前国内被批准用药CIT治疗的药物只有rhTPO(重组人血小板生成素)和rhIL-11(白介素11),rhIL-11在首次或多次给药后会出现过敏或超敏反应[10],有增加中老年患者房颤发生率可能[11]。
鉴于rhIL-11的心脏、肾脏毒性,以及rhTPO疗效和给药方式的限制,血小板减少症治疗的临床需求并未被完全满足。有研究显示TPO -RA对于CIT也有治疗作用[12, 13]。TPO-RA能够激活TPO受体依赖的下游信号通路,刺激巨核细胞增殖分化,促进血小板生成[14]。目前国内上市的TPO-RA除海曲泊帕外还有艾曲泊帕和阿伐曲泊帕,虽然该类药物尚未获批 CIT 的适应证,但结合CIT患者的出血风险及预期的下降时间等具体情况,TPO-RA是一种可考虑的选择[2]。
海曲泊帕,是我国自主研发的新一代口服小分子非肽类TPO-RA,化学结构与同类产品不同,且不具有肽类TPO-RA(如罗普司亭)的免疫原性[15]。海曲泊帕可通过与血小板生成素受体(TPO-R)的跨膜区相结合,激活TPO-R依赖的STAT、PI3K和ERK信号转导通路,刺激巨核细胞增殖和分化,促进血小板生成[16]。是目前唯一一个单药或联合rhTPO获CSCO指南CTIT治疗和预防II级推荐的TPO-RA药物。在海曲泊帕治疗CIT的随机、双盲、对照、多中心Ⅱ期临床研究中[17],海曲泊帕的治疗起始剂量为7.5mg qd连续给药,PL T恢复至≥100×109/L的中位时间为7.5天;二级预防的剂量为7.5mg qd连续给药,保证下一周期化疗能够顺利完成的有效率高达72%。该临床研究取得了阳性结果,对海曲泊帕在恶性肿瘤CIT管理中的应用提供了循证依据,Ⅲ期临床研究正在进行中。但是鉴于该药物的价格和医保覆盖问题,尚不能满足临床需求。结合我们中心具体患者经济及身体状况,在2例患者中试验性采用了小剂量海曲泊帕口服方案,自计划的化疗前3天开始口服,2.5mg qd,持续到化疗后第7天,2例患者均顺利完成了后续4周期化疗,疗效较佳。纵观本病例治疗历程,采用海曲泊帕乙醇胺片的及时、有效的升板治疗和二级预防对于抗肿瘤治疗的足剂量、足疗程、按时、顺利进行发挥了重要作用。对应于CTIT的危害,海曲泊帕防治所产生的积极的医学和社会价值也是多维度、“连锁性”的。海曲泊帕应用可以降低医疗成本,减少住院治疗的需求,从而减轻医疗经济负担;其也是一种更为有效的自我管理方式,有助于改善患者的治疗效果及生活质量。这些影响是相互关联的,一个方面的变化可能会引发连锁反应,影响其他方面。其不仅使患者未因CTIT显著影响生存和生活质量,也未发生出血等严重并发症而带来沉重的医疗和经济负担。这一创新治疗策略的应用,展示了新药改变临床实践的力量。希望随着新版指南的推广和落地,海曲泊帕为更多CTIT患者带来更多的益处。
综上,海曲泊帕对化疗所致血小板减少有治疗及预防双重作用,降低了化疗相关血小板减少的发生率,减少了化疗药物延迟或剂量减少带来的疾病进展风险,部分患者减量使用后仍有较好的临床效果,后续期待有证据级别更高的临床研究进一步证实。
利益冲突声明:所有作者均声明本研究不存在利益冲突。
[1]. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤治疗所致血小板减少症诊疗指南-2023[M]. 人民卫生出版社, 2023.
[2]. 徐瑞华, 石远凯, 冯继锋, 等. 中国肿瘤化疗相关性血小板减少症专家诊疗共识(2019版)[J]. 中国医学前沿杂志(电子版), 2020,12(01):51-58.
[3]. Vadhan-Raj S. Management of chemotherapy-induced thrombocytopenia: current status of thrombopoietic agents[J]. Semin Hematol, 2009,46(1 Suppl 2): S26-S32.
[4]. Elting L S, Rubenstein E B, Martin C G, et al. Incidence, cost, and outcomes of bleeding and chemotherapy dose modification among solid tumor patients with chemotherapy-induced thrombocytopenia[J]. J Clin Oncol, 2001,19(4):1137-1146.
[5]. Li T, Witteman D T, Weber E D, et al. Severe immune-mediated thrombocytopenia after intravitreal bevacizumab injection[J]. Retin Cases Brief Rep, 2020,14(3):251-254.
[6]. Davis E J, Salem J E, Young A, et al. Hematologic Complications of Immune Checkpoint Inhibitors[J]. Oncologist, 2019,24(5):584-588.
[7]. LaFargue C J, Dal Molin G Z, Sood A K, et al. Exploring and comparing adverse events between PARP inhibitors[J]. Lancet Oncol, 2019,20(1): e15-e28.
[8]. Davis E J, Salem J E, Young A, et al. Hematologic Complications of Immune Checkpoint Inhibitors[J]. Oncologist, 2019,24(5):584-588.
[9]. 中国临床肿瘤学会(CSCO)抗肿瘤药物治疗安全管理专家委员会.海曲泊帕临床应用指导原则.白血病·淋巴瘤,2022,31(10):577-582. [J]. 马军. 重组人白细胞介素11在血液病实体瘤血小板减少症合理应用的专家共识[J]. 中华肿瘤杂志, 2010(12):3.
[10]. Xu J, Ren J F, Mugelli A, et al. Age-dependent atrial remodeling induced by recombinant human interleukin-11: implications for atrial flutter/fibrillation[J]. J Cardiovasc Pharmacol, 2002,39(3):435-440.
[11]. Kellum A, Jagiello-Gruszfeld A, Bondarenko I N, et al. A randomized, double-blind, placebo-controlled, dose ranging study to assess the efficacy and safety of eltrombopag in patients receiving carboplatin/paclitaxel for advanced solid tumors[J]. Curr Med Res Opin, 2010,26(10):2339-2346.
[12]. Winer E S, Safran H, Karaszewska B, et al. Eltrombopag for thrombocytopenia in patients with advanced solid tumors receiving gemcitabine-based chemotherapy: a randomized, placebo-controlled phase 2 study[J]. Int J Hematol, 2017,106(6):765-776.
[13]. Peng G, He G, Chang H, et al. A multicenter phase II study on the efficacy and safety of hetrombopag in patients with severe aplastic anemia refractory to immunosuppressive therapy[J]. Ther Adv Hematol, 2022,13:1554002957.
[14]. Zheng L, Liang M Z, Zeng X L, et al. Safety, Pharmacokinetics and Pharmacodynamics of Hetrombopag Olamine, a Novel TPO-R Agonist, in Healthy Individuals[J]. Basic Clin Pharmacol Toxicol, 2017,121(5):414-422.
[15]. Zaja F, Carpenedo M, Barate C, et al. Tapering and discontinuation of thrombopoietin receptor agonists in immune thrombocytopenia: Real-world recommendations[J]. Blood Rev, 2020,41:100647.
[16]. Wang Z, Chen L, Zhang F, et al. First-in-patient study of hetrombopag in patients with chronic idiopathic thrombocytopenic purpura[J]. J Thromb Haemost, 2020,18(11):3053-3060.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


