病史摘要:患者,女性,42岁,因“胃癌术后2年”入院治疗。
症状体征:入院时神志清,精神一般,下腹部可见陈旧性手术瘢痕,生命体征平稳,KPS 80分。
诊断方法:影像学检查及胃镜检查后诊断明确:1.胃腺癌多发转移(大网膜、输尿管、肺、多发淋巴结)IV期(TxN3bM1);2.卵巢转移性腺癌术后分子病理:HER-2(3+) MSS。
治疗方法:根据NCCN指南及CSCO指南关于晚期胃癌诊疗推荐,建议行免疫联合抗HER-2治疗再加化疗的联合治疗模式,经治疗后肿瘤明确缩小,2022-02争取到了手术机会,进行全胃切除伴食管-空肠吻合术,术后病理yp T1a N0 M0,后行替吉奥辅助治疗。同时动态监测血生化和影像学检查,更加关注血小板减少等相关不良反应的全程管理,兼顾疗效和安全性,最终为患者争取了手术机会及长期无瘤生存。
临床转归:目前患者处于术后辅助治疗后无瘤状态,影像学评估未见肿瘤复发。
适合阅读人群:肿瘤科,胃肠外科,消化科
关键词:晚期胃癌;转化治疗;血小板减少;海曲泊帕
引言
胃癌是最常见的消化道恶性肿瘤之一,也是全球范围内死亡率最高的恶性肿瘤之一。根据2021年新发表的中国恶性肿瘤学科发展报告,2020年世界胃癌发病率居恶性肿瘤发病率第五位,死亡率第四位,有超过100万新发病例和大约77万死亡病例,而中国胃癌患者占全球的43.9%[1]。根治性手术目前依然是胃癌患者的唯一治愈手段,然而胃癌患者大部分确诊时已经失去了手术治疗的机会,晚期胃癌患者的预后较差,中位OS不足2年。
人表皮生长因子受体2 (HER2)是表皮生长因子受体酪氨酸激酶家族的一员。当它被激活时,HER-2蛋白发生同型二聚或异型二聚,并启动复杂的细胞信号通路,导致细胞增殖,肿瘤发生和肿瘤转移[2,3]。胃癌患者中HER-2阳性(HER-2 3+和HER-2 2+,FISH扩增)的比例为10%-20%[4,5]。有研究表明HER-2扩增是胃癌患者预后不良的一个重要预测因子[6-9],同时HER-2扩增也与化疗耐药性密切相关[10,11]。
在晚期胃腺癌治疗中,ToGA研究已经证实[12],在以卡培他滨-顺铂/氟尿嘧啶-顺铂化疗基础上,联合曲妥珠单抗可以显著提升患者总生存(13.8 个月 vs. 11.1个月,HR=0.74; 95%CI 0.60-0.91; P=0.0046),曲妥珠单抗已被批准用于晚期HER2 阳性胃腺癌患者的一线治疗。在2021年的ASCO会议中Keynote-811[13,14]研究公布了第一次中期分析的结果,免疫联合抗HER-2治疗组中ORR高达74.4%,疾病控制率(disease control rate, DCR)为96.2%。帕博利珠单抗联合曲妥珠单抗和化疗的方案也凭借优异的ORR数据获得FDA的加速批准,成为HER-2阳性胃癌一线治疗的新疗法。
临床资料
一般资料
42岁年轻女性,2021-08因“腹部疼痛1月余,盆腔占位术后1月”来院。1个多月前无诱因出现间断下腹部疼痛,在当地医院检查发现盆腔占位,于2021.07.09日因盆腔占位于当地医院行“剖腹探查术+全子宫切除+双侧附件切除术”,术后病理示:左侧卵巢腺癌,转移性腺癌。后来我院,2021-08-05胃镜示:胃体管壁僵硬,大弯侧可见巨大溃疡形成,上覆污秽,周边粘膜皱襞粗大呈结节状隆起,质脆易出。病理诊断:(胃体活检)腺癌,中-低化。PD-L1(5%+),Her-2(3+),MLH1(+),PMS2(+),MSH2(+),MSH6(+)。2021-08-09CT示:胃体胃壁增厚,考虑胃癌;肝胃间、腹膜后多发淋巴结肿大,考虑转移;大网膜增厚,呈污秽样改变,考虑转移;盆腔及双侧髂血管走行区多发肿大淋巴结,考虑转移;左侧输尿管下段显示不清,左侧肾盂、输尿管全程扩张、积液,左侧输尿管下段受累;卵巢癌术后改变;双侧锁骨上窝、双侧肺门及纵膈内多发肿大淋巴结,双肺多发结节,考虑转移。
第一次MDT会诊,治疗目标是控制肿瘤行晚一线治疗。后于2021.08.20开始行“帕博利珠单抗+奥沙利铂+替吉奥+曲妥珠单抗”治疗,同时辅以对症治疗。2021.08.27院外复查血常规示:血小板46×109/L。2021.08.29返院,给与“海曲泊帕”对症处理,持续应用6天。2021.09.04复查血小板118×109/L,2021.09.14开始继续行“帕博利珠单抗+奥沙利铂+替吉奥+曲妥珠单抗”治疗,化疗减量10%,同时辅以营养支持及海曲泊帕二级预防。2周期后疗效评价为PR。后于2021.10.04继续原方案C3-C6治疗,6周期后复查疗效评价为持续PR。
第二次MDT会诊,患者年轻女性,经全身治疗后病灶控制较好,目前肿瘤局限,评估后建议可按原方案减量维持治疗,也可行局部手术治疗根据术后病理再评估术后治疗并与患者及家属充分沟通。患者及家属强烈要求手术根治,排除禁忌后于2022.02.02行腹腔镜下“全胃切除伴食管-空肠吻合术”,术程顺利。术后病理分期I期(yp T1a N0 M0)。经第三次MDT后,于2022.03.19开始规律行“替吉奥”方案辅助治疗,后于2023.03结束辅助治疗,定期复查,目前未见肿瘤复发,患者无瘤生存随访中。
检查
1. 影像学检查
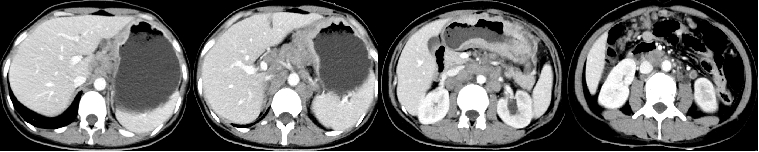
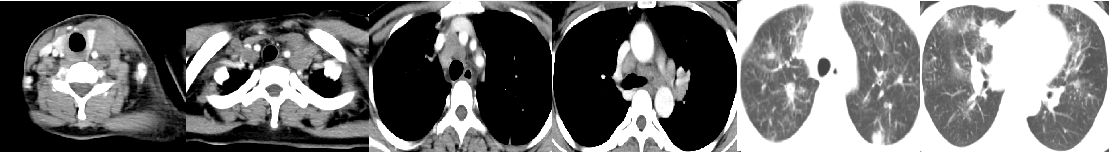
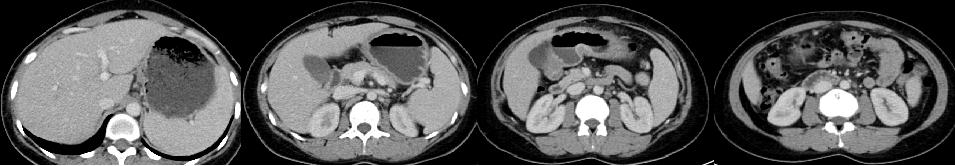
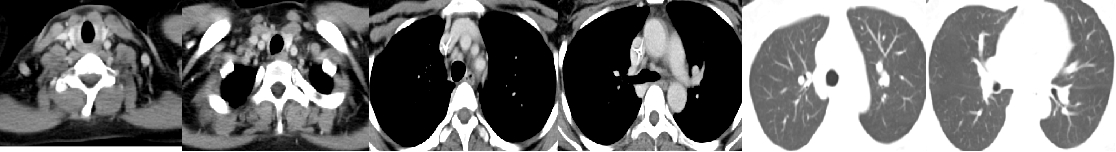
诊断与鉴别诊断
根据术后病理可诊断明确,无需鉴别。
治疗
患者初治来院时肿瘤负荷较重,经第一次MDT后明确为初始不可切晚期胃癌伴多发淋巴结及肺转移,Her-2扩增型。结合NCCN及CSCO指南Her-2阳性胃癌晚一线全身治疗方案中免疫联合抗HER-2靶向治疗再联合双药化疗的四药联合方案为目前的标准方案及优先推荐。考虑患者为年轻女性,治疗意愿强烈,遂行四药联合治疗。1周期后出现III度骨髓抑制,血小板减少,给与海曲泊帕对症处理后迅速恢复。后于2021.09-2022-01行5个周期“帕博利珠单抗+奥沙利铂+替吉奥+曲妥珠单抗”方案治疗,期间给与海曲泊帕二级预防,过程顺利。疗效评价为PR。晚期胃癌异质性较高,生物学行为差,预后较差,但该患者经过6周期四药联合治疗后肿瘤病灶局限在胃周,遂行第二次MDT,经影像科及外科充分沟通后,有机会行胃癌根治术。后于患者充分沟通后行胃癌根治术,实现了患者的无瘤生存愿望,为患者争取了长生存可能。
治疗结果、随访及转归
目前患者生活质量好,无瘤状态生存随访中。
讨论
胃癌是我国最常见的消化系统恶性肿瘤之一,很多患者初治时就已经是晚期,失去了手术治疗的机会。HER-2是胃癌预后不良的一个重要分子病理标志。随着免疫治疗,靶向治疗等综合治疗的进展,个体化治疗是现代医学发展的一个重要方向,它有望改变传统的“一刀切”治疗模式,为患者提供更精确、更有效的医疗服务。胃癌的联合治疗及多学科MDT也已经成为了临床诊疗的常见手段,为很多患者切实制定了更加个体化的方案,取得了较好的临床诊疗效果。
目前已有研究发现,针对 HER2 靶点的治疗效应包括免疫系统的调节,而 HER2的靶向治疗可以增加肿瘤的 PD-L1 表达。因此,对于 HER2 阳性的恶性肿瘤患者,将曲妥珠单抗和免疫检查点抑制剂联合可能带来更大的临床获益。2 项早期研究 NCT02954536,NCT02901301 均提示,曲妥珠单抗联合帕博利珠单抗及化疗用于晚期食管腺癌和胃癌患者,具有良好的耐受性和较高的客观缓解率。NCT0295453[15]研究为针对 HER2 阳性人群免疫联合靶向及化疗的 II 期研究。纳入 37 例既往未经治疗的 HER2 阳性胃癌患者,均接受帕博利珠单抗(P)/曲妥珠单抗(T)/XELOX 治疗,其中 22 例患者在化疗前还接受了 1 周期的 P+T 诱导化疗。在 32 例可评估患者中,全部患者均出现了肿瘤消退(-20%~-100%),ORR为 87%,52%患者在 P+T 诱导后靶病灶缩小。NCT02901301[16](PANTHERA 研究)为一项多机构Ⅰb/Ⅱ期临床试验。该研究探索了帕博利珠单抗+曲妥珠单抗+化疗治疗 HER2 阳性晚期胃癌患者的安全性和疗效。截至 2020 年 8 月 31 日,共 43 例患者接受治疗,中位随访 18.2 个月,3 例患者继续治疗,6 例患者完成2 年治疗时无进展。结果显示,ORR 达 76.7%,其中 7 例为完全缓解(CR, 16.3%),26 例为部分缓解(PR, 60.5%)。中位 OS 为 19.3 个月(95% CI 16.5-NA),中位PFS 为 8.6 个月(95% CI 7.2-16.4),中位 DOR 为 10.8 个月(95% CI 7.17-NA)。对于HER-2阳性晚期胃癌的一线治疗,在2021年的ASCO会议中Keynote-811(13,14)研究公布了第一次中期分析的结果,使得免疫联合抗HER-2再联合化疗的综合治疗方案成为了HER-2阳性胃癌一线治疗的新模式。本文中提到,患者行“帕博利珠单抗+奥沙利铂+替吉奥+曲妥珠单抗”治疗后院外复查血常规示低于正常值,随后给与“海曲泊帕”对症处理后恢复治疗,同时辅以营养支持及海曲泊帕二级预防。2周期后疗效评价为PR。由此也可以看出,海曲泊帕的支持治疗在提高血小板计数、改善患者生活质量、减少输血需求以及协同其他治疗方法方面发挥着重要作用,为CTIT患者的持续治疗提供了新疗防治策略。
综上所述,免疫联合靶向再联合化疗的模式已经广泛应用于临床,带来了很多可喜的结果。目前该患者通过联合治疗成功使得初始不可切的胃癌转化成功,为患者争取了宝贵的长期无瘤生存机会。
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1]Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209–249.
[2]Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001;2:127–37.
[3]Oh DY, Bang YJ. HER2-targeted therapies – a role beyond breast cancer.Nat Rev Clin Oncol 2020;17:33–48.
[4]Ruschoff J, Hanna W, Bilous M, Hofmann M, Osamura RY, Penault-Llorca F, et al. HER2 testing in gastric cancer: a practical approach. Mod Pathol. 2012;25(5):637–50.
[5]Hofmann M, Stoss O, Shi D, Buttner R, van de Vijver M, Kim W, et al.Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008;52(7):797–805.
[6]Liu Z, Shi M, Li X, et al. HER2 copy number as predictor of disease-free survival in HER2-positive resectable gastric adenocarcinoma. J Cancer Res Clin Oncol 2021;147:1315–24.
[7]Gordon MA, Gundacker HM, Benedetti J, et al. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Ann Oncol 2013;24:1754–61.
[8]Sasako M, Sakuramoto S, Katai H, et al. Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol 2011;29:4387–93.
[9]Kim KC, Koh YW, Chang HM, et al. Evaluation of HER2 protein expression in gastric carcinomas: comparative analysis of 1,414 cases of whole-tissue sections and 595 cases of tissue microarrays. Ann Surg Oncol 2011;18:2833–40.
[10]Sun LF, Yang K, Wang YG, et al. The role of HER2 in self-renewal,invasion, and tumorigenicity of gastric cancer stem cells. Front Oncol 2020;10:1608.
[11]Knuefermann C, Lu Y, Liu B, et al. HER2/PI-3K/Akt activation leads to a Multi-drug resistance in human breast adenocarcinoma cells. Oncogene 2003;22:3205–12.
[12]Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label,randomised controlled trial.Lancet.2010 Aug 28;376(9742):687-97.
[13]PENG Z, LIU T, WEI J et al. Efficacy and Safety of a Novel Anti-HER2 Therapeutic Antibody RC48 in Patients with HER2-Overexpressing, Locally Advanced or Metastatic Gastric or Gastroesophageal Junction Cancer: A Single-Arm Phase II Study.[J]. Cancer Communications (London, England), 2021, 41(11): 1173–1182.
[14]JANJIGIAN Y Y, KAWAZOE A, YAÑEZ P et al. The KEYNOTE-811 Trial of Dual PD-1 and HER2 Blockade in HER2-Positive Gastric Cancer.[J]. Nature, 2021, 600(7890): 727–730.
[15]Yelena Yuriy Janjigian, Steven Brad Maron, et al. First-line pembrolizumab (P),trastuzumab (T), capecitabine (C) and oxaliplatin (O) in HER2-positive metastatic esophagogastric adenocarcinoma.Journal of Clinical Oncology. 2019 37:15_suppl, 4011-4011.
[16]Rha SY, Lee C-K, Kim HS, et al. A multi-institutional phase Ib/II trial of first-line triplet regimen ([embrolizumab, trastuzumab, chemotherapy) for HER2-positive advanced gastric and gastroesophageal junction cancer (PANTHERA trial): molecular profiling and clinical update. Presented at: 2021 Gastrointestinal Cancers Symposium; January15-17, 2021. Abstract 218.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


