在过去二十年中,非小细胞肺癌(NSCLC)的基础与临床研究取得了令人振奋的进展。但全球患者仍面临大量未满足的需求,其中耐药问题始终是不可避免的现实。同时,若要拓展治疗效果的广度与深度,还需理解并整合多领域的深入突破。
今天和大家分享一篇发表在 Signal Transduction and Targeted Therapy 杂志,影响因子40.8分的一篇精彩review: Advances in molecular pathology and therapy of non-small cell lung cancer。作者为来自武汉同济大学的Hu Sheng教授、Huang Qing教授等。
本文为(上篇)主要包括以下内容:
1. 全面呈现分子病理学各方面的进展,包括转移机制的阐释、治疗靶点的发现以及空间组学的解析。
2. 重点介绍了多种小分子药物和抗体药物,涵盖其在二线、一线、新辅助或辅助治疗中单独或联合应用的情况。
本综述不仅概述了重塑现有治疗手段的各种策略,还举例说明了开发新型靶向药物的临床转化路径,以期革新NSCLC的治疗格局。
NSCLC的全球流行病学特征
1. 发病率与死亡率
NSCLC占肺癌的85%,2022年全球新发病例约250万,死亡超180万,中国新发病例和死亡病例分别为482万和257万。
在高人类发展指数(HDI)国家,肺癌是最常见癌症之一。
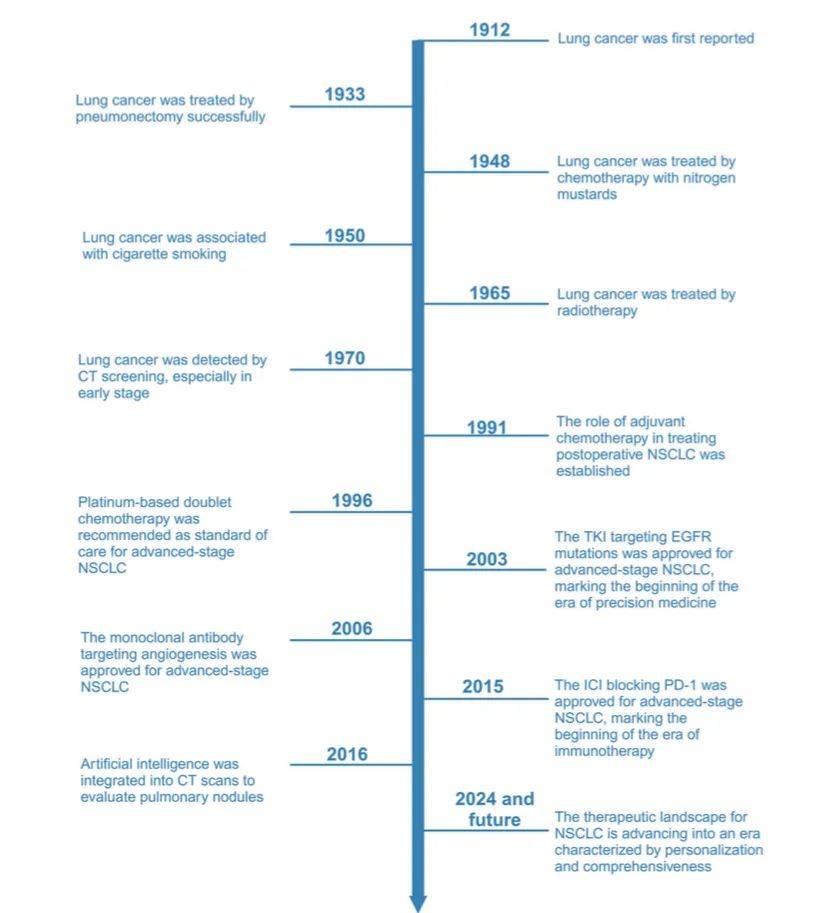
肺癌研究中的里程碑事件呈现了肺癌诊断与治疗领域的11项重大进展,重点展示过去20年中最迅速的发展成果,并对未来方向进行展望。
2. 风险因素
吸烟是主要风险因素,但约25%病例与吸烟无关,非吸烟人群中遗传易感性、空气污染、厨房油烟等影响显著。
亚洲女性EGFR突变率约为白人女性的4倍,KRAS突变在亚洲患者中较少(8%-10%),男性发病率和死亡率高于女性。
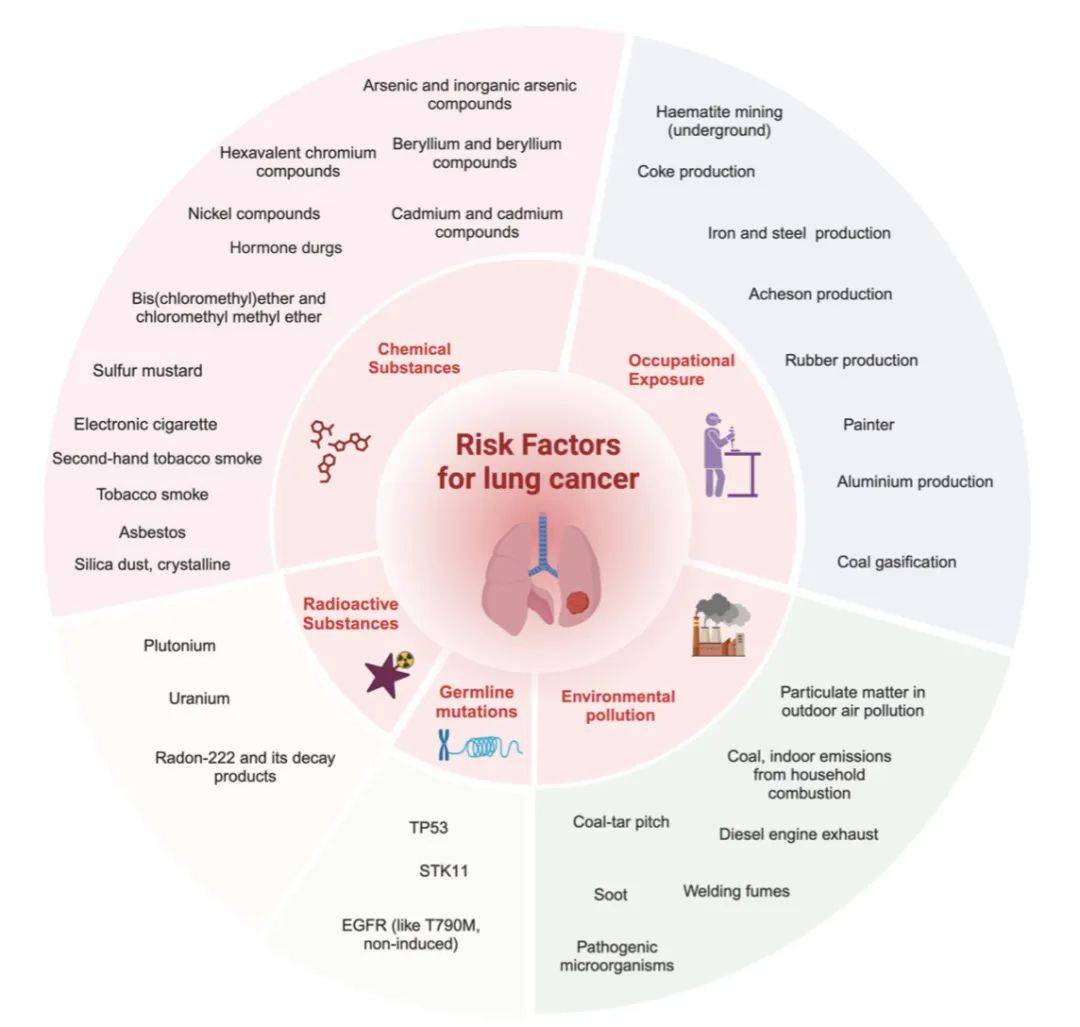
肺癌已知致癌因素(引用自 World Cancer Report, Cancer research for cancer prevention, 2020 ,
)。肺癌的致癌原因因地区、种族和性别而异。总体而言,这些因素共同促成肺癌发生,包括环境污染、不健康生活习惯和遗传易感性,尽管个体间影响程度不同。随着社会进步,这些致癌因素的性质也在演变:例如,感染与环境污染的关联日益密切,传统烟草使用已转向电子烟。
分子病理机制进展
1. 驱动突变
包括EGFR、KRAS、ALK、BRAF、ROS1等,不同突变对应不同临床特征。例如,EGFR突变常见于亚洲非吸烟女性,KRAS突变与吸烟相关。
2. 表观遗传调控
DNA甲基化(如RASSF1A、p16甲基化)、组蛋白修饰(如EZH2过表达)和非编码RNA(如miR-200家族、circRNAs)参与肿瘤发生与转移。
3. 肿瘤微环境(TME)与转移机制
癌细胞通过上皮-间质转化(EMT)、血管生成及与免疫细胞、成纤维细胞的相互作用促进转移,缺氧诱导因子(HIF-1α)起关键作用。
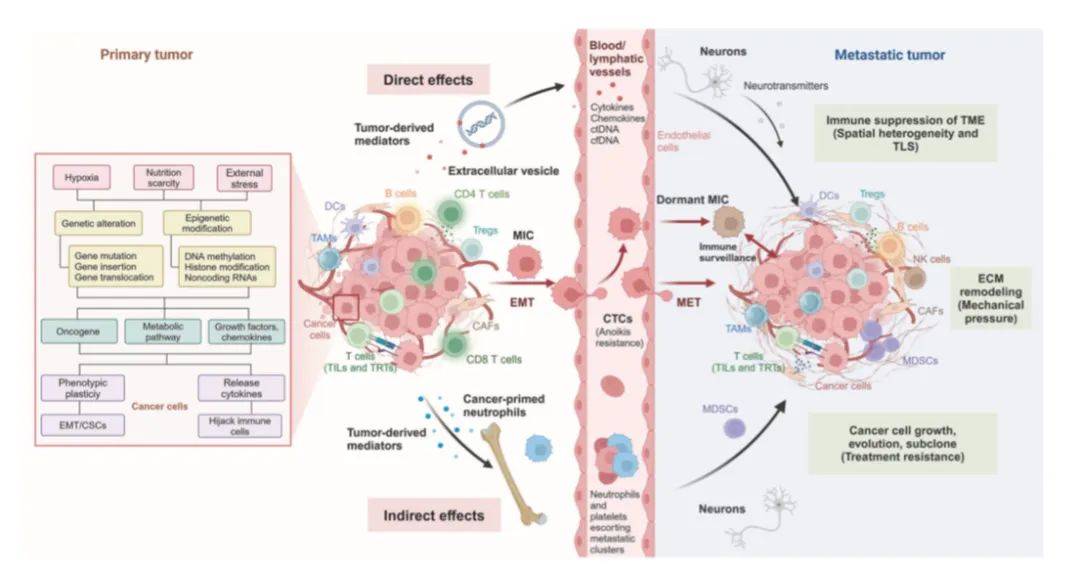
非小细胞肺癌(NSCLC)癌细胞转移相关机制一图总结了NSCLC癌细胞转移的相关机制。
从进化角度来看,转移是癌细胞对生存微环境压力的系统性适应性反应。该过程始于癌细胞特征的若干改变,至少包括癌基因激活(如EGFR、ALK和RAS等)、细胞因子(如IL-6、TGF、IGF和HIF-1等)及趋化因子与其受体(如CXCL9、CXCL10、CXCL11、CXCR3、CXCR4和CCR5等)的上调,以及代谢重编程(详见方框内容)。
随后发生涉及上皮-间质转化(EMT)的表型转变,主要由miRNA、ZEB1/2和EZH2驱动。接着,癌细胞通过各种可溶性分子和外泌体改变远处器官的微环境,为自身存活提供支持(直接作用);同时重新“教育”骨髓来源的免疫细胞,构建免疫抑制微环境(间接作用)。此外,循环中的癌细胞会与中性粒细胞和血小板结合以抵抗失巢凋亡,随后上调内皮细胞黏附分子,促进其侵入组织。
在远处器官的转移前微环境中,会发生MET恢复、细胞外基质(ECM)重塑(通过MMP2、9和10)、血管生成诱导(通过VEGF、VEGFR、TIE2和血管生成素1/2),以及癌相关成纤维细胞(CAFs)和神经元细胞(通过GABA)的募集,同时伴随免疫抑制细胞(髓系抑制细胞MDSCs、调节性T细胞Tregs、促肿瘤中性粒细胞TANs和肿瘤相关巨噬细胞TAMs)的聚集。这些细胞通过诱导T细胞耗竭(通过PD-(L)1、CTLA-4、LAG3和TIM3等)和代谢竞争(上调谷氨酰胺酶GLS1和GLS2,积累毒性癌细胞代谢物),帮助癌细胞逃避免疫监视(包括肿瘤浸润淋巴细胞TILs、组织驻留T细胞(αβ或γδ T细胞)、自然杀伤细胞NK、巨噬细胞和B细胞)。这种复杂的相互作用使癌细胞得以存活、亚克隆进化并产生治疗耐药性。若缺乏这些机制,肿瘤可能在远处器官临床显现前潜伏超过10年。
需注意的是,上述通路和分子未涵盖转移过程的全部环节,也未完全解释转移的器官特异性,或揭示其如何导致治疗耐药性。
诊断与生物标志物
1. 基因检测:
二代测序(NGS)可检测驱动突变(如EGFR、ALK)和肿瘤突变负荷(TMB),指导靶向治疗。
循环肿瘤DNA(ctDNA)用于监测微小残留病灶(MRD)和复发风险,如术后ctDNA阳性患者复发时间提前5.2个月。
2. 免疫治疗标志物:
PD-L1表达(TPS≥50%)提示单药免疫治疗获益,TPS≥1%可考虑联合化疗。
TMB高(≥10 mut/Mb)与免疫治疗响应相关,但需结合其他指标(如肿瘤浸润淋巴细胞TILs)。
3. 影像与病理:
低剂量CT筛查可降低高危人群肺癌死亡率,病理评估需结合组织学分型(如腺癌、鳞癌)和分子特征。
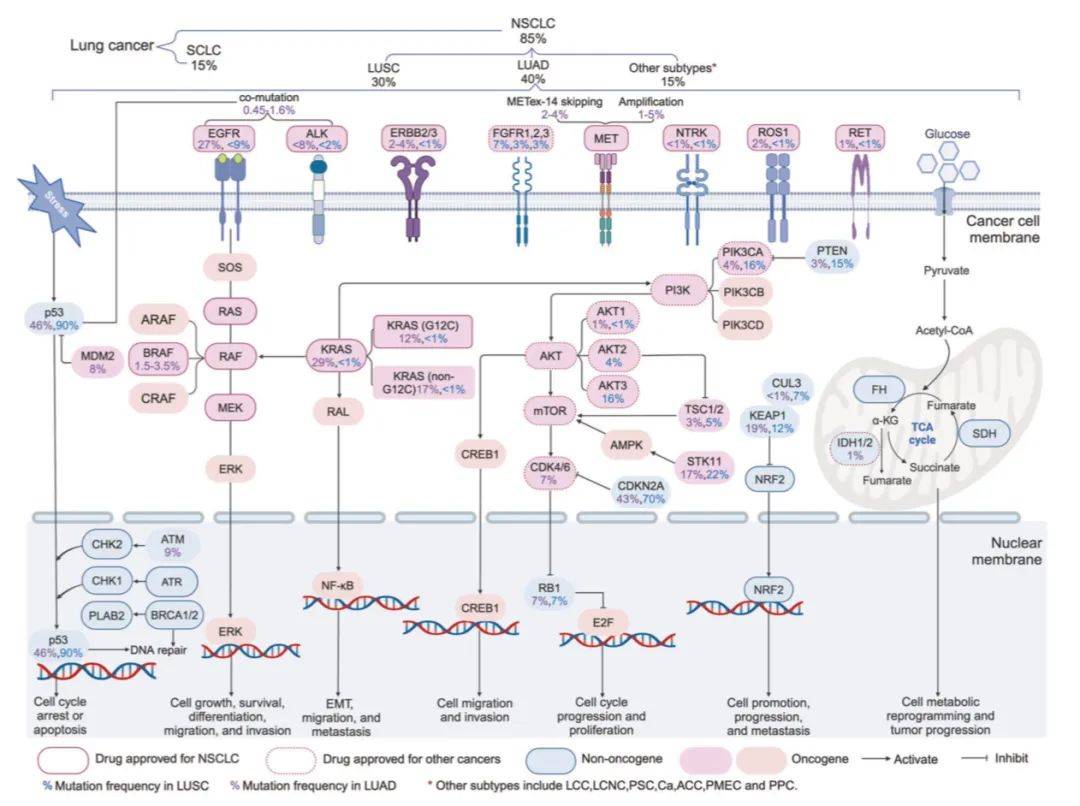
非小细胞肺癌(NSCLC)中涉及诸多药物靶点或生物标志物的致癌与抑癌通路改变。在NSCLC中,已发现众多激活或上调的细胞内致癌及非致癌蛋白激酶信号通路。对于已成为或即将成为可成药的靶点,要强调其突变频率。尽管不同文献或数据库报道的突变频率可能存在差异,但总体差异并不显著。本示意图可能未完全涵盖这些信号通路在体内的多样性、功能复杂性及其相互作用。此外,由于篇幅限制,细胞外或微环境特征(如癌细胞对VEGF/VEGFR信号的依赖性、葡萄糖以外的其他代谢通路及缺氧环境等)未予呈现。
治疗策略与临床进展
1. 可切除或局部晚期NSCLC
新辅助/辅助治疗 :免疫检查点抑制剂(ICIs)联合化疗显著提高病理完全缓解率。例如,CHECKMATE-816试验中,nivolumab联合化疗使无事件生存率达67%;EGFR突变患者术后使用osimertinib可延长无病生存期。
手术与放疗 :微创手术(VATS、机器人手术)减少并发症,术后放疗仅推荐用于高复发风险患者。
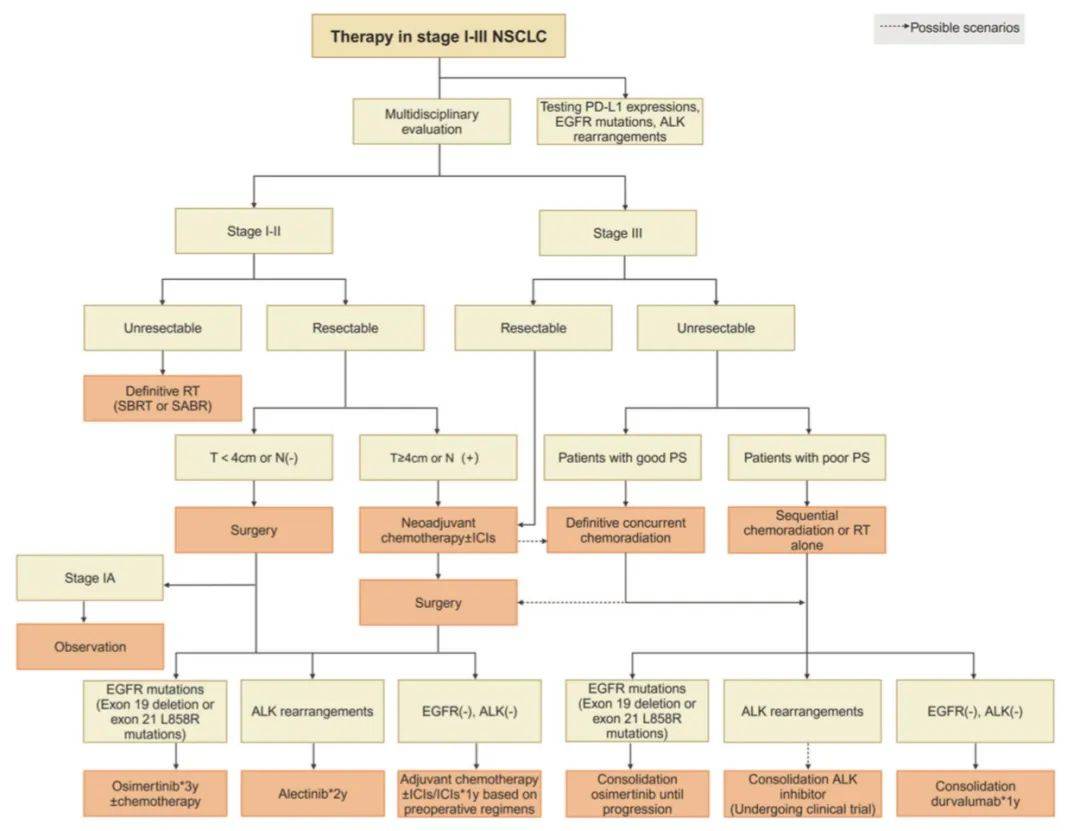
I-III期非小细胞肺癌(NSCLC)循证治疗一览,该流程图全面阐述了早期肺癌的治疗选择,通过虚线表示替代方案来保持灵活性。然而,此图示主要聚焦于多层次药物选择,未详细说明放疗和手术等更具技术性的治疗方案,而这些方案对某些患者可能更为关键。对于新辅助治疗方案,尤其是化疗联合免疫检查点抑制剂(ICIs)的方案,不同选择的推荐级别仍保持一致。
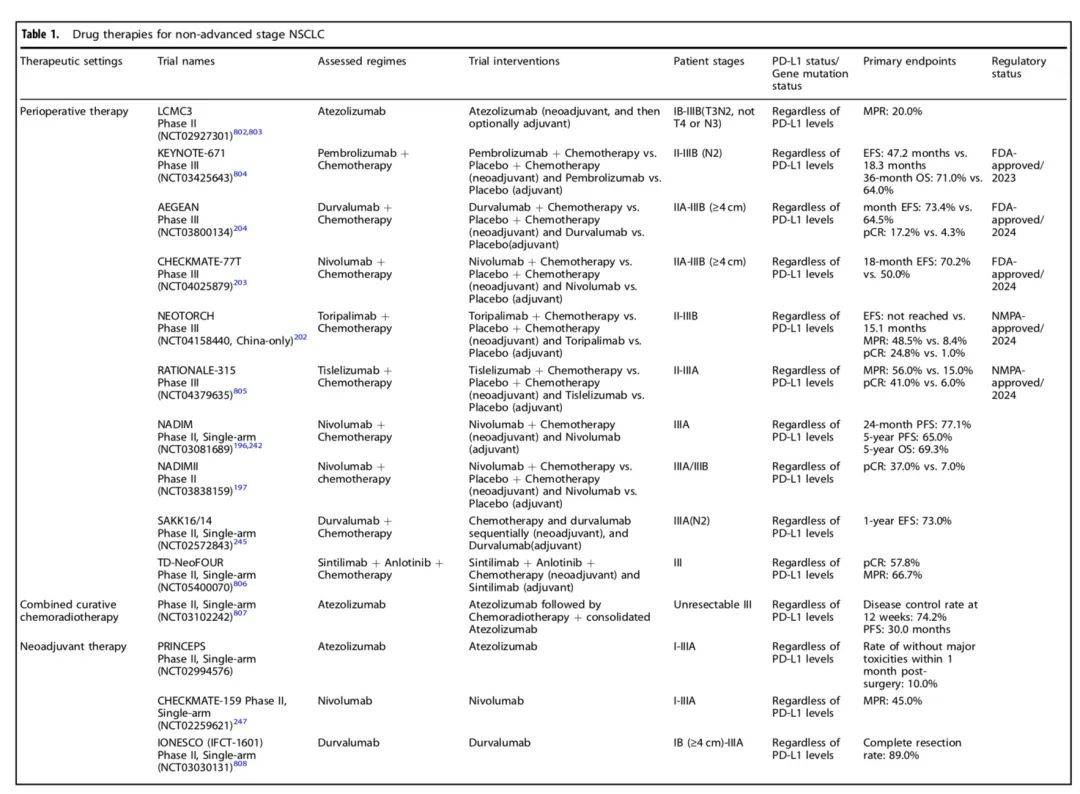
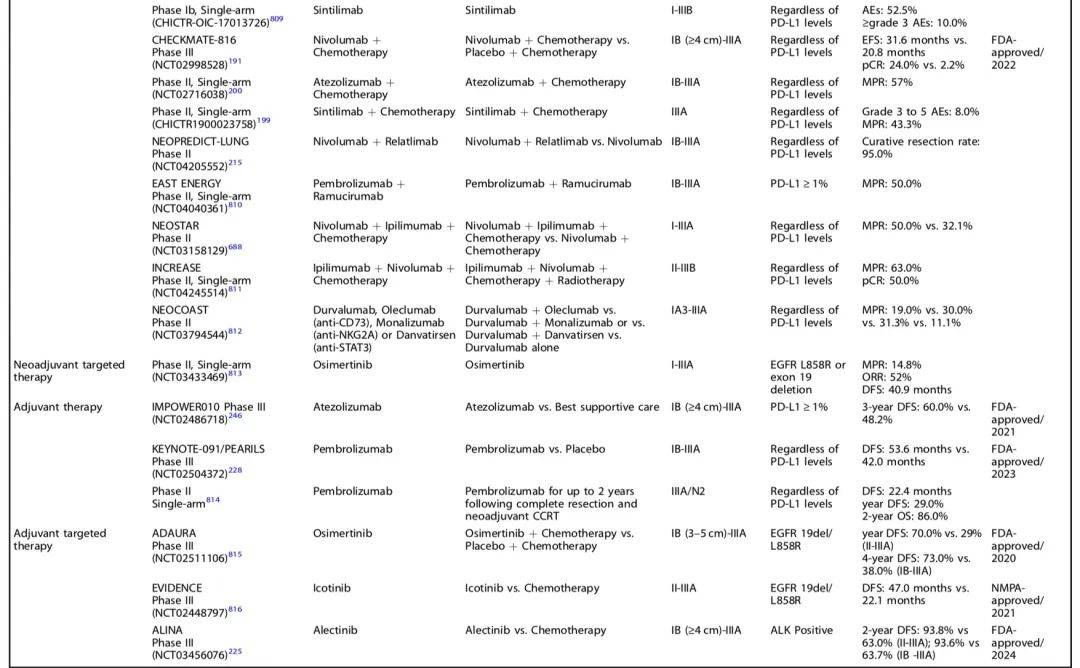
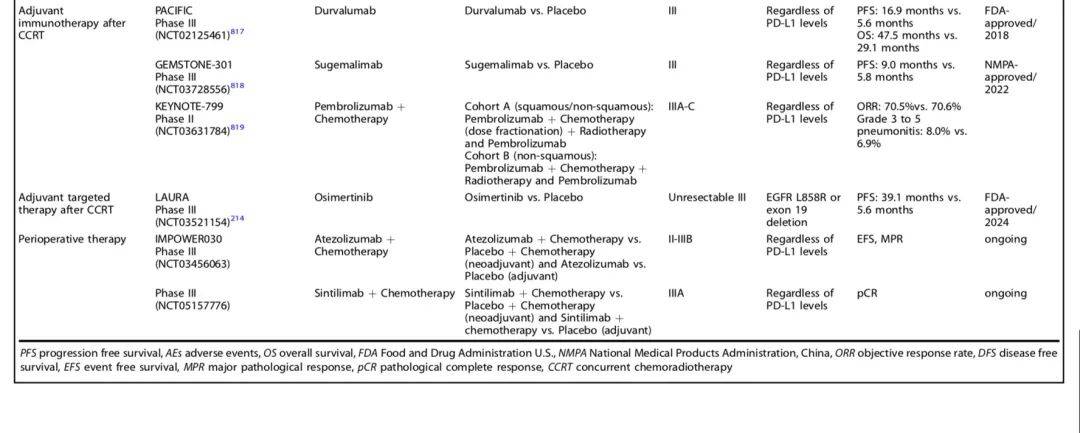
以下是非进展期NSCLC围手术期治疗研究及结果一览:
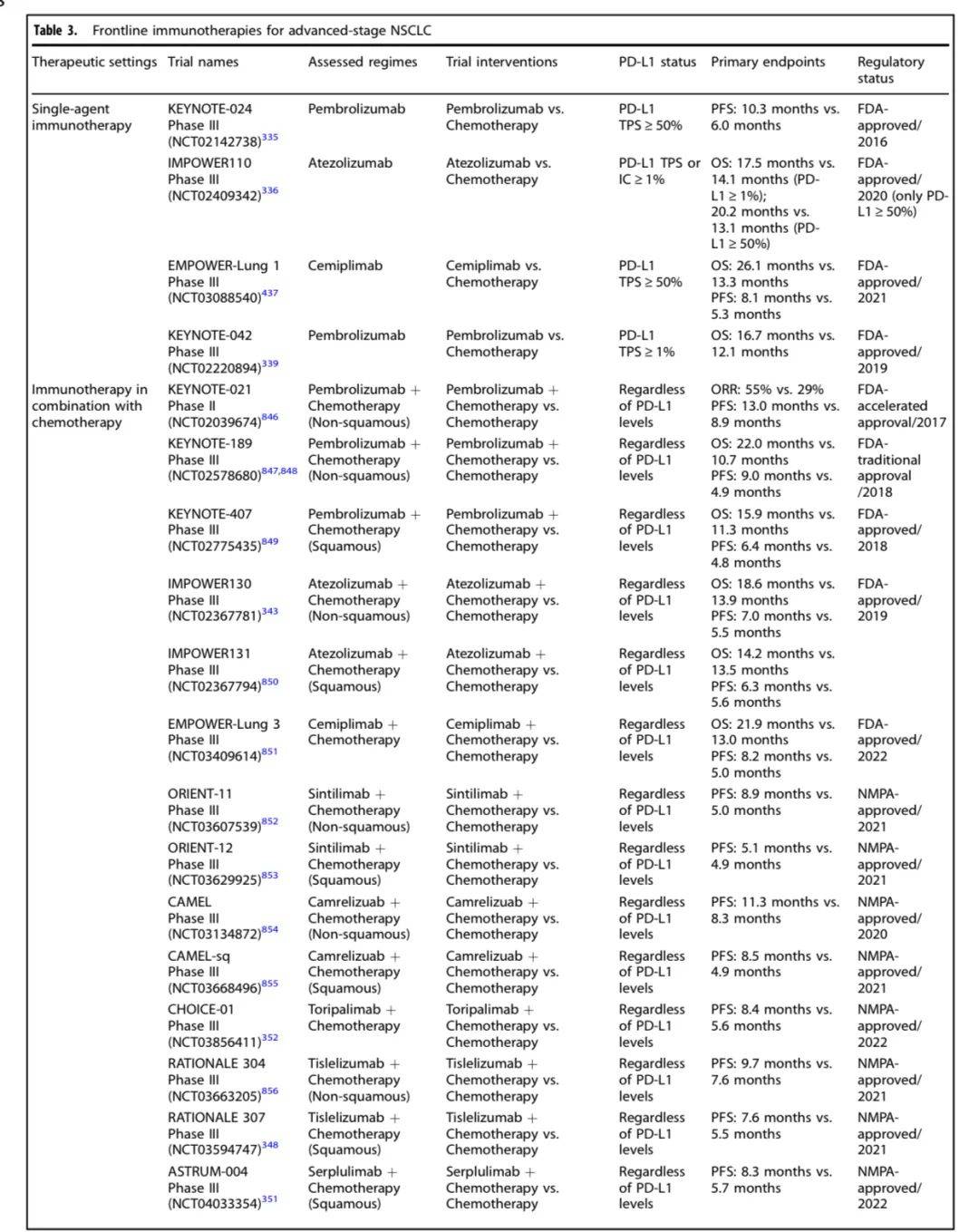
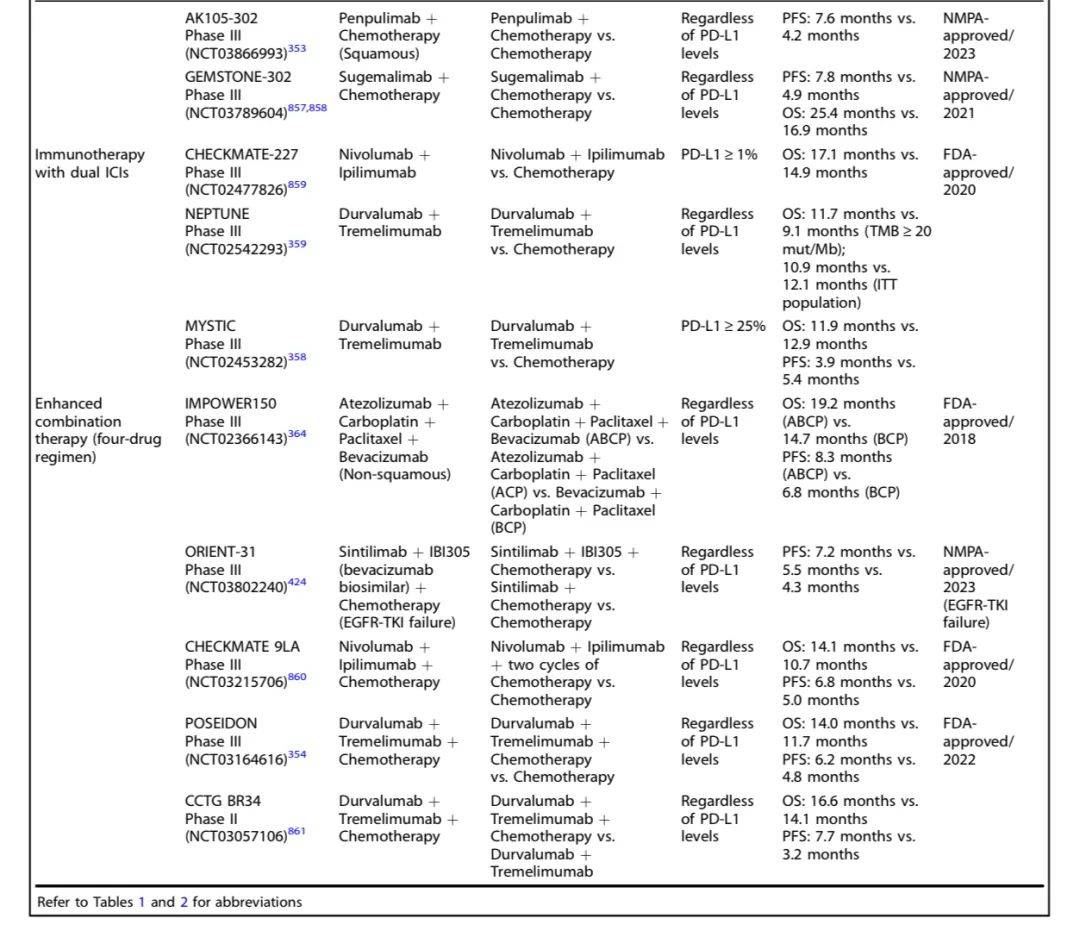
2. 晚期或转移性NSCLC
靶向治疗
:针对EGFR、ALK等突变的酪氨酸激酶抑制剂(TKIs)为一线治疗。例如,osimertinib一线治疗EGFR突变患者中位PFS达18.9个月;KRAS G12C抑制剂sotorasib、adagrasib用于二线治疗。
免疫治疗
:ICIs单药或联合化疗为驱动基因阴性患者的标准治疗。例如,pembrolizumab联合化疗延长中位OS;双免疫治疗(如nivolumab + ipilimumab)对高肿瘤突变负荷(TMB)患者有效。
抗体偶联药物(ADCs)
:如trastuzumab deruxtecan用于HER-2突变患者,datopotamab deruxtecan靶向TROP2。
以下是进展期NSCLC不同靶点药物研究及结果一览:
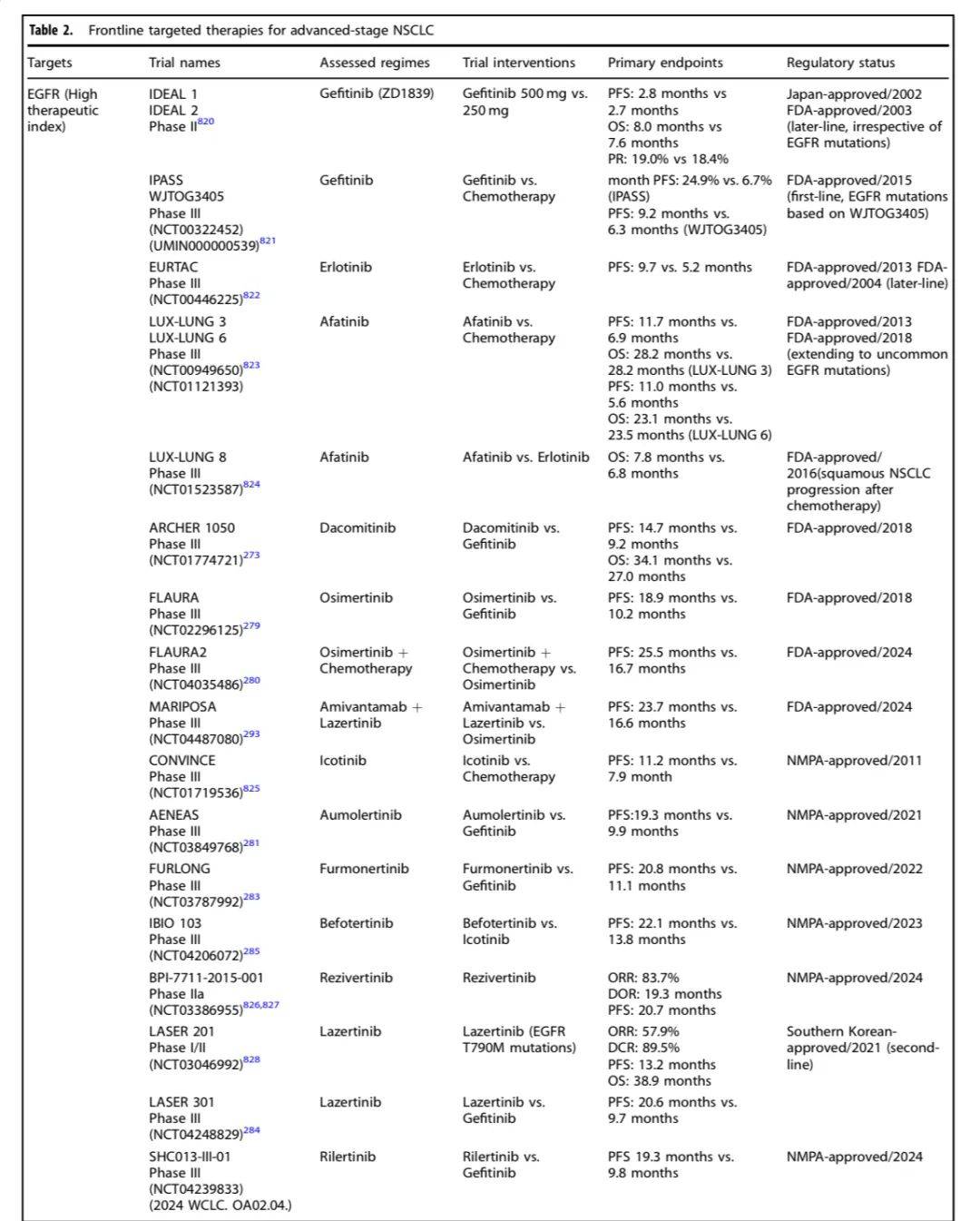
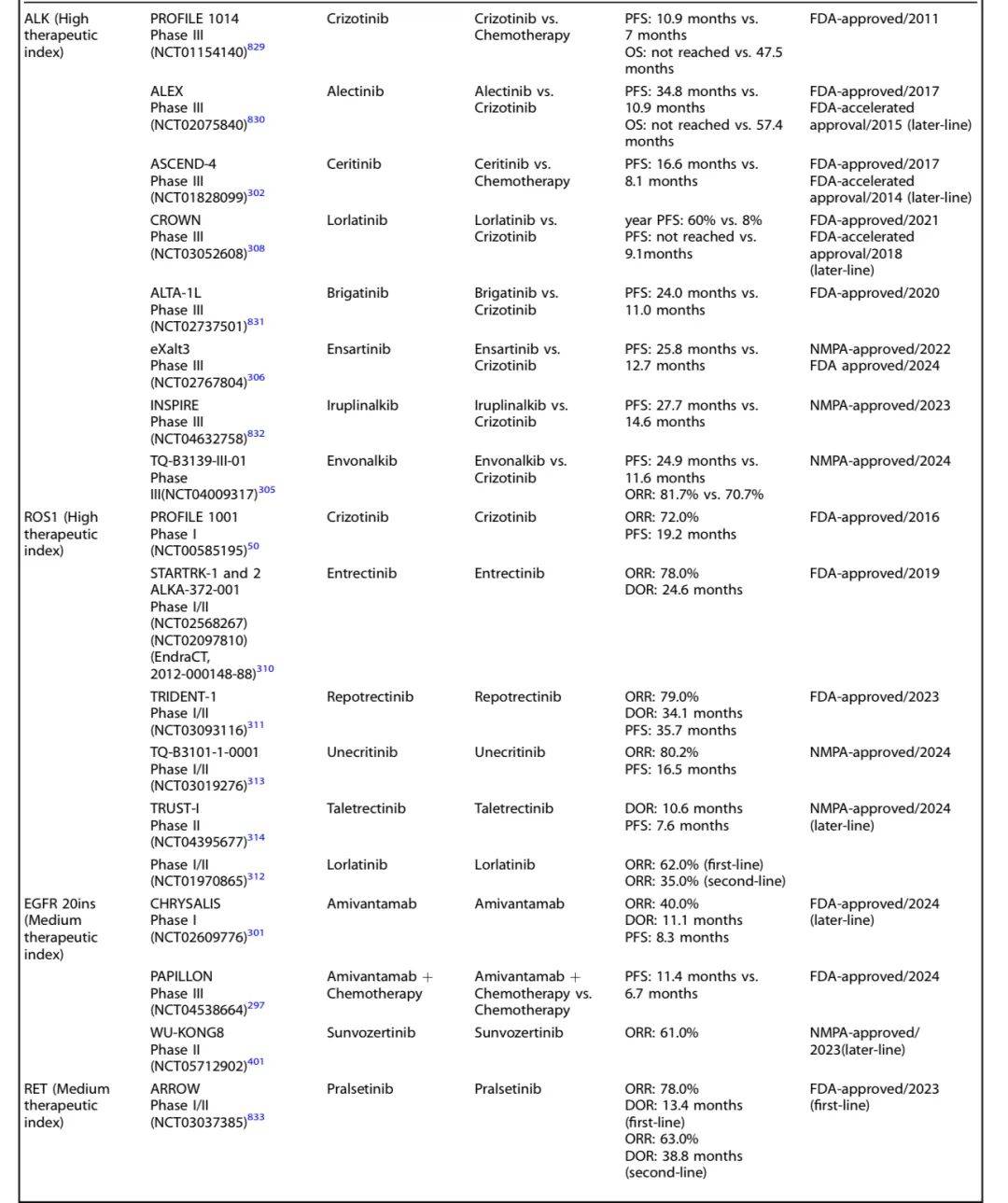
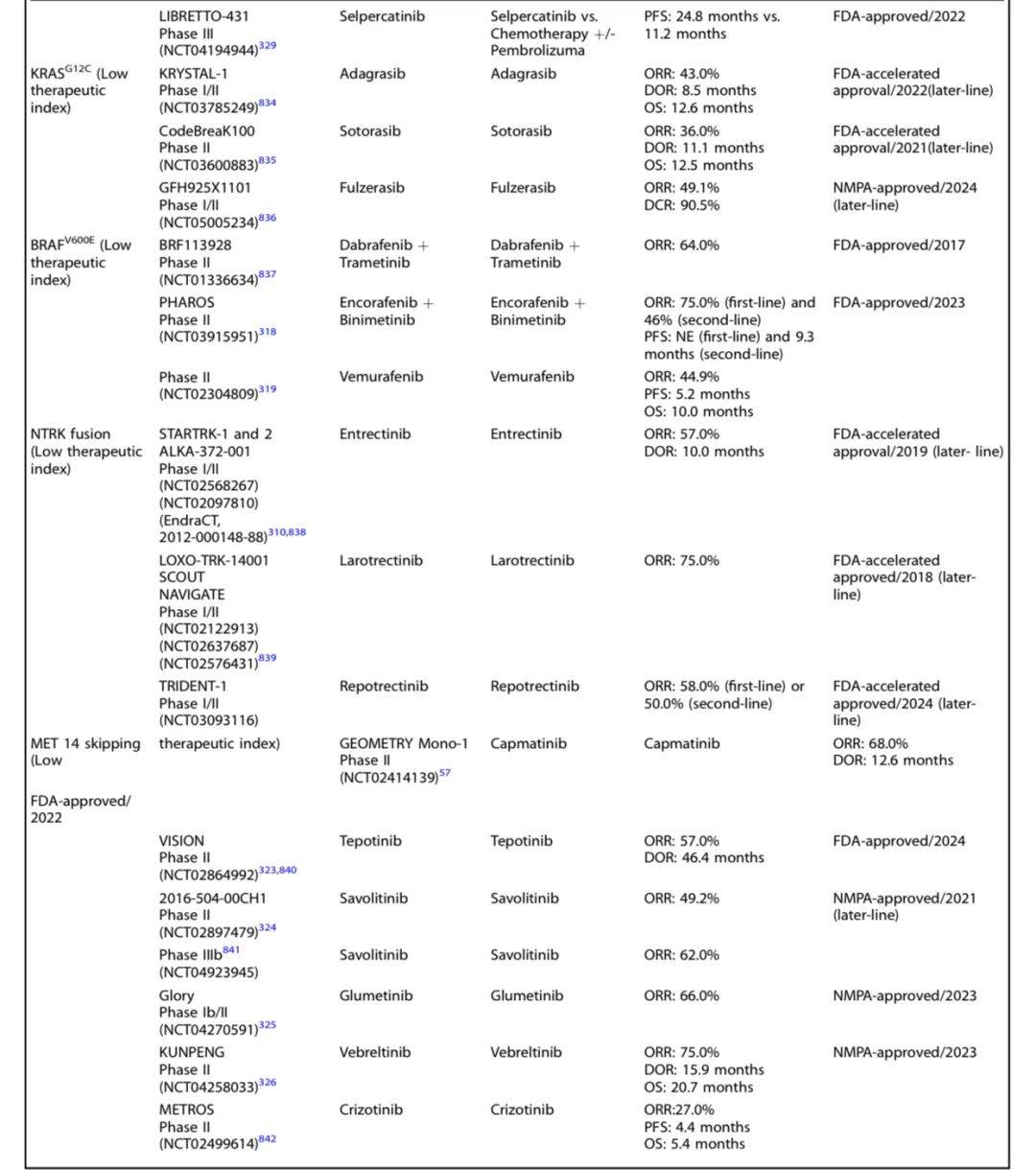
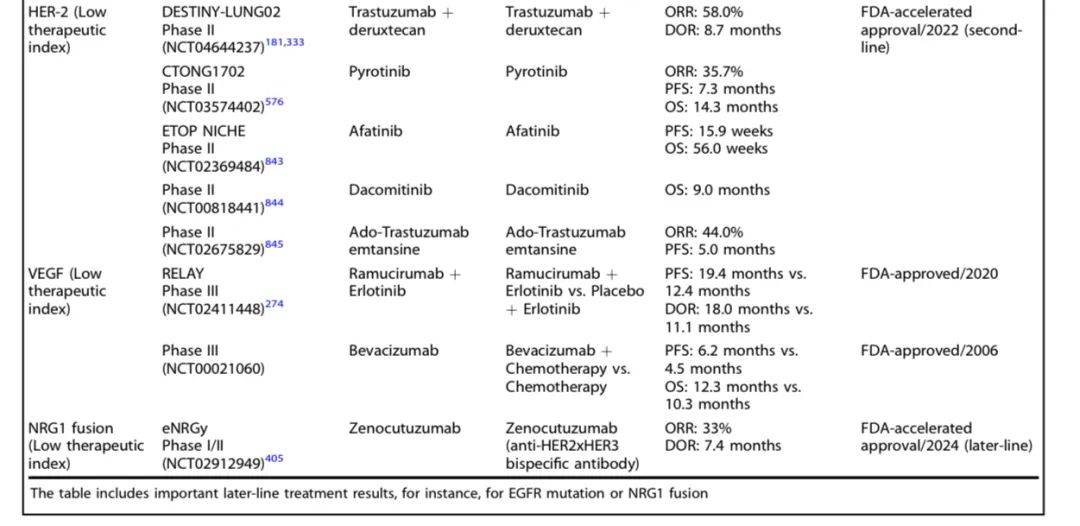
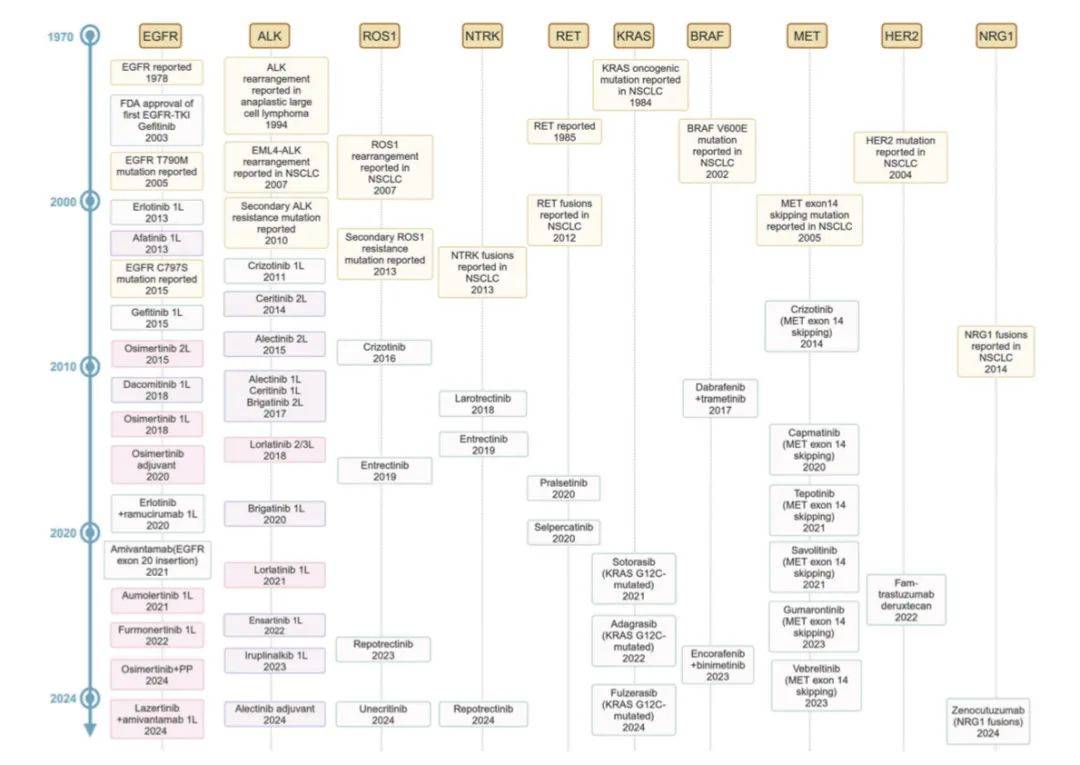
非小细胞肺癌(NSCLC)靶向治疗研究历史及里程碑事件时间线
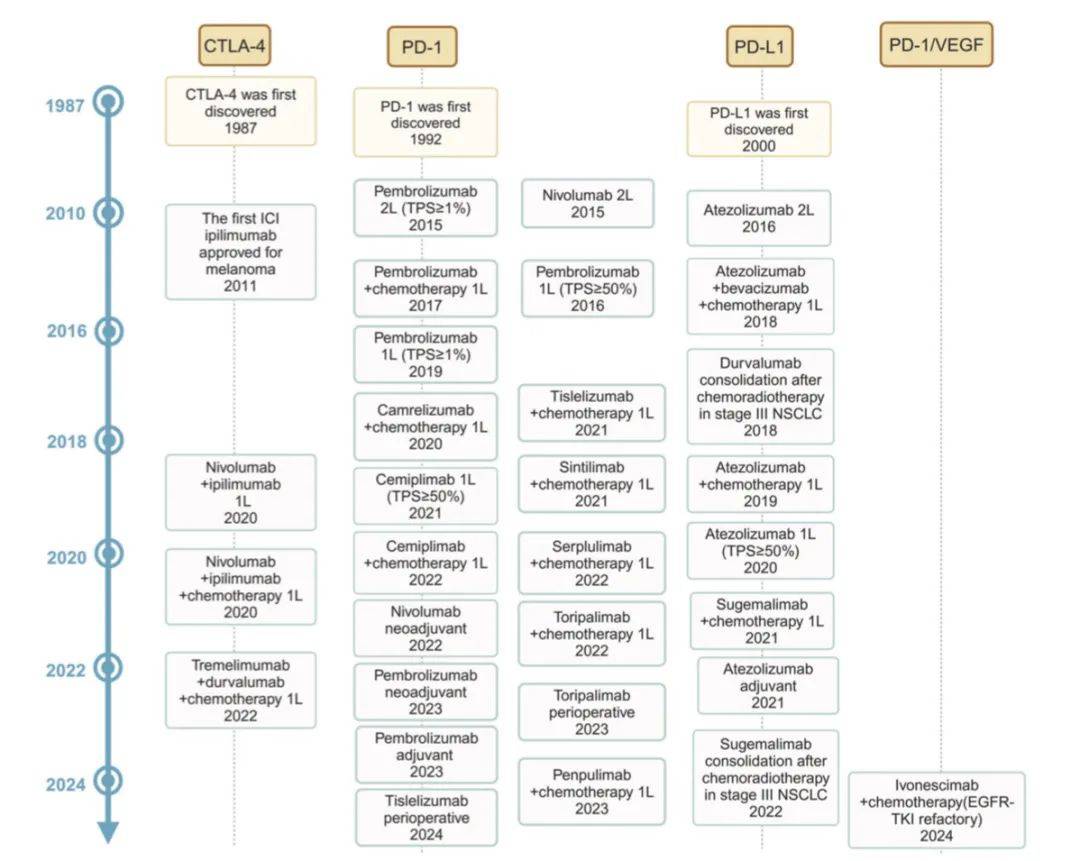
肿瘤基因依赖型转移性非小细胞肺癌(NSCLC)的推荐治疗一览
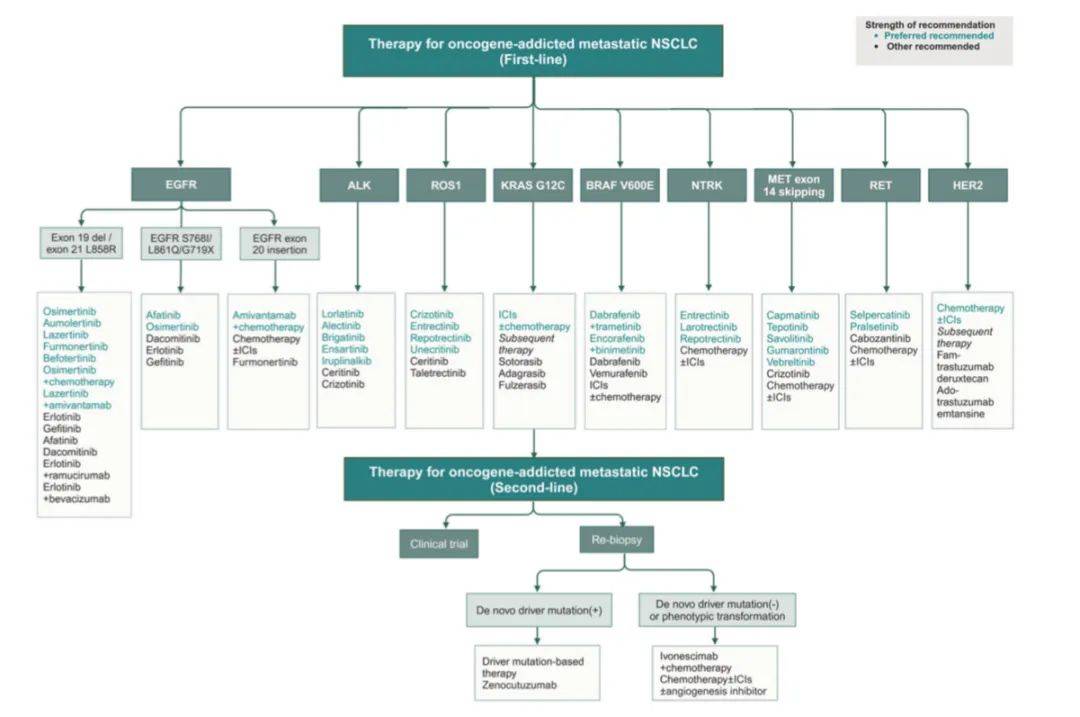
该流程图全面呈现了转移性NSCLC靶向治疗的临床决策思路,强调治疗决策需具备灵活性。例如,根据肿瘤负荷和患者偏好,可选择奥希替尼联合化疗或单药治疗。对于EGFR和ALK突变,第三代酪氨酸激酶抑制剂(TKIs)通常为首选方案。需权衡其获益与成本。
非肿瘤基因依赖型转移性非小细胞肺癌(NSCLC)的推荐治疗一览
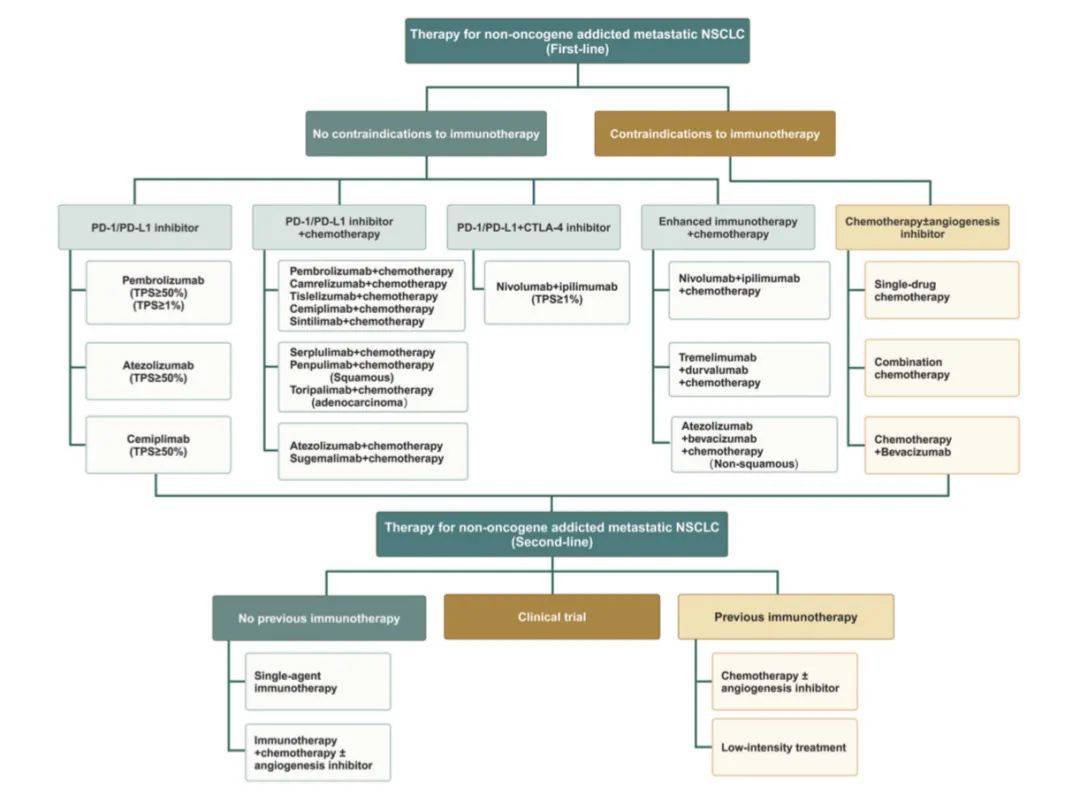
该流程图主要基于药物特性和肿瘤特征对免疫治疗方案进行分类,目前这类方案种类繁多,需根据可及性选择。
尽管化疗联合免疫治疗是标准方案,但仍需考量不同情况,例如白蛋白结合型紫杉醇(nab-paclitaxel)相关的神经毒性可能需要替代治疗策略。抗血管生成生物类似药可作为替代方案。
Ref:Advances in molecular pathology and therapy of non-small cell lung cancer











 苏公网安备32059002004080号
苏公网安备32059002004080号


