病史摘要:患者,男性,57岁,因“上腹部饱胀不适6月”入院治疗。
症状体征:患者外院胃镜示:胃贲门后壁可见一纵行溃疡灶,大小约3.5cm×1.0cm,取病理示:腺癌。患者目前无特殊不适,腹部检查未发现阳性体征,锁骨上也未触及肿大淋巴结。
诊断方法:根据胃镜活检结果显示,患者的贲门部位存在腺癌。而腹部CT检查显示,胃贲门及小弯侧胃壁增厚,考虑为胃癌,且与胰腺的分界不清,附近的胃小弯侧还有多发淋巴结转移。免疫组化结果显示Her-2阳性(3+)。
治疗方法:患者被诊断为局部晚期胃癌后接受了信迪利单抗、曲妥珠单抗和FLOT方案的转化治疗,共进行了5个周期。治疗后肿瘤明显退缩,随后进行了根治性手术。手术后,患者接受了信迪利单抗、曲妥珠单抗和雷替曲塞的辅助治疗,共进行了3个周期。
临床转归:术后完成辅助治疗后,患者定期进行复查,并未发现明显异常。
适合人群:胃肠外科,肿瘤内科,消化科
关键词:胃癌;免疫治疗;转化治疗;靶向治疗
前言
胃癌在我国的发病率和死亡率排名第三,根据2020年的数据,中国新发胃癌病例达到47.8万例,死亡病例为37.3万例[1]。相对于日本和韩国,我国早期胃癌病例较少,大约70%的胃癌病例为局部进展期和晚期,其中不可切除的局部晚期胃癌预后较差,五年生存率低于10%[2]。针对局部晚期胃癌,通常采取转化治疗,主要包括化疗和放疗,但总体转化成功率有限。近年来,随着免疫治疗和靶向治疗的发展,为晚期胃癌患者带来了新的希望。研究表明,在转化治疗中加入免疫治疗和靶向治疗可以明显提高转化成功率,这对改善患者的预后至关重要。病例中患者对免疫治疗和靶向治疗的良好反应,显示了这些新型治疗方法在局部晚期胃癌治疗中的潜力,为未来治疗策略的发展提供了参考。这些新的治疗方法为晚期胃癌患者提供了更多的治疗选择,并为他们的生存和生活质量带来了积极的影响。该病例为胃肠外科医生提供了一个局部晚期胃癌转化治疗的成功案例,强调了个体化治疗、多学科协作和新型治疗方法的重要性,有助于指导临床实践,改善患者的治疗结果和生活质量。
临床资料
一般资料
患者男性,57岁,因“上腹部饱胀不适6个月”入院,患者自诉于2022年2月出现上腹部饱胀不适,伴有呃逆,无恶心、呕吐,无畏寒、发热,无心慌、胸闷等不适。2022年8月18日于咸宁市第一人民医院行胃镜示:胃贲门后壁可见一纵行溃疡灶,大小约3.5 cm×1.0cm,取病理示:腺癌。今患者来我院要求进一步检查及治疗,门诊以“胃癌”收入院,入院后行进一步检查及治疗。患者自患病以来,神志清楚,精神尚可,食欲,睡眠一般,大小便正常,体力体重无明显改变。患者既往史无特殊。入院查体:腹平软,无压痛、反跳痛,未触及肿块,浅表淋巴结未触及肿大。
检查
2022年8月25日进行的肿瘤标志物检查显示CEA水平高达345ng/mL,CA199为21U/mL,CA724为6U/mL,CA50为7U/mL。但血常规、生化、凝血机制、传染病和大小便常规等检查未发现明显异常。
而在2022年8月27日进行的腹部CT检查显示胃贲门及小弯侧胃壁增厚,考虑为胃癌,并且附近的胃小弯侧有多发淋巴结转移并融合成团,与胰腺的分界不清。这些检查结果提示患者可能患有胃癌并已发生转移。
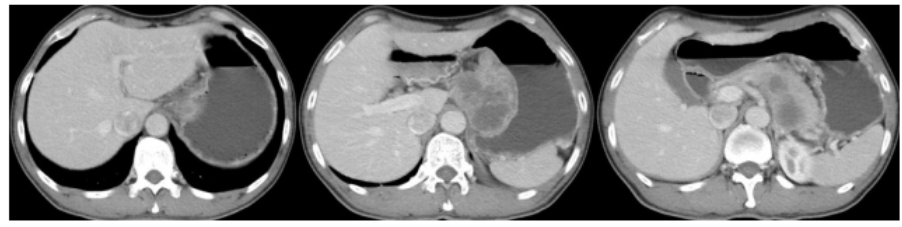 图1. 患者2022年8月27日腹部CT
图1. 患者2022年8月27日腹部CT
根据患者的病理会诊结果显示为腺癌,并且免疫组化结果显示Her-2阳性(3+),PD-L1 CPS为8。这些结果进一步确认了患者胃癌的诊断。
此外,胸部CT和全身骨扫描等检查未发现明显的转移征象,这表明患者目前的转移情况可能局限于腹部区域。
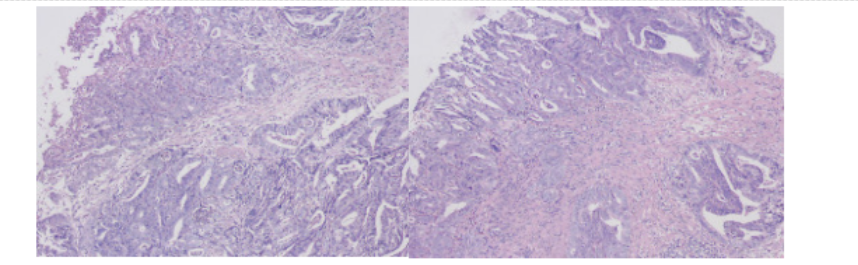 图2. 活检病理 100倍,术后病理 40倍
图2. 活检病理 100倍,术后病理 40倍
诊断
诊断:根据患者的胃镜活检结果以及腹部CT等影像学结果,患者的胃癌诊断为cT4N+M0,表示肿瘤已经侵犯了胃壁的深层组织(T4),并且淋巴结转移(N+),但尚未发现远处的器官转移(M0)。诊断明确,无需鉴别。
治疗
自2022年8月28日起,患者开始接受以信迪利单抗、曲妥珠单抗和FLOT方案为核心的综合治疗,持续了5个周期,每个周期为期3周。在治疗初期,患者出现了二级骨髓抑制的副作用。为应对这一挑战,治疗团队采纳了预防性措施,特别是提前使用硫培非格司亭(PEG-rhG-CSF),以预防中性粒细胞减少性发热(FN)。这一决策考虑到患者处于FN的高风险状态,并且急需出院,因此及时采用长效升白药物变得至关重要。此策略成功避免了进一步的骨髓抑制。在我们精心的治疗计划下,患者的反应显著,尤其是癌胚抗原(CEA)水平的持续下降,从初始的216 ng/mL降至5.22 ng/mL,直观显示了治疗效果。这一系列的治疗措施不仅彰显了个体化治疗方案的效力,也凸显了在面对高风险患者时,实施积极预防措施的重要性。
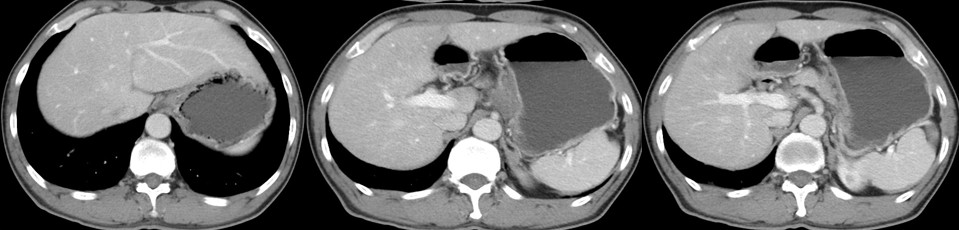 图3. 患者2022年12月10日腹部CT
图3. 患者2022年12月10日腹部CT
经过5个周期的治疗并转换治疗方案后,复查的腹部CT显示,经过综合治疗后,胃贲门和小弯侧胃壁的肿瘤明显缩小,邻近的多发淋巴结转移也有所减小。患者的腹部CT结果显示肿瘤显著降期,全身其他部位未发现新的转移灶。因此,考虑到患者有望接受手术治疗,在排除了手术禁忌后,患者于2022年12月15日在全麻下接受了胃癌根治手术(全胃切除及食管-空肠R-Y吻合)。术后恢复良好,并继续接受了以信迪利单抗、曲妥珠单抗和雷替曲塞为基础的3个周期辅助治疗。
术后的病理检查结果显示,在全胃切除标本中,平坦区和浆膜面稍质硬区的取材充分,镜下观察到坏死、泡沫细胞、组织细胞和炎细胞的浸润,以及胆固醇结晶,但未观察到明确的癌细胞残留,这与治疗后的完全反应相符。同时,上下切端和网膜组织均未见癌细胞残留。检查的26个淋巴结(包括平坦区周围、小弯侧、幽门下、大弯侧淋巴结以及其他特定淋巴结)中也未发现转移癌,均未见化疗后反应。
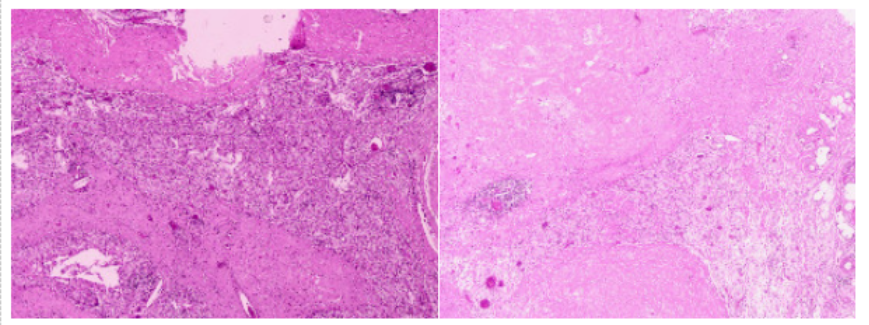 图4. 术后病理图像
图4. 术后病理图像
治疗结果、随访及转归
在完成根治性手术后,患者进行了补充的辅助治疗,最终一次治疗在2023年3月进行。定期的复查和随访显示,患者整体状况保持良好,没有发现任何明显的复发或转移情况,这反映了治疗带来的持久效果和患者的积极预后。而且治疗初期,面临二级骨髓抑制的副作用时,治疗团队采取了预防措施,尤其是及时使用硫培非格司亭(PEG-rhG-CSF)进行早期干预。这一策略成功避免了进一步的骨髓抑制问题,确保了患者治疗过程的顺利进行。
讨论
据Globocan 2020数据显示,中国每年新发胃癌病例占全球新发病例43.9%,死亡病例占全球48.5%,平均每1-2分钟就有1名国人因胃癌去世,胃癌被称之为“中国式癌症”[1-2]。研究表明,遗传风险和生活方式是导致中国人胃癌高发的两大因素,坚持良好生活方式,能够显著降低具有胃癌高遗传风险者的胃癌发病风险[3]。
在我国,胃癌患者数量庞大,且往往在诊断时已发展至较晚阶段,部分病例在被发现时已是局部晚期。面对局部晚期胃癌,无论选择姑息性减瘤手术还是依赖全身性治疗,总体预后仍然不容乐观。转化治疗策略旨在应对这一挑战,通过将化疗等系统治疗前置于手术之前,目的是缩小肿瘤体积、有效控制转移灶,从而可能将原本无法切除或不能彻底切除的肿瘤,转变为可根治性切除的状态。对局部晚期胃癌患者而言,现行指南主要建议以放射和化疗为核心的转化治疗,随后评估手术的可行性。目前的研究表明,采用放化疗的转化治疗,其成功率介于30%到60%之间,且倾向于选择三药联合化疗方案,其中FLOT三药方案因其较高的客观缓解率而被视为一种优先选项,尤其适用于身体状况较好的患者[4-6]。
治疗初期,面对二级骨髓抑制的不良反应,团队采用了预防性的措施,特别是早期使用了硫培非格司亭(PEG-rhG-CSF)。Vogel等的研究发现,采用PEG-rhG-CSF进行一级预防的患者,其中性粒细胞减少性发热(FN)的发生率从17%降至1%(P<0.001),住院率从14%降至1%(P<0.001),以及抗感染药物使用率从10%降至2%(P<0.001)。中国的临床试验也对rhG-CSF和PEG-rhG-CSF预防化疗后中性粒细胞减少症的效果进行了比较分析。结果显示,在使用这两种药物的治疗周期中,未出现四级外周血中性粒细胞绝对值减少的患者比例高达94.3%,均未发生FN,抗生素的使用率分别为7.5%和3.8%(P=0.678)。因此,尽早采用长效的升白细胞药物进行预防显得格外关键,有效避免了进一步的骨髓抑制现象[7]。这一系列治疗措施不仅展示了个体化治疗方案的力量,也凸显了对高风险患者采取积极预防措施的重要性。
近年来,免疫检查点抑制剂在晚期胃癌治疗上取得重大突破,在胃癌的一线及后线治疗中均显示了显著疗效,Checkmate-649,ORIENT-16两个III期临床研究确定了PD-1单抗纳武利尤单抗以及信迪利单抗联合双药化疗在晚期胃癌患者的一线标准治疗的地位,两项研究中PD-1单抗联合两药方案化疗全人群客观缓解率在50%-60%左右[8-9]。对于HER-2阳性晚期胃癌,ToGA研究确定了曲妥珠单抗的一线治疗地位,最新的研究发现免疫治疗在此类患者中也有良好疗效[10]。在Keynote811研究中,帕博利珠单抗联合曲妥珠单抗和化疗明显降低晚期HER-2阳性胃癌或胃食管交界处腺癌的疾病进展风险和死亡风险,客观缓解率达到74.4%[11]。
免疫联合化疗对于局部晚期胃癌围手术期的探索也正在进行中,有小样本研究显示可提高转化成功率及病理完全缓解率。对于HER-2阳性晚期胃癌,我们看到Keynote811研究中高达74.4%的客观缓解率,更高的客观缓解率意味着更高的转化切除率。因此在本例患者HER-2阳性且为免疫治疗优势人群的情况下,转化治疗采用免疫联合靶向及化疗,以期获得根治性切除机会。患者转化治疗5周期后行手术切除,术后病检提示病理完全缓解,术后随访未发现转移、复发征象,取得良好疗效。本例患者的诊治提示,免疫联合靶向及化疗在Her-2阳性胃癌转化治疗中可带来良好疗效。
综上所述,该病例强调了转化治疗在局部晚期胃癌治疗中的重要性。免疫联合靶向治疗为Her-2阳性晚期胃癌患者带来新的希望,在转化治疗中采用靶免化三联疗法可明显提高转化成功率及病理完全缓解率,明显改善局晚期患者的预后,显示了这些新型治疗方法在局部晚期胃癌治疗中的潜力,为未来治疗策略的发展提供了参考。该病例的成功治疗涉及了胃肠外科、肿瘤内科、放射科等多个学科的协作,体现了多学科团队在复杂病例中的重要性。此外,患者在接受转化治疗时出现了骨髓抑制,治疗团队采取了预防性措施,使用硫培非格司亭(PEG-rhG-CSF)进行早期干预。这进一步强调了在治疗过程中对患者个体差异的关注和个体化治疗的重要性。我们期待不久的将来,更多的患者能通过精准的转化治疗获得根治性手术的机会。
[1] World Health Organization (WHO). World cancer report 2020. 2020. URL: https://www.iarc.fr/cards_page/world-cancer-report/.
[2]《胃癌的生存率和生存时间》2019-04-07 http://www.360doc.com/content/19/0407/06/30532947_826914082.shtml
[3] Jin G, Lv J, Yang M. Genetic risk, incident gastric cancer, and healthy lifestyle: a meta-analysis of genome-wide association studies and prospective cohort study (vol 21, pg 1378, 2020)[J].The lancet oncology, 2020(11):21.
[4] Conversion therapy for inoperable advanced gastric cancer patients by docetaxel, cisplatin, and S-1 (DCS) chemotherapy: a multi-institutional retrospective study[J]. Gastric Cancer 2017, 20(3):517-526.
[5] Sym SJ, Chang HM, Ryu MH, Lee JL, Kim TW, Yook JH, Oh ST, Kim BS, Kang YK. Neoadjuvant docetaxel, capecitabine and cisplatin (DXP) in patients with unresectable locally advanced or metastatic gastric cancer[J]. Ann Surg Oncol 2010, 17(4):1024-1032.
[6] Al-Batran SE, Homann N, Pauligk C, Illerhaus G, Martens UM, Stoehlmacher J, Schmalenberg H, Luley KB, Prasnikar N, Egger M, et al. Effect of Neoadjuvant Chemotherapy Followed by Surgical Resection on Survival in Patients With Limited Metastatic Gastric or Gastroesophageal Junction Cancer[J]. The AIO-FLOT3 Trial. JAMA Oncol 2017, 3(9):1237-1244.
[7] 肿瘤放化疗相关中性粒细胞减少症规范化管理指南.中华肿瘤杂志,2017,39(11) : 868-868.
[8] Janjigian Y Y, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[9] Annals of Oncology (2021) 32 (suppl_5): S1283-S1346.
[10] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER-2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet. 2010;376(9742):687-97.
[11] Janjigian YY, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER-2 blockade in HER-2-positive gastric cancer[J]. Nature. 2021 ;600(7890):727-730.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


