病史摘要:患者女性,52岁,围绝经期,因右乳肿物3年,破溃3个月于2017年7月来我院就诊。既往体健,家族史无特殊。
症状体征:右乳房乳头乳晕缺失,右乳可见隆起的菜花状肿物,呈暗红色,占据整个乳腺,肿物面积12.0cm×10.0cm,肿物表面皮肤破溃,破溃范围3.0cm×2.0cm。右腋下可触及直径2.0cm淋巴结,质硬,活动可,左乳腺、左腋下及双侧锁骨上下未触及异常肿物。
诊断方法:病理活检,行右乳肿物穿刺。病理:右乳腺非特殊型浸润性癌(浸润性导管癌),组织学分级Ⅱ级,皮肤乳头层见有癌组织浸润,皮肤表面炎性渗出及坏死,伴霉菌菌团形成。ER(弱、中等+70%)、PR(弱、中等+20%)、HER2(0)、Ki-67(+90%)。右侧锁骨上结节穿刺病理:转移性腺癌;左侧腋下:淋巴结穿刺组织未见癌。结合患者影像学和病理检查,临床诊断为:右乳腺癌(cT4N3M0 ⅢC期)
治疗方法:经过多学科MDT讨论,整体评估患者状态,结合相关诊疗指南,患者右侧局部晚期乳腺癌,符合新辅助化疗的指征,遂行术前新辅助化疗。新辅助治疗方案为TE:多西他赛140mg、表柔比星150mg,21天一周期,因第一次化疗后重度骨髓抑制,后续周期应用硫培非格司亭长效升白保护。手术治疗,术后两年复发,应用内分泌治疗。
临床转归:术后21个月后复发,应用内分泌治疗。
适合阅读人群 乳腺外科 放化疗科
关键词 乳腺癌;骨髓抑制;新辅助治疗;内分泌治疗;硫培非格司亭
引言
雌激素在HR+(激素受体阳性)乳腺癌的生长中扮演着关键角色。通过与激素受体结合并激活它们,雌激素不仅促进乳腺癌细胞的增殖和侵袭,还抑制了肿瘤细胞的自然死亡。因此,针对HR+乳腺癌患者的内分泌治疗显得至关重要,这种治疗应当伴随患者从乳腺癌的早期治疗直至复发挽救治疗的整个临床过程。近年,随着CDK4/6抑制剂和HDAC抑制剂等靶向治疗手段的出现,这些治疗在传统内分泌治疗基础上进一步提升了疗效,显著改善了患者预后。接下来,我们将介绍一例HR+/HER2-晚期乳腺癌的治疗案例。该患者在接受辅助内分泌治疗期间出现耐药,属于原发性内分泌治疗耐药群体。她首先接受了戈舍瑞林+来曲唑的辅助内分泌治疗。然而,在治疗21个月后,右腋下局部进展,幸好没有内脏或其他脏器的转移。随后,治疗方案更换为氟维司群+西达本胺的内分泌治疗,从而取得了部分缓解(PR)。目前,该患者已获得超过20个月的无进展生存期(PFS)。
临床资料
一般资料
一位52岁的女性患者在围绝经期时,因为右侧乳房出现肿块已经三年,并在过去三个月内破溃,于2017年7月来到我们医院寻求治疗。她过去一直身体健康,家族中没有特别的病史。检查发现,该患者的右乳房乳头和乳晕部分缺失,可以看到一块暗红色的、占据整个乳腺的菜花状隆起肿物,其大小约为12.0cm×10.0cm,表面有3.0cm×2.0cm的皮肤破溃。在右腋下可以触及到直径约2.0cm的硬质淋巴结,这些淋巴结可以移动。而在左乳腺、左腋下和双侧锁骨上下则没有触及到任何异常肿物。通过病理活检和右乳肿物穿刺检查,诊断出该患者患有非特殊型浸润性乳腺癌(即浸润性导管癌),且为Ⅱ级组织学分级。癌组织已浸润至皮肤乳头层,伴有皮肤表面的炎性渗出和坏死,还有霉菌菌团的形成。患者的雌激素受体(ER)表达弱中等,约70%,孕激素受体(PR)表达弱中等,约20%,人表皮生长因子受体2(HER2)为0,Ki-67标记为+90%。右侧锁骨上结节的穿刺病理检查显示为转移性腺癌;而左侧腋下的淋巴结穿刺组织未见癌细胞。结合影像学和病理检查,临床诊断该患者为ⅢC期右侧乳腺癌(cT4N3M0)。治疗方案为新辅助治疗,即在手术前先进行化疗来缩小肿瘤。基于患者的病情和相关诊疗指南,她接受了以多西他赛140mg和表柔比星150mg为基础的TE化疗方案,每21天为一次治疗周期。由于第一次化疗后出现重度骨髓抑制,后续周期中加入了硫培非格司亭长效制剂以保护白细胞数。在完成新辅助化疗后,患者进行了手术治疗。不幸的是,手术两年后,肿瘤复发,随后患者接受了内分泌治疗。
检查
专科检查:右乳房乳头乳晕缺失,右乳可见隆起的菜花状肿物,呈暗红色,占据整个乳腺,肿物面积12.0cm×10.0cm,肿物表面皮肤破溃,破溃范围3.0cm×2.0cm。右腋下可触及直径2.0cm淋巴结,质硬,活动可,左乳腺、左腋下及双侧锁骨上下未触及异常肿物。入院检查阴性结果:血尿常规、凝血、肿瘤标记物等未见明显异常;头颅、胸部、上腹CT未见明显异常;全身骨显像未见异常。
2017年7月行乳腺超声:右侧乳腺实性团块,BI-RADS:5级,右腋下多发低回声结节,考虑:异常肿大淋巴结;左侧腋下多发低回声结节(不除外肿大淋巴结)。下颈部彩超:右锁骨上不除外肿大淋巴结。右侧乳腺可见团块状稍长T1长T2信号大小约10.0cm×8.9cm,BI-RADS-MRI 5类,右侧腋窝多发短径1.1cm以下淋巴结影,左侧腋窝可见短径0.7cm淋巴结影。
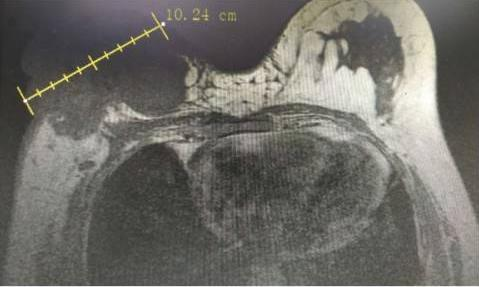
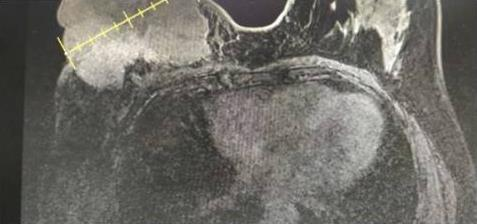
诊断与鉴别诊断
病理活检:行右乳肿物穿刺,病理:右乳腺非特殊型浸润性癌(浸润性导管癌),组织学分级Ⅱ级,皮肤乳头层见有癌组织浸润,皮肤表面炎性渗出及坏死,伴霉菌菌团形成。ER(弱、中等+70%)、PR(弱、中等+20%)、HER2(0)、Ki-67(+90%)。右侧锁骨上结节穿刺病理:转移性腺癌;左侧腋下:淋巴结穿刺组织未见癌。结合患者影像学和病理检查,临床诊断为:右乳腺癌(cT4N3M0 ⅢC期)。诊断明确,无需鉴别。
治疗
经过多学科MDT讨论,整体评估患者状态,结合相关诊疗指南,患者右侧局部晚期乳腺癌,符合新辅助化疗的指征,遂行术前新辅助化疗。新辅助治疗方案为TE:多西他赛140mg+表柔比星150mg,21天一周期。第一周期化疗后第7天,患者发热,体温38.6℃,当地医院急查血细胞分析白细胞0.76×109/L,中性粒细胞0.24×109/L,血红蛋白82g/L,红细胞3.82×1012/L,血小板141×109/L,考虑重度骨髓抑制,予患者对症治疗。后续周期化疗后予患者硫培非格司亭6mg皮下注射,预防性升白保护,未再发生骨髓抑制。
化疗过程中进行疗效评估,影像学评估肿瘤有缩小,患者化疗前后影像学变化如下图。
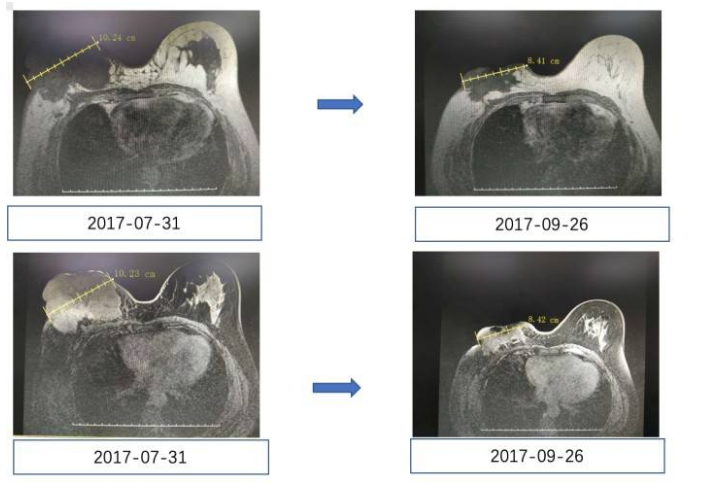
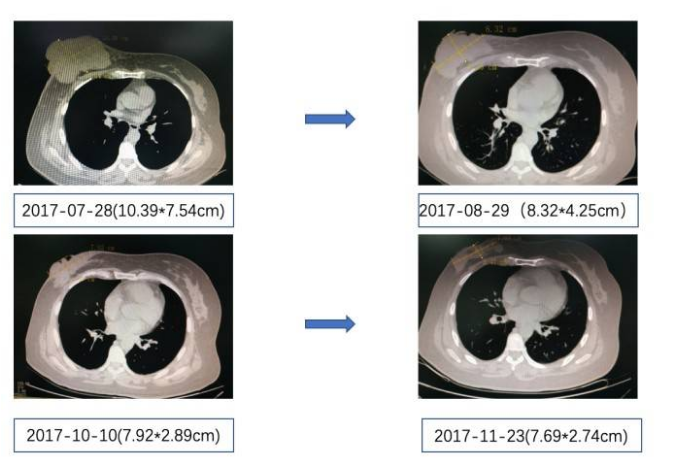
图3. 化疗前后胸部CT变化
手术治疗及术后病理
6周期TE方案新辅助化疗后,2017年12月19日行右侧乳腺癌改良根治术(备临近皮瓣转移术),术中做切缘冰冻病理未见癌残留。右乳腺癌改良根治术后病理:右乳腺非特殊型浸润性癌(浸润性导管癌),组织学分级Ⅱ级,肿物呈结节状并相互融合,总体积:9.5cm×5cm×3cm,癌组织侵犯脂肪,脉管见癌栓。切口上下方皮缘未见癌。免疫组化:ER(弱、中等+30%)、PR(弱、中等+20%)、HER2(0),Ki67(+80%)。淋巴结:腋下淋巴结见癌转移(1/11)、癌结节2枚,肌间纤维脂肪组织未见癌,腋尖纤维脂肪组织内见癌结节1枚,其余未见癌。淋巴结总计(1/11转移,癌结节3枚)。化疗评价MP分级:G3(肿瘤细胞减少约50%)。术后诊断为:右乳腺癌(ypT4N3M0ⅢC期)。
患者术后常规放疗+内分泌治疗,用药:戈舍瑞林+托瑞米芬。戈舍瑞林3.6mg皮下注射,1次/28天;托瑞米芬60mg口服,1次/日。3个月后改用戈舍瑞林+阿那曲唑,2.5mg,1/日。患者术后定期门诊复查,饮食、精神、睡眠可,二便正常,体重无明显变化。
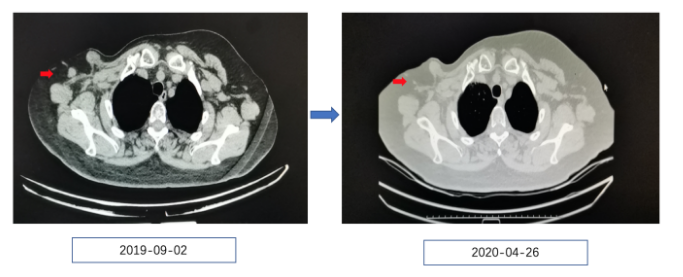
2019年9月2日门诊复查彩超提示:右侧腋下可见两个低回声结节,建议超声下穿刺。胸部CT、腹部、锁骨上下彩超未见明显异常,遂继续入院治疗。行右腋下结节穿刺活检病理:见转移癌,结合免疫组化考虑来源于乳腺,ER(弱、中+80%)、PR(-)、HER2(0)、Ki-67(+80%)。复发诊断为:右乳腺癌术后,右腋下局部复发。疗效评估进展,DFS:1年9个月。
患者在阿那曲唑治疗期间2年内出现复发,考虑阿那曲唑耐药以及患者的经济情况,更换为氟维司群+HDAC抑制剂继续内分泌治疗。具体方案为:氟维司群 500mg肌肉注射,28d/次(第一个月强化)+西达本胺 口服30mg(6片,5mg /片),每周2次。患者治疗后因疫情原因患者未来院复查,电话随访,患者一般状况稳定,精神、饮食、体力均趋于正常,无明显不适。2020年4月26日来院复查,血常规、肿瘤标志物、生化大致正常,锁骨上下淋巴结超声、腹部超声、妇科超声大致正常。2019年9月2日右腋下可见两个低回声结节,分别为1.5cm×1.0cm、1.1cm×0.8cm,边界清。2020年4月26日行右腋下低回声结节,0.84cm×0.38cm,边界尚清。疗效评估为PR,一线治疗前后胸部CT、乳腺超声变化如下。

治疗结果、随访及转归
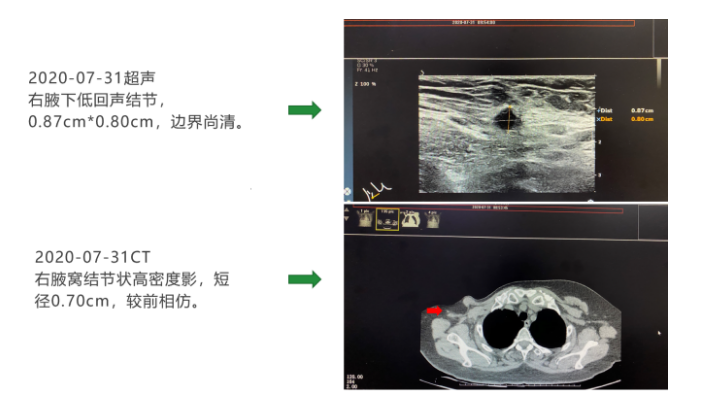
2020年7月31日再次复查血常规、肝功能、乳腺肿瘤标志物未见明显异常。2020年7月31日超声提示右腋下低回声结节,0.87cm×0.80cm,边界尚清。2020年7月31日 CT提示右腋窝结节状高密度影,短径0.70cm,较前相仿。疗效评估为维持PR,腋下结节超声变化如下。目前,患者已经取得10个多月的PFS,仍在继续治疗和定期随访过程中。
讨论
本病例报告介绍了一位处于围绝经期的女性患者,经过多学科团队合作可以显著提升乳腺癌患者的治疗效果,通过综合各学科意见为患者制定最佳治疗方案,提高生存率。MDT模式从诊断到治疗、到患者随访,提供全病程管理,改善患者生存预后和生活质量 ,也为医疗专业人员提供了宝贵的学习和成长机会。
该患者首次诊断时为局部晚期乳腺癌,分期为cT4N3M0 ⅢC期,激素受体阳性/HER2阴性(HR+/HER2-)。在接受TE方案的新辅助治疗后,患者进行了右乳腺癌的改良根治手术。术后病理评估显示化疗效果为G3,未能达到病理学上的完全缓解。因此,患者继续接受了两个周期的TE方案化疗,并同时进行了常规的放疗和戈舍瑞林+来曲唑的辅助内分泌治疗。经过21个月的治疗,患者右腋下局部出现病情进展,但未发现内脏或其他脏器的转移。此后,患者的治疗方案调整为氟维司群+西达本胺的内分泌治疗,病情得以稳定,无进展生存期(PFS)达到23个月,复查显示病情持续稳定。在乳腺癌患者中,乳腺癌改良根治术是一种在治疗乳腺癌时,相对于传统的根治性手术(如Halsted手术)保留了胸大肌或胸大小肌的手术方式。本例患者采用乳腺癌改良根治术,与传统根治术相比,在不降低治疗效果的前提下,减少了术后并发症,也在一定层面上改善了患者的外观和功能,从而提高了生存质量。
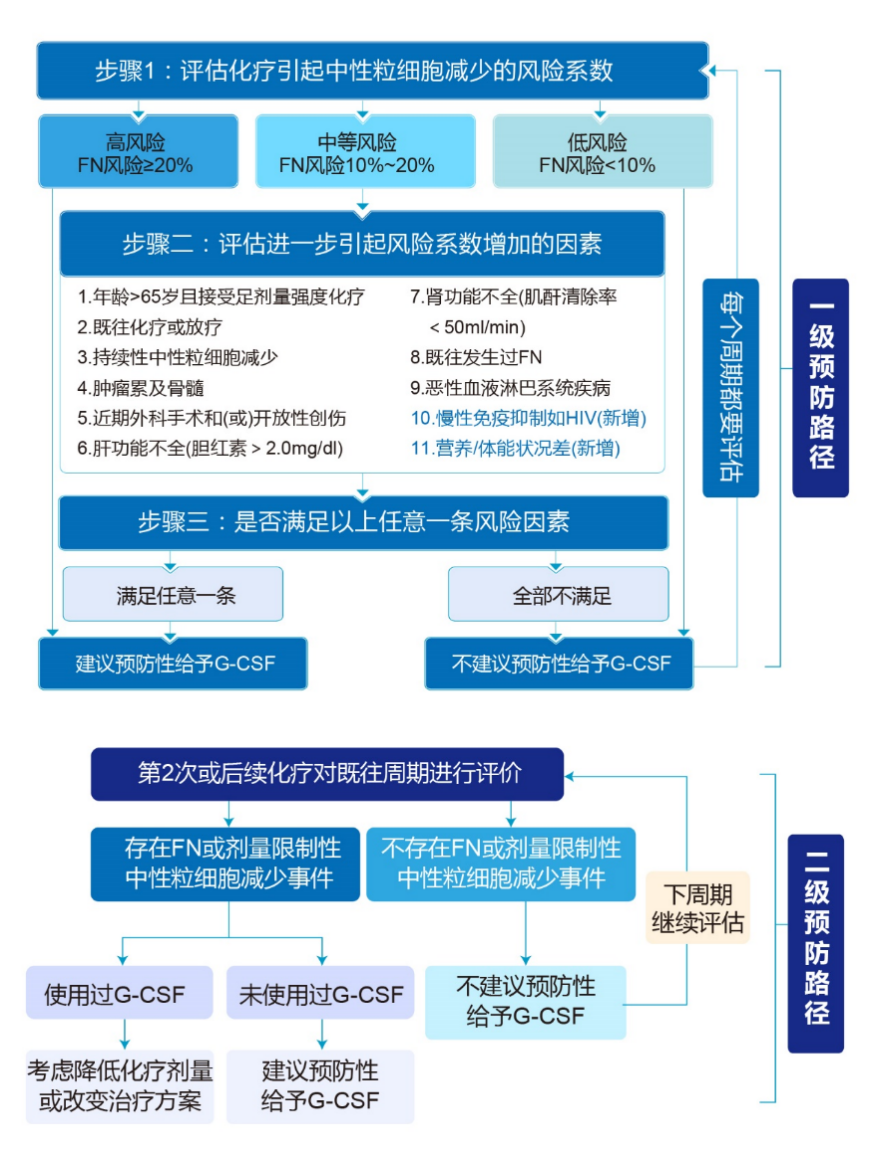
此外,在放化疗患者中,骨髓抑制是一个需要重点关注的不良事件,其中中性粒细胞减少症是最常见的血液学毒性。中性粒细胞的减少程度和持续时间与患者的感染风险甚至死亡风险直接相关,对化疗药物的相对剂量强度及患者预后产生不良影响。2020年CSCO指南对肿瘤放化疗相关的中性粒细胞减少症进行了规范化管理,提出了分层管理的理念,并建立了预防与治疗的临床路径。该指南详细讲解了中性粒细胞减少症的分级、生理病理特性,并指导临床医生特别关注化疗后8-14天的血常规结果,以便及时识别和管理中性粒细胞减少症及其并发症[1]。在我们的临床实践中,对每位患者在每个化疗周期都进行FN风险评估和分层,并对中高风险患者,尤其是那些有高危因素的患者,采用聚乙二醇化重组人粒细胞刺激因子(PEG-rhG-CSF)进行一级预防(图1)[2, 3]。对于已经发生FN的患者,实施二级预防,以实现骨髓抑制管理的精准化和个体化。
此外,指南还详细说明了短效及长效升白制剂的使用最佳时间、剂量及方法,指导临床医生个体化预防及治疗放化疗相关中性粒细胞减少症[1]。预防性使用G-CSF能有效降低感染率、FN发生率以及住院率,缩短患者的住院次数及天数[4-6]。循证医学证据显示G-CSF作为一级预防措施,FN发生风险可降低46%,感染相关死亡风险可降低44.8%[7],住院率可降低13%左右[6]。
PEG-rhG-CSF是重组人粒细胞刺激因子(rhG-CSF)的长效剂型,二者疗效相当,长效制剂更具独特的优势——便捷,每周期化疗仅需使用1次,可提高患者依从性,有效保障患者安全及化疗方案足剂量、足疗程、如期实施[8, 9]。
CSCO乳腺癌临床诊疗指南中指出[1],对于HR+晚期乳腺癌,肿瘤缓慢进展,且无内脏危象的患者,可以首选一线内分泌治疗。关于晚期内分泌治疗方案的选择,需考虑患者的辅助治疗方案,无病间期,复发/转移的疾病负荷选择治疗方案。上述患者是在辅助内分泌2年内出现复发进展,属于内分泌原发耐药人群。根据2020 CSCO-BC指南推荐,非甾体类AI耐药的患者,推荐接受内分泌联合靶向治疗,其中甾体类AI+HDAC抑制剂作为1A类证据推荐[8]。
总之,HR+/HER2-晚期乳腺癌治疗需要考虑既往内分泌治疗无病间期、内分泌治疗反应、肿瘤负荷以及是否存在需要快速控制的症状等因素,也要考虑到患者年龄、体能状态、合并疾病、社会经济学和心理学等患者相关因素。需要通过合理选择、有序安排、全程管理和精准决策,把每一个优效方案用到最佳!
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1] 王英哲, 殷咏梅, 江泽飞. 2020年CSCO《乳腺癌诊疗指南》更新要点解读 [J]. 中国肿瘤外科杂志, 2023, 15(3): 209-13.
[2] 王莉, 周湘哲, 田瑞兆, et al. 肿瘤化疗后中性粒细胞缺乏伴发热合并感染诊治体会 [J]. 中国临床案例成果数据库, 2022, 04(01): E01081-E.
[3] Zhengchuan F U, Fang Q, Xuhuan Y, et al. Association between ABCB1 Gene Polymorphisms and Chemotherapy-induced Severe Neutropenia in Patients with Breast Cancer [J]. China Pharmacy, 2016,
[4] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021) [J]. 临床肿瘤学杂志, 2021, 026(007): 638-48.
[5] Hecht J R, Pillai M, Gollard R, et al. A randomized, placebo-controlled phase ii study evaluating the reduction of neutropenia and febrile neutropenia in patients with colorectal cancer receiving pegfilgrastim with every-2-week chemotherapy [J]. Clinical Colorectal Cancer, 2010, 9(2): 95-101.
[6] Lebrasseur N K, Huffman D M, Denis G V. The Biology of Aging: Role in Cancer, Metabolic Dysfunction, and Health Disparities [J]. Springer International Publishing, 2014,
[7] Laplante R, Claeys K C, Bork J T, et al. Evaluating the Follow-up of Post-discharge Positive Sterile Site Cultures and the Impact on Infection-Related Complications [J]. Infectious Diseases and Therapy, 2023, 3):
[8] Qu S, Qiu J, Zhang Y, et al. Application of pegylated recombinant human granulocyte colony-stimulating factor (PEG-rhG-CSF) for the prevention of neutropenia in triple negative breast cancer patients older than 65 years during adjuvant chemotherapy [J]. Oncology and Translational Medicine, 2019.
[9] 刘琨, 杨成轩. PEG-rhG-CSF治疗乳腺癌化疗后白细胞减少症的有效性及安全性研究 [J]. 上海医药, 2023, 5(12): 33-8.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


