病史摘要:患者,女性,发现左乳包块3个月。
症状体征:三个月前,患者无意中发现左侧乳房出现肿块,同侧腋窝伴有肿物,伴有一定的压痛,但没有隐痛、胀痛或刺痛感。
诊断方法:乳腺B超检查显示左侧乳腺有两个低回声结节,边界不清晰,形态不规则,属BI-RADS 5类;同时,左侧腋窝肿大淋巴结。超声引导下穿刺活检后,左侧乳房位置结节被诊断为浸润性癌Ⅱ级,左侧腋窝淋巴结活检显示淋巴组织内存在癌转移。
治疗方法:给予TCbHP方案新辅助化疗6周期,手术,放疗和内分泌治疗
临床转归:患者顺利完成6周期新辅助化疗后行左侧乳腺癌改良根治术,术后病理提示达到pCR,后期给予双靶治疗满1年,给予依西美坦内分泌治疗,术后1月半给予放疗,目前随访中,乳腺癌各项指标正常,肿瘤得到很好的治疗。另外甲亢突眼控制佳,甲功复查正常。
适合阅读人群:乳腺外科,内分泌科,普通外科
关键词:乳腺癌;甲亢;中性粒细胞减少;硫培非格司亭
前言
根据最新的全球癌症统计数据,乳腺癌已超越肺癌,成为当前全球对人类健康威胁最大的癌症类型[1]。在过去的几十年中,乳腺癌治疗策略已经从以手术为主转向了包括化疗、内分泌治疗及靶向治疗在内的综合治疗模式[2-4]。甲状腺功能亢进(甲亢)是由于甲状腺激素过量合成及分泌引起的一种疾病,而合并甲状腺相关眼病的患者,其治疗主要依赖于药物[5]。值得注意的是,粒细胞缺乏是治疗甲亢时最常见的药物副作用之一[6]。本文报道了一例乳腺癌合并甲状腺功能亢进的病例,目的在于增强医疗专业人员对此类患者的认识,以减少不良反应的发生。
临床资料
一般资料
患者,女性,首次于2023年3月15日就诊于我院。三个月前,患者偶然发现左侧乳腺肿物,伴有压痛,无隐痛、胀痛或刺痛,肿物表面皮肤无红肿或破溃现象;乳头无糜烂、刺痛或瘙痒,亦无乳头溢液;同侧腋窝未触及肿物;上肢无疼痛、麻木或肿胀;患者无低热、盗汗、食欲减退,且无乳房外伤史。外院B超检查结果显示:左乳3点位置低回声结节(25mm×22mm×13mm),左乳4点位置低回声结节(15mm×12mm×9mm),结节边界欠清晰,形态不规则,BI-RADS 5类;左侧腋窝有肿大淋巴结(21mm×13mm)。自发病以来,患者未经历腰背部疼痛、四肢疼痛,无咳嗽、咳血或胸痛,睡眠和饮食状况良好,大小便正常,体重无明显变化。既往患有甲状腺功能亢进症(甲亢)17年,表现为明显的突眼症,7年前接受碘131治疗,目前正通过每日一片优甲乐进行治疗。对磺胺类药物过敏。
检查
超声引导下穿刺活检示:左乳3点、4点结节,浸润性癌Ⅱ级;左侧腋窝淋巴结:淋巴组织内有癌转移。详见图1。
免疫组化结果:
3点结节:雌激素受体(ER,强阳性,+95%)、孕激素受体(PR,中等-强阳性,+90%)、CK5/6(-)、雄激素受体(AR,强阳性,+80%)、人表皮生长因子受体2(Her2,1+)、Ki67(+70%)。
4点结节:ER(强阳性,+95%)、PR(中等-强阳性,+80%)、CK5/6(-)、AR(强阳性,+80%)、Her2(1+)、Ki67(+60%)。
左侧腋窝淋巴结:ER(强阳性,+90%)、PR(中等-强阳性,+80%)、Her2(3+)、Ki67(+60%)。
胸部、上腹部和盆腔CT未见异常,全身骨扫描大致正常,头颅磁共振未见异常。
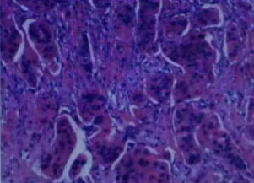 图1. 超声引导下穿刺病理结果 HE 10X。
图1. 超声引导下穿刺病理结果 HE 10X。
诊断与鉴别诊断
诊断:左乳癌(cT2N1M0,ⅡB期,Luminal B型,HER2阳性);甲状腺功能亢进症;甲状腺突眼。
诊断依据:结合患者主诉、查体及乳腺B超穿刺结果可明确诊断。
鉴别诊断:在面对乳腺区域的肿块时,进行鉴别诊断是至关重要的,以排除其他条件并确诊乳腺癌。乳腺纤维腺瘤通常表现为圆形或椭圆形、边界清晰且活动度大的肿瘤,其发展较为缓慢。浆细胞性乳腺炎则在60%的案例中呈现急性炎症特征,肿块较大时可导致皮肤呈现橘皮样改变。相反,40%的浆细胞性乳腺炎患者起初表现为慢性炎症,伴有乳晕旁边界不清的肿块,可能存在皮肤粘连和乳头凹陷,通过穿刺检查可进行鉴别。乳腺囊性增生病的特征为乳房胀痛和肿块,这些症状可呈现周期性变化,与月经周期相关。乳腺结核是由结核杆菌引起的一种慢性乳腺组织炎症,其特征是乳房内出现硬性肿块,这些肿块的边界可能不清晰,活动度受限,且可能伴有疼痛,但疼痛通常不呈现周期性变化乳腺恶性淋巴瘤则表现为迅速增大的肿块,有时可影响整个乳房,肿块可呈巨块或结节状、分叶状,边界清晰,质地坚硬且有弹性,与皮肤和乳房无粘连,穿刺检查亦可助于鉴别。相较之下,乳腺癌的诊断需要基于临床表现、影像学检查及组织病理学确认,确保准确识别与其他疾病的区别,从而制定适当的治疗方案。
治疗
在乳腺外科、肿瘤内科及内分泌科多学科团队(MDT)的综合讨论后,根据《2022年NCCN乳腺癌治疗指南》和《2022年CSCO乳腺癌治疗指南》的建议,患者被安排接受TCbHP方案的新辅助化疗共6个周期。化疗初期,即在第一周期治疗后不久,患者迅速出现了粒细胞缺乏症,中心粒细胞计数降至0.4×10×9/L,并伴有低热症状,体温达到37.8℃。对此,我们立即采取了包括短效粒细胞刺激因子提升白细胞数、使用抗生素预防感染等措施进行治疗。经过一周的积极治疗,患者的粒细胞数恢复至正常范围。为预防后续化疗周期中再次出现粒细胞缺乏,我们决定使用硫培非格司亭长效升白针进行二级预防,结果患者未再出现粒细胞缺乏的情况。
为了全面评估化疗的效果,每两个治疗周期后,我们对患者进行一次乳腺磁共振(MRI)检查。患者的肿块显著缩小,接近于完全缓解(CR)。效果如图2所示。这一积极的治疗反应不仅体现了所采用治疗方案的有效性,也突显了多学科团队在精准治疗乳腺癌中的重要作用,为患者提供了更为个性化和精确的治疗策略。
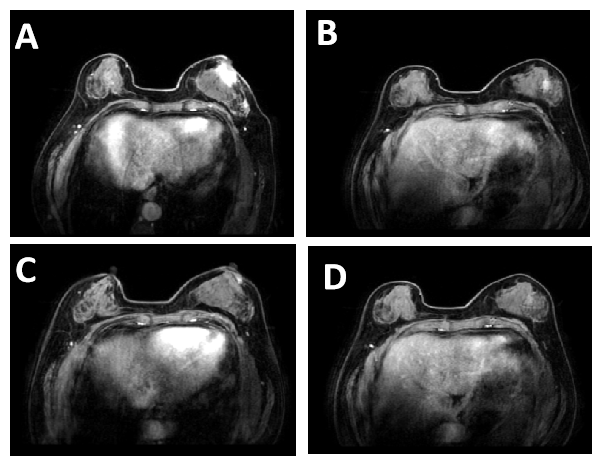
治疗结果、随访及转归
患者在顺利完成六个周期的新辅助化疗之后,接受了左侧乳腺癌改良根治术。术后病理分析显示患者达到了完全缓解(pCR),这是一项极为积极的治疗成果。为了进一步巩固治疗效果,患者随后接受了为期一年的双靶点治疗,并辅以依西美坦的内分泌治疗。术后一个半月,患者还完成了放疗,以减少复发的风险。目前,患者正处于随访期,乳腺癌相关的各项指标均保持正常,显示出肿瘤得到了有效控制和治疗。
此外,患者之前受到甲状腺功能亢进症(甲亢)导致的突眼症状也得到了良好的控制,效果如图3。甲状腺功能检查(甲功)结果显示一切正常。这一系列的治疗措施不仅成功地控制了乳腺癌的发展,同时也有效管理了患者的甲亢症状,体现了个性化医疗和多学科团队在现代癌症治疗中的重要作用。通过这样的综合治疗策略,患者的生活质量得到了显著提升,展现了当代癌症治疗的进步和希望。

讨论
本报告讨论了一例绝经后女性的乳腺癌,该病例特别之处在于患者同时伴有甲状腺功能亢进(甲亢)的情况。患者的诊断结果显示为浸润性乳腺癌Ⅱ级,并在左侧腋窝淋巴结中发现癌细胞转移。免疫组化分析结果表明,该病例属于Luminal B型 HER2阳性亚型。全身评估未发现远处转移的迹象。特别指出的是,该患者具有长达17年以上的甲状腺功能亢进(甲亢)病史,伴有明显的Graves'眼病症状。患者曾在7年前接受了放射性碘-131治疗,目前维持使用左甲状腺素钠(例如优甲乐,每日一片)进行治疗。尽管入院时患者仍有显著的突眼症状,但其甲状腺功能检测结果显示功能正常。
在内分泌科的会诊后,未发现化疗的明确禁忌症。根据先前的文献[7],曾有五例乳腺癌合并原发性甲亢患者在接受TEC方案化疗后,甲状腺功能迅速降至正常或更低水平,暗示化疗联合抗甲状腺药物可能对甲状腺功能具有显著的抑制作用。基于《2022年NCCN乳腺癌治疗指南》及《2022年CSCO乳腺癌治疗指南》[8-9]的指导,为患者安排了6个周期的TCbHP方案新辅助化疗。
甲亢是一种由于甲状腺激素过度合成和分泌引起的疾病。Graves'眼病(Graves' ophthalmopathy, GO)是甲亢的一种典型甲状腺外表现,可能导致眼睛的不适、胀痛、畏光、流泪、复视、斜视和视力下降等症状。体检可见眼球突出、眼睑后退、肿胀、结膜充血和水肿,严重时可限制眼球活动、导致眼睑闭合不全,甚至发展为角膜溃疡或全眼炎,有时还会出现与甲状腺相关的视神经病变,极端情况下可能导致失明[10]。对于合并甲状腺相关眼病的患者,甲亢的治疗主要依赖于药物[5],而粒细胞缺乏是治疗过程中常见的副作用[6]。
我们报道此病例,目的是增强对这类患者的了解,并减少化疗中不良反应的发生。该患者在接受首轮化疗后迅速出现了粒细胞缺乏,中心粒细胞计数下降至0.4×10×9/L,并伴有低热,体温达到37.8℃。通过短效粒细胞刺激因子提升白细胞数量和预防性使用抗生素等治疗措施,一周后患者的粒细胞计数恢复至正常范围。为了预防后续化疗周期中再次出现粒细胞缺乏,采用了硫培非格司亭长效升白针进行二级预防,有效避免了粒细胞缺乏的重复发生,展现了国产硫培非格司亭长效升白针在预防粒细胞减少方面的显著优势。这强调了在乳腺癌合并甲亢患者的化疗中使用长效升白针预防粒细胞缺乏的重要性。此外,患者在六轮化疗期间的甲状腺功能检查均正常,突眼症状亦有显著改善,与先前报道相似[7],这进一步证实了化疗联合抗甲状腺药物可能对甲状腺功能有较强的抑制作用。
总的来说,对于乳腺癌合并甲状腺功能亢进的患者,只要甲状腺功能得到适当控制,化疗便是安全的。我们建议在这种情况下使用长效升白针预防粒细胞缺乏症,以提高治疗的安全性和有效性。
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1] Kashyap, D., Pal, D., Sharma, R., et al. Global Increase in Breast Cancer Incidence: Risk Factors and Preventive Measures. BioMed research international, 2022, 9605439.
[2] Burstein, H. J., Curigliano, G., Thürlimann, B., et al. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Annals of oncology : official journal of the European Society for Medical Oncology, 2021,32(10), 1216–1235.
[3] Ben-Dror, J., Shalamov, M., & Sonnenblick, A. The History of Early Breast Cancer Treatment. Genes,2022,13(6), 960.
[4] Yan, J., Liu, Z., Du, S., et al. Diagnosis and Treatment of Breast Cancer in the Precision Medicine Era. Methods in molecular biology (Clifton, N.J.), 2020,2204, 53–61.
[5] Ross, D. S., Burch, H. B., Cooper, D. S., et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid : official journal of the American Thyroid Association, 2016,26(10), 1343-1421.
[6] He, Y., Li, J., Zheng, J.,et al. Emphasis on the early diagnosis of antithyroid drug-induced agranulocytosis: retrospective analysis over 16 years at one Chinese center. Journal of endocrinological investigation, 2017,40(7), 733–740.
[7] 黄剑波,汲广岩,邢雷,等.合并原发性甲亢的乳腺癌患者围术期及化疗期间甲状腺危象的防治[J].重庆医学, 2012,41(27):2.
[8] Gradishar, W. J., Moran, M. S., Abraham, J., et al. NCCN Guidelines® Insights: Breast Cancer, Version 4.2023. Journal of the National Comprehensive Cancer Network : JNCCN, 2023, 21(6), 594–608.
[9] Zhang, J., Yu, Y., Lin, Y., et al. Efficacy and safety of neoadjuvant therapy for HER2-positive early breast cancer: a network meta-analysis. Therapeutic advances in medical oncology, 2021, 13, 17588359211006948.
[10] González-García, A., & Sales-Sanz, M. Treatment of Graves' ophthalmopathy.. Medicina clinica, 2021, 156(4), 180–186.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


