整理:肿瘤资讯
来源:肿瘤资讯
病例点评:中国人民解放军总医院 第一医学中心 吴欣教授
本文介绍一例KIT外显子11突变的胃间质瘤病例,初诊肿瘤直径大约12 cm,且与脾脏、胰腺关系密切,直接手术联合脏器切除风险较大。伊马替尼治疗5个月时,肿瘤最大径缩小为8 cm,较上次CT检查变化不大,直接手术仍面临多器官切除的风险。后经MDT讨论以及与患者及家属充分沟通后,换用瑞派替尼,肿瘤进一步显著缩小,瑞派替尼治疗7个月后,肿瘤最大径从8 cm缩小至4.4 cm,缩瘤达45%,最终实施了R0手术切除并保留了受累器官且术后无并发症发生。本病例提示,对于伊马替尼新辅助治疗达瓶颈期的胃肠间质瘤患者,尤其是KIT外显子11突变的患者,瑞派替尼可能会提供进一步缩瘤的机会。本病例提供了有力的证据,支持瑞派替尼在术前新辅助治疗中的潜在价值,为临床实践提供了新思路。
专家简介

吴欣 教授
中国人民解放军总医院第一医学中心
普外科医学部
副主任医师
中国医师协会微无创医学专业委员会委员
中国医师协会胃肠道间质瘤专业委员会委员
中国抗癌协会胃肠间质瘤专业委员会委员
中国临床肿瘤学会胃肠间质瘤专家委员会委员
中国人民解放军转化医学专业委员会委员
中国人民解放军胃肠间质瘤专业委员会常委
中国医疗保健国际交流促进会临床实用技术分会委员
曾获全军科技进步二等奖,先后承担国家自然科学基金、军队科研基金等多项。发表SCI论文多篇。
病例点评
吴欣教授点评
病例简介
基本情况
女性,42岁,2024年2月因胃占位就诊于当地医院, CT 发现胃脾之间软组织肿块,大小约12 cm ×10 cm,密度混杂,胰腺后移受压,考虑胃间质瘤可能性大,建议手术,告知其有切除脾脏、胰腺等脏器的风险,患者无法接受,因此医生建议其行胃镜下穿刺病理。
2024年2月穿刺病理显示,胃梭形细胞,免疫组化结果:CD34(脉管+)、CD117(+)、DOG-1(+)、Ki-67(index 8%)、S-100(-)、SMA(-)、SDHB(+)、Desmin(-),符合胃肠间质瘤(GIST)。基因检测提示KIT 11外显子缺失突变。
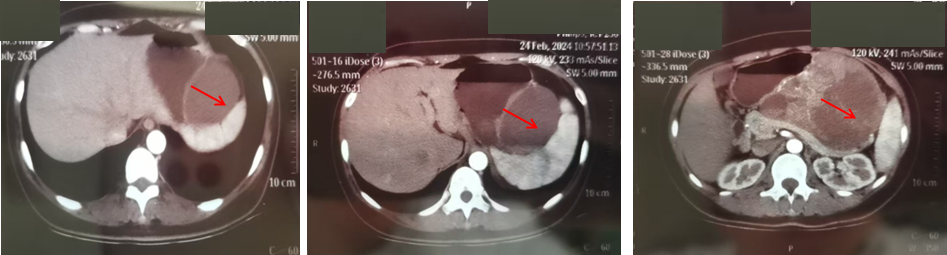
2024年2月CT(治疗前基线)
治疗经过
伊马替尼新辅助治疗(2024年2月至2024年8月)
当地医院考虑到患者面临联合脏器切除、难以达到R0切除的风险, 2024年2月,予口服甲磺酸伊马替尼400 mg QD治疗。
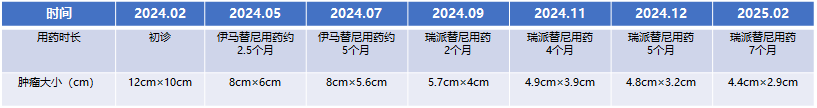
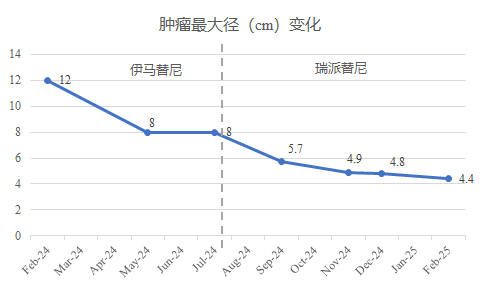
2024年5月,伊马替尼治疗约2.5个月,复查腹部CT,显示肿瘤明显缩小,截面大小约8 cm × 6 cm,疗效部分缓解(PR);
2024年7月,伊马替尼治疗约5个月,复查腹部CT,显示肿瘤较上次变化不大,截面大小约8 cm× 5.6 cm;当地医院建议其手术,但是仍存在损伤、切除胰腺的可能,患者就诊我院寻求有无其他可降低手术风险的治疗方法。

2024年7月CT(伊马替尼治疗约5个月)
瑞派替尼新辅助治疗(2024年8月至2025年2月)
患者于2024年8月就诊于我院,评估手术,切除范围较大,且可能涉及联合脏器切除,MDT后建议选择有效的TKI治疗以进一步缩小肿瘤,经与患者充分沟通知情同意,患者于2024年8月开始服用瑞派替尼150mg QD治疗,患者耐受性好,后每月规律随诊。
2024年9月,瑞派替尼治疗近2个月,复查腹部CT,显示肿瘤缩小至 5.7 cm × 4.0 cm,疗效接近PR;
2024年11月,瑞派替尼治疗近4个月,复查腹部CT,显示肿瘤缩小至 4.9 cm × 3.9 cm,疗效达到PR;
2024年12月,瑞派替尼治疗近5个月,复查腹部CT,显示肿瘤持续缩小至4.8 cm × 3.2 cm,实性肿块影,密度较均匀,CT值约 37HU,病变前下缘局部密度稍高,增强扫描各期强化不明确,建议患者手术。
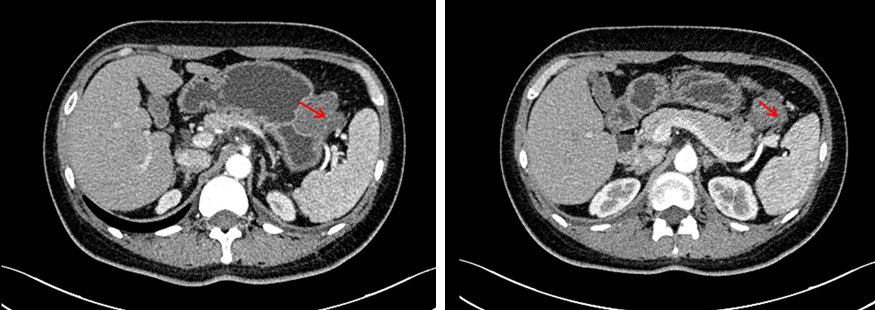
2024-12 CT(瑞派替尼治疗近5个月)
2025年1月,因患者室早需心内科行手术治疗,要求继续服药并于心内科住院治疗。
2025年2月,复查腹部CT,显示肿瘤持续缩小至4.4 cm × 2.9 cm,实性肿块影,密度较均匀,CT值约30HU,病变前下缘局部密度稍高,增强扫描各期强化不明确,较前大致相仿。
2025年2月27日,腹腔镜探查、3D腹腔镜辅助下胃间质瘤切除术。肿瘤位于胃体大弯侧的侧后壁,腔内外型生长,大小约5 cm ×4 cm × 4 cm,包膜完整,与周围组织脏器粘连较重。紧邻胃大弯离断网膜,逐步暴露肿瘤所在的大弯侧,可见肿瘤退缩后的纤维膜与脾脏及胰尾粘连紧密。仔细分离大弯侧,将肿瘤与脾脏和胰尾逐步分离,见数根肿瘤供血血管,依次结扎,暴露肿瘤根部,应用切割闭合器切断部分胃壁。术后9天出院,无术后并发症。
术后病理:(胃间质瘤新辅助治疗后)胃黏膜下梭形细胞肿瘤,伴大片玻璃样变性及坏死,大部分肿瘤细胞退变显著,结合病史及免疫组化结果,符合胃肠间质瘤(GIST)。吻合钉切缘未见肿瘤 (R0切除)。
患者新辅助治疗期间CT显示的肿瘤变化
辅助治疗
基于初诊肿瘤较大(12 cm ×10 cm),新辅助治疗后达到R0切除,综合考虑目前的循证医学证据,患者术后选用伊马替尼治疗。目前定期随访中。
专家点评
吴欣教授:
手术是原发可切除胃肠间质瘤患者的首选治疗,特殊情况下,需考虑新辅助治疗。NCCN和CSCO胃肠间质瘤指南均指出,术前评估预期肿瘤难以达到R0切除、需联合脏器切除、可完整切除但手术风险较大者,应考虑新辅助治疗。新辅助治疗可提高局限进展期GIST患者的手术切除率,保存器官功能[1]。多项研究也表明,新辅助治疗可以给局晚期GIST患者带来长期生存获益[2-4]。各项研究提示,伊马替尼新辅助治疗,客观缓解(ORR)率为43%~80%,R0切除率为36%~100%[2-9],提示仍存在伊马替尼不敏感或疗效有限的患者,难以满足手术需求。后续如何选择更有效的药物,也是困扰临床的一个问题。
他山之石,可以攻玉。免疫新辅助治疗在胃癌中的发展路径体现了从“末线挽救”到“前线治愈”的策略转变。免疫抑制剂最初获批用于晚期/转移性胃癌的三线或后线治疗,CheckMate 649研究首次确立了免疫治疗+化疗在中国晚期胃癌一线治疗中的标准地位。目前,免疫新辅助治疗的研究也在逐步推进,从小规模试验到MATTERHORN III期研究取得阳性结果,推动了免疫治疗在胃癌新辅助阶段的应用。
目前GIST新辅助治疗的药物选择有限。瑞派替尼是新型的开关控制抑制剂,可广泛地抑制KIT/PDGFRA各种原发和继发突变类型[10]。在晚期GIST患者中显示出良好的疗效和安全性,已获批用于晚期胃肠间质瘤四线及以上治疗[11, 12]。全球Ⅲ期INTRIGUE研究显示[13],在伊马替尼治疗进展或不耐受的GIST患者中,瑞派替尼与舒尼替尼疗效相当,在携带KIT外显子11突变的患者中,瑞派替尼在中位无进展生存期(mPFS)方面呈现改善趋势,且ORR显著高于舒尼替尼(23.9% vs 14.6%)。此外,瑞派替尼的安全性更佳。同时,中国二线研究显示,瑞派替尼为KIT外显子11突变的人群带来显著生存获益,瑞派替尼组mPFS优于舒尼替尼组(独立影像评估NR vs 4.9个月, HR=0.46;研究者评估结果:13.8 vs 7.0个月, HR=0.55)[14];长期随访数据显示[15],在KIT外显子11突变人群中,瑞派替尼组总生存期(OS)获益优于舒尼替尼组,瑞派替尼组42个月OS率达59.3% ,舒尼替尼组为39.8%,且ORR更高(37% vs 22.9%)。目前CSCO 胃肠间质瘤诊疗指南I级推荐瑞派替尼用于伊马替尼标准剂量失败后的原发KIT外显子11突变型GIST患者的二线治疗。因此,对于伊马替尼治疗进展或不耐受的GIST患者,尤其是KIT外显子11突变的患者,瑞派替尼可能提供进一步缩瘤的机会。目前,瑞派替尼在新辅助治疗中的应用尚未得到充分探索。既往有病例报道显示[16],一例KIT 11原发突变的胃GIST,初诊肿瘤直径大于10 cm,且与胰腺、脾脏关系密切,直接手术联合脏器切除风险较大,肿瘤在14个月的伊马替尼新辅助治疗后反应甚微,面临多器官切除的风险。转用瑞派替尼治疗8个月后,最大肿瘤直径减少了26%,最终实现了R0切除并保留了受累器官。在本病例中,虽然伊马替尼治疗2.5个月时,疗效显著,但治疗5个月时,肿瘤缩小较上次变化不大,直接手术仍面临多器官切除的风险。换用瑞派替尼后,肿瘤进一步显著缩小,瑞派替尼治疗7个月后,肿瘤最大径从8 cm缩小至4.4 cm,缩瘤达45%,最终实施了R0手术切除并保留了受累器官。术后无并发症。瑞派替尼显示出总体良好的安全性。
本病例表明,对于伊马替尼新辅助治疗达瓶颈期的GIST患者,尤其是KIT 外显子11突变的患者,瑞派替尼可能会提供进一步缩瘤的机会。本病例提供了有力的证据,支持瑞派替尼在术前新辅助治疗中的潜在价值,为临床实践提供了新的思路。
参考文献:
[1]中国临床肿瘤学会指南工作委员会组织编写. 中国临床肿瘤学会(CSCO)胃肠间质瘤诊疗指南. 人民卫生出版社 2024.
[2]Blesius A, Cassier PA, Bertucci F et al. Neoadjuvant imatinib in patients with locally advanced non metastatic GIST in the prospective BFR14 trial. BMC Cancer 2011; 11: 72.
[3] Rutkowski P, Gronchi A, Hohenberger P et al. Neoadjuvant imatinib in locally advanced gastrointestinal stromal tumors (GIST): the EORTC STBSG experience. Ann Surg Oncol 2013; 20 (9): 2937-2943.
[4]Tielen R, Verhoef C, van Coevorden F et al. Surgical treatment of locally advanced, non-metastatic, gastrointestinal stromal tumours after treatment with imatinib. Eur J Surg Oncol 2013; 39 (2): 150-155.
[5]Fiore M, Palassini E, Fumagalli E et al. Preoperative imatinib mesylate for unresectable or locally advanced primary gastrointestinal stromal tumors (GIST). Eur J Surg Oncol 2009; 35 (7): 739-745.
[6]Kurokawa Y, Yang HK, Cho H et al. Phase II study of neoadjuvant imatinib in large gastrointestinal stromal tumours of the stomach. Br J Cancer 2017; 117 (1): 25-32.
[7]Reichardt P. The Story of Imatinib in GIST - a Journey through the Development of a Targeted Therapy. Oncol Res Treat 2018; 41 (7-8): 472-477.
[8]Eisenberg BL, Harris J, Blanke CD et al. Phase II trial of neoadjuvant/adjuvant imatinib mesylate (IM) for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumor (GIST): early results of RTOG 0132/ACRIN 6665. J Surg Oncol 2009; 99 (1): 42-47.
[9]Wang D, Zhang Q, Blanke CD et al. Phase II trial of neoadjuvant/adjuvant imatinib mesylate for advanced primary and metastatic/recurrent operable gastrointestinal stromal tumors: long-term follow-up results of Radiation Therapy Oncology Group 0132. Ann Surg Oncol 2012; 19 (4): 1074-1080.
[10]Smith BD, Kaufman MD, Lu WP et al. Ripretinib (DCC-2618) Is a Switch Control Kinase Inhibitor of a Broad Spectrum of Oncogenic and Drug-Resistant KIT and PDGFRA Variants. Cancer Cell 2019; 35 (5): 738-751.e739.
[11]Blay JY, Serrano C, Heinrich MC et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21 (7): 923-934.
[12]Li J, Cai S, Zhou Y et al. Efficacy and Safety of Ripretinib in Chinese Patients with Advanced Gastrointestinal Stromal Tumors as a Fourth- or Later-Line Therapy: A Multicenter, Single-Arm, Open-Label Phase II Study. Clin Cancer Res 2022; 28 (16): 3425-3432.
[13]Bauer S, Jones RL, Blay JY et al. Ripretinib Versus Sunitinib in Patients With Advanced Gastrointestinal Stromal Tumor After Treatment With Imatinib (INTRIGUE): A Randomized, Open-Label, Phase III Trial. J Clin Oncol 2022; 40 (34): 3918-3928.
[14]Li J, Zhang J, Zhang Y et al. Efficacy and safety of ripretinib vs. sunitinib in patients with advanced gastrointestinal stromal tumor previously treated with imatinib: A phase 2, multicenter, randomized, open-label study in China. European Journal of Cancer 2024; 196: 113439.
[15]Li J, Zhang J, Zhang Y et al. 1759P Long-term updated outcomes of a phase II study of ripretinib vs. sunitinib in chinese patients with advanced gastrointestinal stromal tumor. Annals of Oncology 2024; 35: S1048.
[16]Liu G, Zheng Z, Li J et al. Case Report: Neoadjuvant therapy with ripretinib for gastrointestinal stromal tumor: a case report. Front Pharmacol 2025; 16: 1573610.
*以上信息涉及尚未在中国获批的产品/适应症。此信息仅作信息分享用途,不应被理解为这些产品/适应症在中国获批或注册。
相关文章回顾(点击可查看详情):
排版编辑:yu













 苏公网安备32059002004080号
苏公网安备32059002004080号


