本病例报告详细阐述了一例胰腺神经内分泌肿瘤伴肝脏广泛转移患者的诊断、多学科诊疗过程及长期随访结果,重点描述了替莫唑胺治疗后诱导肿瘤突变负荷升高的现象及对后续治疗策略的影响,并探讨了适时病理及PET/CT再评估的重要性。
患者基本情况
患者为一名55岁男性,于2018年3月在外院体检,腹部B超检查提示胰头占位和肝转移瘤。随后在外院行胰腺占位穿刺活检,病理诊断为神经内分泌瘤。患者于2018年7月在另一家医院接受了胰十二指肠切除术、肝脏部分切除术及腹腔淋巴结清扫术。术后病理提示神经内分泌肿瘤G2级。同期进行了二代测序(NGS)及免疫治疗标志物检测,结果显示PD-1表达阴性,肿瘤突变负荷(TMB)约为8.8。
随后患者在广州中山一院行68Ga-SSA-PET/CT检查,提示肿瘤生长抑素受体(SSTR)高表达。随后患者开始接受长效奥曲肽30 mg每4周一次的治疗,并针对肝转移瘤进行了多次TAE介入治疗,该方案维持了约两年时间。

疾病进展与治疗方案调整
2020年11月,外院CT提示肝内肿瘤增多增大。患者采取了奥曲肽增量策略,剂量增加至60mg/4周,并再次行TAE治疗。

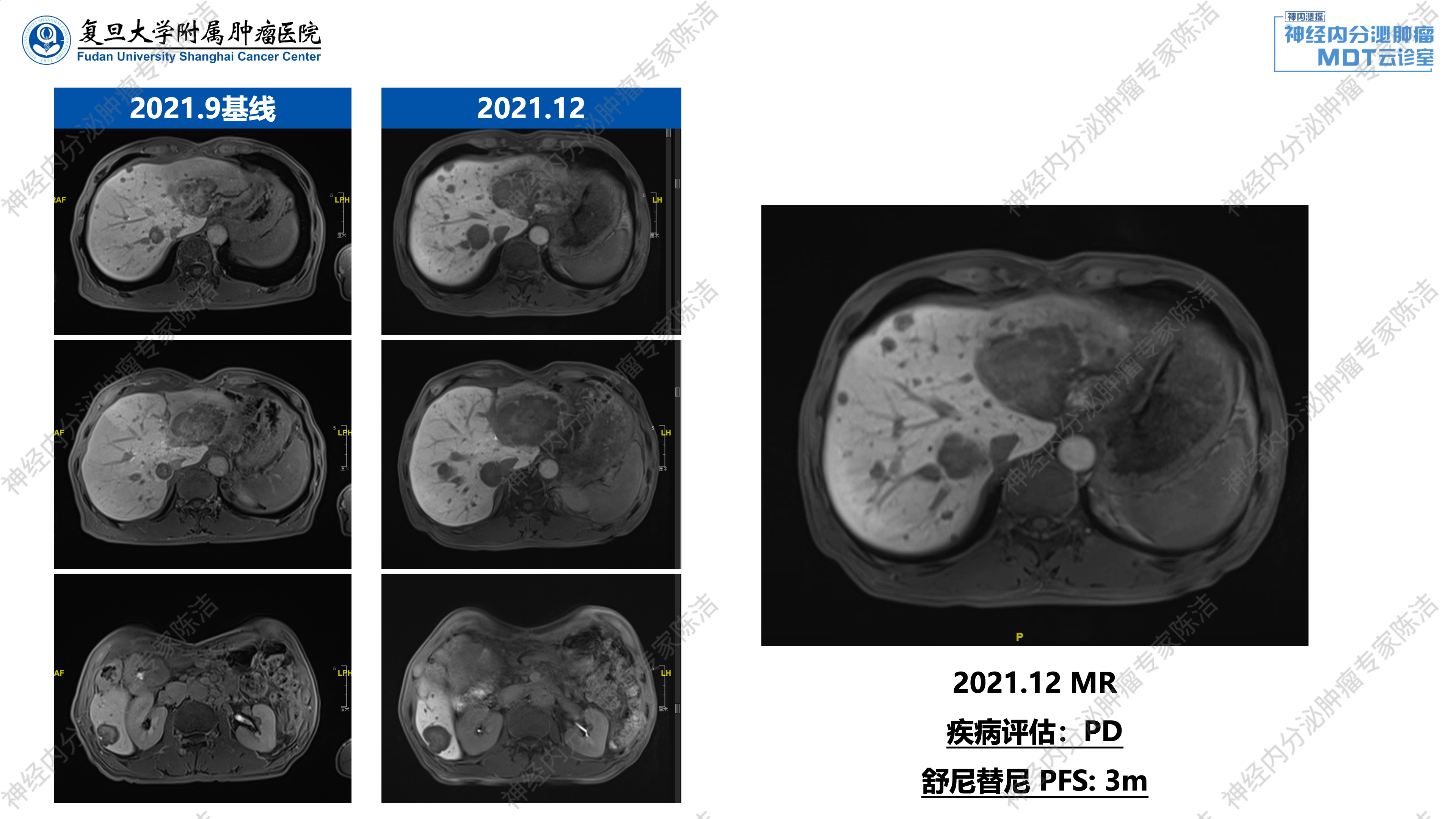
2021年9月,患者至我院就诊。入院后进行了我院的基线CT和磁共振评估:患者为胰腺NET伴肝转移瘤术后,肝脏内仍有大小不等、富血供占位,负荷不小。其中肝右叶有一较大病灶,其余分散于两叶,呈散在富血供转移,整体肿瘤负荷约为35%~40%。

基于上述评估,患者开始接受舒尼替尼靶向治疗。然而,仅3个月后(2021年12月),复查影像显示肝脏内转移瘤进一步增大,尤其肝左叶病灶增大明显,肿瘤评估为疾病进展(PD)。此次舒尼替尼治疗的无进展生存期(PFS)仅约3个月。
多线治疗与疗效评估
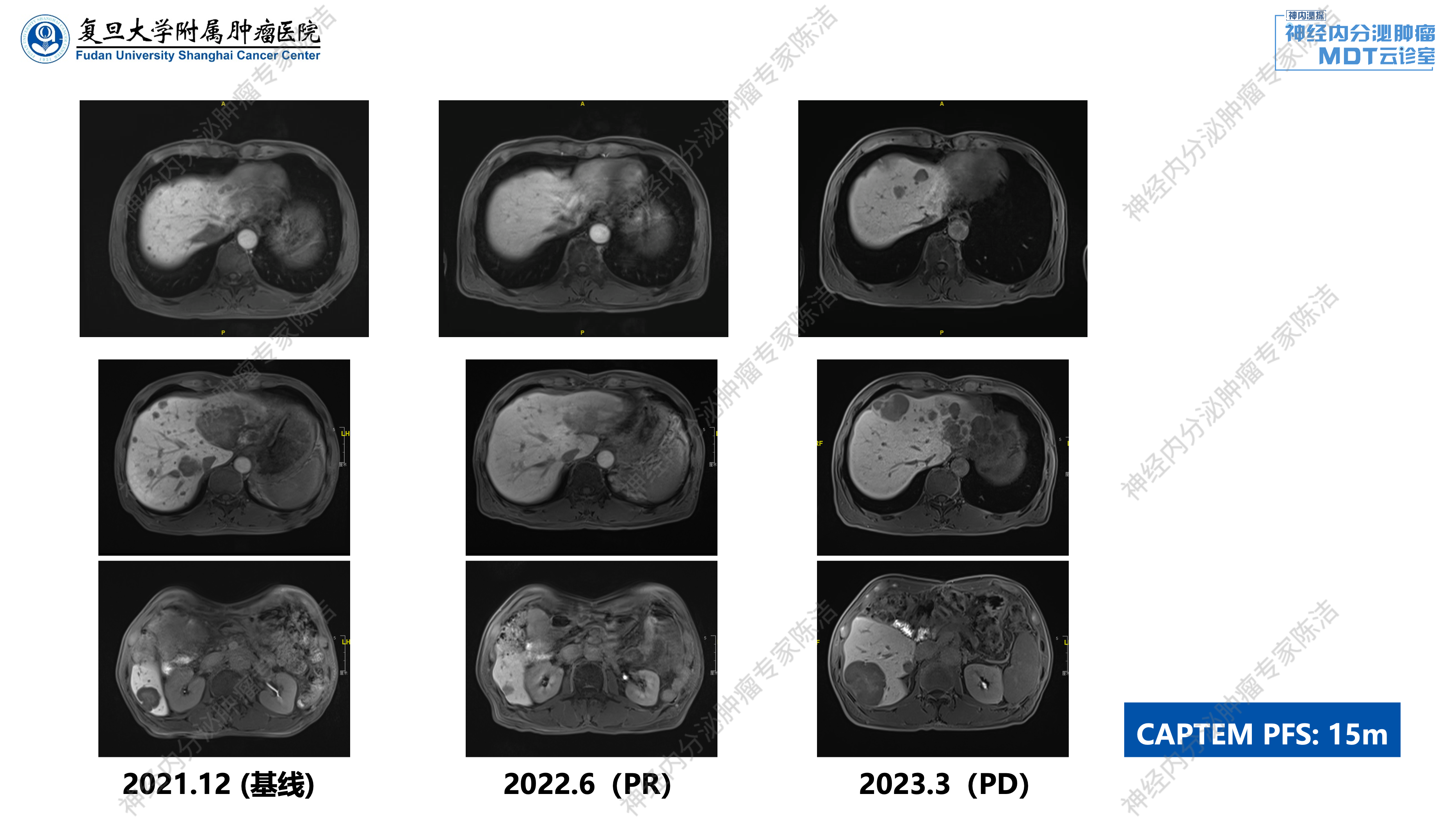
鉴于疾病快速进展,2021年12月开始,将治疗方案调整为卡培他滨联合替莫唑胺(CAPTEM)化疗。2022年6月复查:肝脏转移瘤明显退缩,肝内较大肿瘤显著缩小,评估为PR(部分缓解)。2022年10月复查:肿瘤持续缩小,评估为缩小的SD。2023年3月复查提示肿瘤出现进展,部分病灶反弹增大,甚至超过基线大小,评估为PD。CAPTEM化疗的PFS约为15个月。
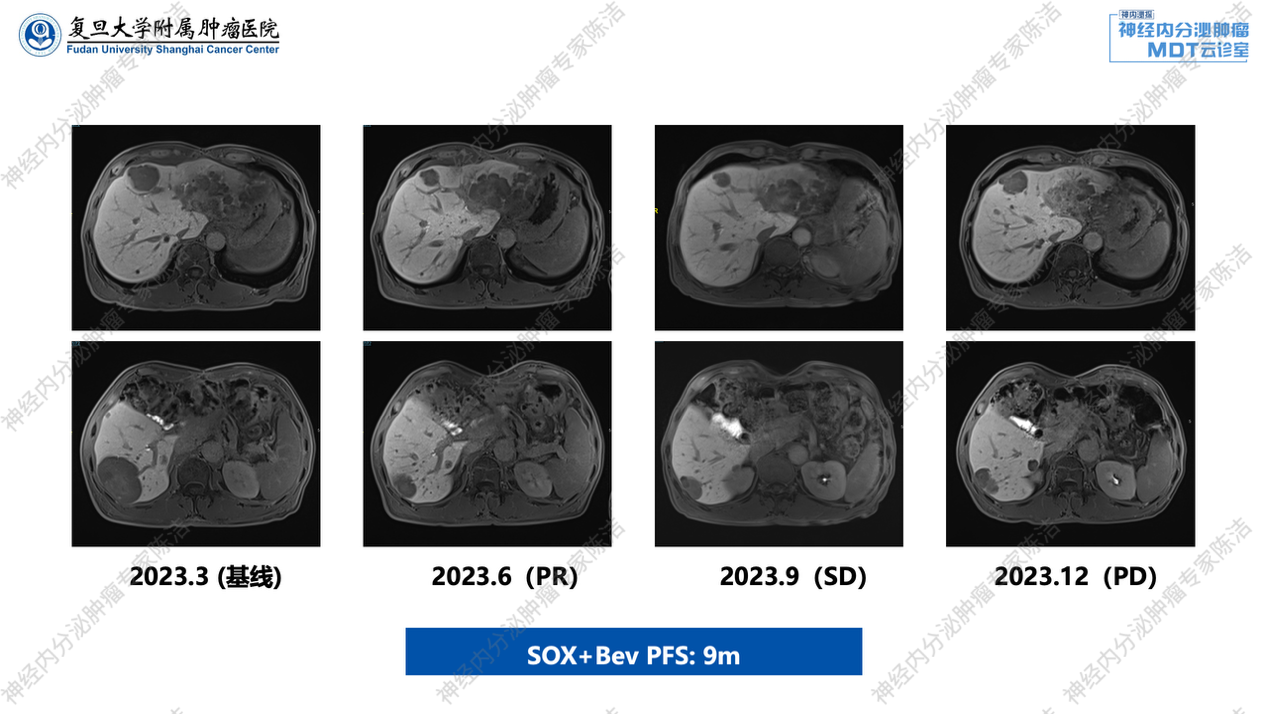
随后,我院建议患者接受FOLFOX化疗联合贝伐珠单抗治疗,患者返回当地医院后,实际采取的方案为奥沙利铂+替吉奥(SOX方案)化疗,联合贝伐珠单抗。2023年6月返院复查,肿瘤体积明显缩小,评估为PR。继续原方案治疗,2023年9月复查提示,肿瘤进一步缩小,评估为缩小的SD。但是,2023年12月复查提示,肿瘤出现反弹,并出现新的小散分布病灶,评估为PD。此次治疗的PFS约为9个月。
再次活检与免疫治疗探索
考虑到疾病进展快,2023年12月为患者重新进行了肝穿刺活检,病理与NGS基因检测结果:转移病灶穿刺显示上皮标记和神经内分泌标记(Syn、CgA、INSM1)均为阳性,SSTR2呈强阳性(3+)表达。Ki-67增殖活性上升至15%。免疫组化显示MGMT缺失表达。基因检测PD-L1表达无明显增加,但TMB较上次(8.8)显著增加至276,同时,肿瘤浸润CD8阳性T细胞密度较高。

基于TMB显著升高,尝试使用了阿得贝利单抗单药免疫治疗。然而,2024年5月复查提示,肿瘤出现明显进展,评估为PD。阿得贝利单抗免疫治疗的PFS仅约5个月。

PET/CT双扫描评估及肝移植
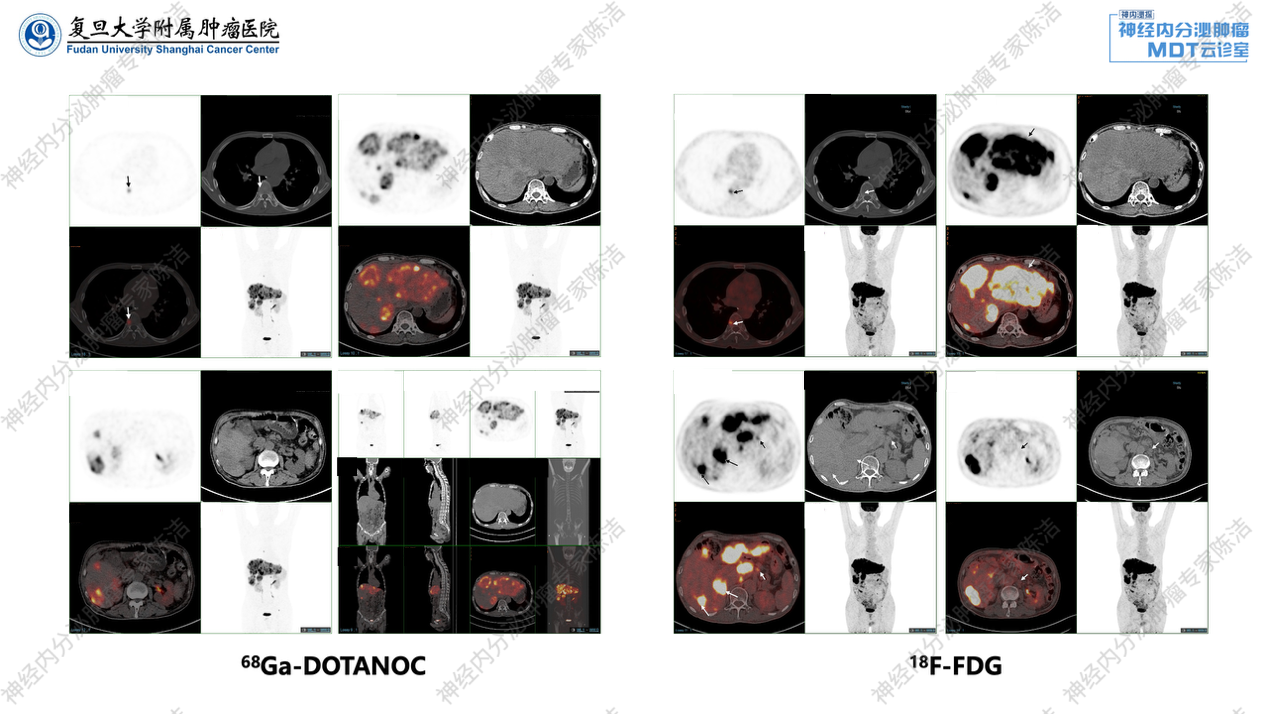
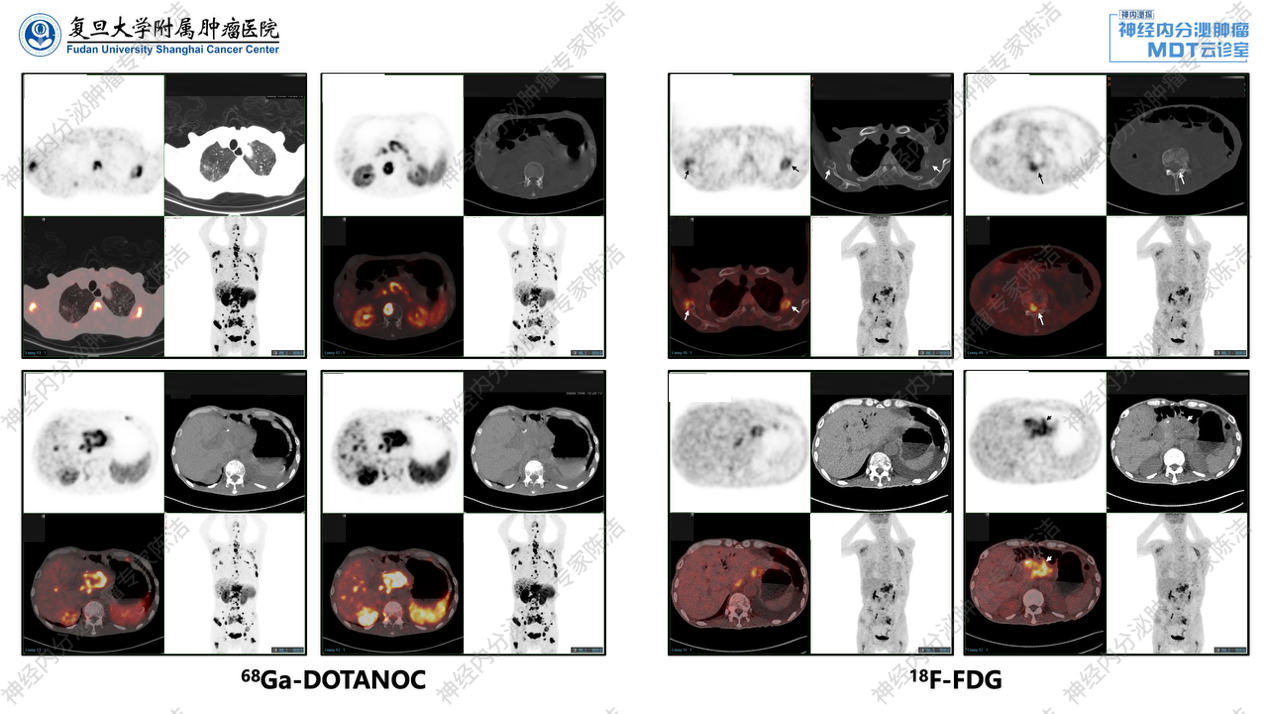
考虑肿瘤仍在快速进展,予完善PET/CT双扫描评估,结果提示:在SSTR表达方面,肝脏内多发转移灶,包括肝左叶的巨大病灶和肝右叶散在的病灶,均呈现出显著的SSTR高表达。此外,腹膜后散在的转移性淋巴结也显示SSTR高表达。在FDG糖代谢方面,这些病灶亦表现出FDG高糖代谢,特别是肝左叶的巨块型肿瘤,其糖代谢明显增高。68Ga-DOTANOC PET/CT还显示椎体局部存在一处小灶性椎弓 SSTR高表达的转移,但整体骨转移负荷较低,主要病灶负荷集中于肝脏转移。
由于肝内肿瘤进展迅速且负荷较大,患者于2024年5月在外院接受了肝移植手术。术后进行他克莫司抗排异治疗,并对骨转移病灶进行了放疗。

肝移植术后病理与影像再评估
2024年11月,患者返回我院复诊,并对肝移植切除的完整肿瘤标本进行了病理会诊。结果显示肿瘤类型仍为神经内分泌瘤,但Ki-67增殖活性进一步上升至25%。P53表达无明显改变(少量阳性,考虑仍为野生型),但RB1有部分缺失,提示肿瘤生物学行为可能更具侵袭性。SSTR2表达仍为强阳性(3+)。

同期,患者进行了PET/CT双扫描,对全身肿瘤负荷再评估。移植后出现肝弥漫小散转移,同时,出现较多新发骨转移病灶,SSTR表达强阳性,大部分骨转移灶FDG代谢不高,但部分散在小病灶存在FDG高代谢,提示存在肿瘤内异质性。
目前患者使用奥曲肽60 mg/4周及地舒单抗120mg/4周进行维持治疗。
MDT讨论
黄丹教授:该患者的病理类型为高分化神经内分泌瘤,治疗过程中的多次活检及术后病理提示,肿瘤在治疗过程中存在异质性及肿瘤发展。一方面,肿瘤增殖活性逐渐增高,Ki-67指数从最初的8%,逐渐上升至25%,提示肿瘤级别进一步升高,肝移植术后病理还提示了肿瘤细胞存在部分RB1缺失。另一方面,肿瘤突变负荷在CAPTEM等方案治疗后出现了明显的上升。这些变化体现了神经内分泌瘤在治疗过程中不断发展进化,适时进行病理再评估十分必要。
徐俊彦教授:该患者基线及后续多次生长抑素受体PET/CT显示肿瘤SSTR高表达,为长效奥曲肽治疗奠定了基础。在患者免疫治疗失败后,双扫描PET/CT评估揭示了肝内多发转移灶、腹膜后淋巴结及骨转移灶均呈现SSTR高表达,同时伴有FDG高代谢,呈现“双高”特征,提示肿瘤级别相对较高。特别是肝左叶巨块型肿瘤的明显FDG高代谢,进一步印证了肿瘤的侵袭性。肝移植术后的再次双扫描PET/CT评估,则确认了新发转移灶SSTR仍高表达,而FDG代谢普遍不高,为未来PRRT治疗的入组提供了影像学支持。总之,通过PET/CT动态评估肿瘤的SSTR表达和糖代谢情况,为判断肿瘤生物学行为、评估级别进展、调整药物治疗乃至规划PRRT治疗,提供了重要的核医学证据。
汤伟教授:该患者我院基线影像清晰显示胰腺NET术后,肝脏内多发富血供占位及较高的肿瘤负荷。在舒尼替尼治疗期间,影像提示肿瘤进展。随后,CAPTEM化疗方案使肝脏转移瘤显著退缩,达到部分缓解(PR),但约15个月后再次进展。更换为SOX联合贝伐珠单抗方案后,影像再次显示肿瘤缩小并稳定,达到PR,但约9个月后再次进展。总的来说,影像学评估动态反映了肿瘤对多线系统治疗和局部介入治疗的反应,清晰地呈现了疾病的进展与缓解,并为临床判断治疗效果和调整方案提供了直观的影像学依据。
陈洁教授总结

该病例呈现了一例胰腺神经内分泌肿瘤伴肝脏广泛转移的病例,其疾病进程复杂且治疗具有较高挑战性。患者的诊疗历程长达七年,期间综合运用了手术、介入治疗、多线全身治疗以及肝移植。诊疗团队在治疗过程中不断探索,先后采用了长效奥曲肽增量、抗血管生成靶向药物、以及两线化疗方案。值得注意的是,在多线治疗进展后,患者通过二次活检发现肿瘤级别升高且TMB显著升高。尽管TMB显著升高,单药免疫治疗的PFS仅约5个月,这提示并非所有烷化剂诱导的高TMB患者都能从免疫治疗中显著获益,且在分化好的神经内分泌瘤中,免疫检查点抑制剂联合其他药物(如TKI或化疗)也未显示出1+1>2的效果。
患者在两线化疗进展后,重新评估的双扫描PET/CT提示肝内肿瘤负荷大,且糖代谢活跃,考虑到药物治疗已无太多选择,且肝外病灶较少,患者积极寻求并成功接受了肝移植。这种超越米兰标准的肝移植是否能使患者获益,在当时很难有定论,而在移植术半年后返院再次评估的双扫描PET/CT可以发现,患者骨转移出现明显进展,肝脏出现小散转移。尽管如此,患者全身肿瘤仍高表达SSTR,且糖代谢活跃的病灶,尤其是肝转移病灶,较移植术前明显减少,这为后续重新使用生长抑素类似物,乃至PRRT,提供了可能。而这一系列措施,也有望进一步提升患者的总生存。
该病例的诊疗经验为管理伴有快速进展、高肿瘤负荷和级别升高的胰腺神经内分泌肿瘤提供了宝贵启示,也证实了适时进行病理和功能影像的再评估,对于理解肿瘤进展及指导治疗方案选择的重要性。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-烷化剂(替莫唑胺)治疗专场回放:
https://doctor.liangyihui.net/#/doc/147423

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


