在全球瞩目的2025美国临床肿瘤学会(ASCO)年会上,来自日本国立癌症中心东医院的Kohei Shitara教授以口头报告形式,重磅发布了全球III期DESTINY-Gastric04研究(LBA4002)的最新结果。该研究旨在评估德曲妥珠单抗(T-DXd)对比雷莫西尤单抗联合紫杉醇(Ram-Pac)在HER2阳性不可切除或转移性胃癌/胃食管结合部腺癌(GC/GEJC)二线治疗中的疗效与安全性。研究结果显示,T-DXd显著改善了患者的总生存期(OS),无进展生存期(PFS)和客观缓解率(ORR)也均有显著提高。该研究结果也同步发表于《新英格兰医学杂志》(NEJM),为T-DXd在全球范围内成为HER2阳性胃癌/GEJC二线治疗的新标准奠定了坚实基础。【肿瘤资讯】特此整理要点,以飨读者。
 胃癌和胃食管结合部腺癌患者中约有15%为HER2阳性,通常定义为IHC 3+或IHC 2+伴ISH阳性。大多数患者在一线基于曲妥珠单抗的化疗后会经历疾病进展,需要进一步的治疗。虽然T-DXd作为一种抗HER2抗体偶联药物(ADC),在日本和韩国进行的DESTINY-Gastric01试验中,在三线或更晚线治疗中对比化疗显著改善了OS。随后的单臂DESTINY-Gastric02研究也显示,T-DXd在非亚洲人群二线治疗中表现出相似的活性,这促使T-DXd在多个国家获得监管批准。然而,目前尚未有随机研究将T-DXd与雷莫西尤单抗联合紫杉醇(Ram-Pac)进行比较,后者是另一种全球范围内广泛使用的二线治疗方案,无论HER2状态如何。
胃癌和胃食管结合部腺癌患者中约有15%为HER2阳性,通常定义为IHC 3+或IHC 2+伴ISH阳性。大多数患者在一线基于曲妥珠单抗的化疗后会经历疾病进展,需要进一步的治疗。虽然T-DXd作为一种抗HER2抗体偶联药物(ADC),在日本和韩国进行的DESTINY-Gastric01试验中,在三线或更晚线治疗中对比化疗显著改善了OS。随后的单臂DESTINY-Gastric02研究也显示,T-DXd在非亚洲人群二线治疗中表现出相似的活性,这促使T-DXd在多个国家获得监管批准。然而,目前尚未有随机研究将T-DXd与雷莫西尤单抗联合紫杉醇(Ram-Pac)进行比较,后者是另一种全球范围内广泛使用的二线治疗方案,无论HER2状态如何。
因此,DESTINY-Gastric04研究作为一项全球性、随机、开放标签的III期临床试验,旨在直接比较T-DXd与Ram-Pac在HER2阳性GC/GEJC二线治疗中的疗效和安全性。
研究设计与终点
该研究共筛选了1000余名患者,最终有494名符合条件的HER2阳性GC/GEJC患者被随机分配至两组:试验组接受T-DXd(6.4 mg/kg,每三周一次),对照组接受Ram-Pac。入组患者必须在一线德曲妥珠单抗治疗后出现疾病进展,并进行中心或局部HER2状态再活检确认。研究期间不计划交叉治疗,但患者在研究治疗结束后可接受医生选择的后续治疗(图1)。
随机化分层因素包括HER2状态(IHC 3+ vs. IHC 2+/ISH+)、地理区域(亚洲 vs. 非亚洲)以及一线治疗的无进展生存期(TTP)。
主要终点:总生存期(OS)。
次要终点:研究者评估的无进展生存期(PFS)、确认的客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)和安全性。患者报告结局(PROs)作为探索性终点进行评估。
研究计划招募490名患者,以观察339个OS事件,并预期OS的风险比(HR)为0.70。在完成入组和发生237个OS事件(对应70%计划OS事件)后进行了一次中期分析。数据截止日期为2024年10月,中期分析的OS显著性阈值为P值0.0228。

T-DXd显著延长OS,刷新二线治疗最长中位生存期
主要终点OS:显著改善,长期获益显现
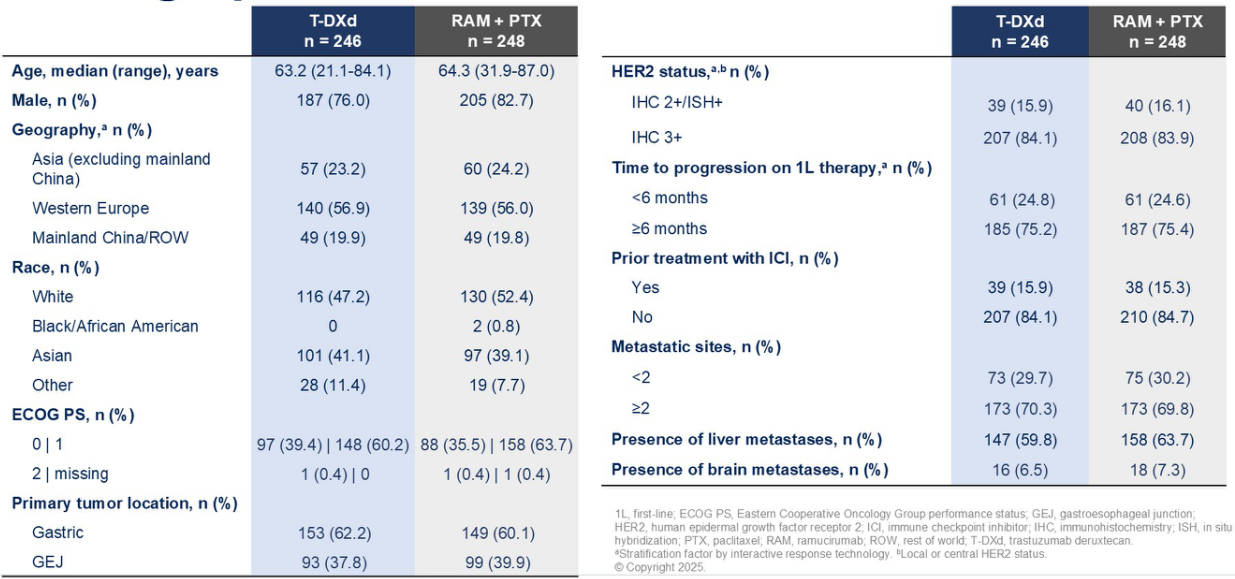
截至数据截止,两组约有18%的患者仍在接受治疗。基线特征在两组间平衡良好,其中约40%为亚洲患者,超过80%的患者为IHC 3+,约15%的患者曾接受过既往的免疫检查点抑制剂治疗(图2)。
在研究治疗结束后,约半数患者接受了后续抗癌治疗。Ram-Pac组接受后续抗癌治疗的患者更多,其中21%的患者接受了T-DXd治疗。
OS结果显示,T-DXd组的生存曲线从早期就开始分离,且这种差异在整个随访期间得以维持。T-DXd组的中位OS为14.7个月,而Ram-Pac组为11.4个月,T-DXd组延长了3.3个月(图3)。Kohei Shitara教授强调,这可能是全球二线III期研究中观察到的最长的中位生存期。OS的风险比(HR)为0.70,P=0.0044,低于预设的显著性阈值(0.0228)。因此,本研究达到了主要终点,显示T-DXd显著改善了OS。
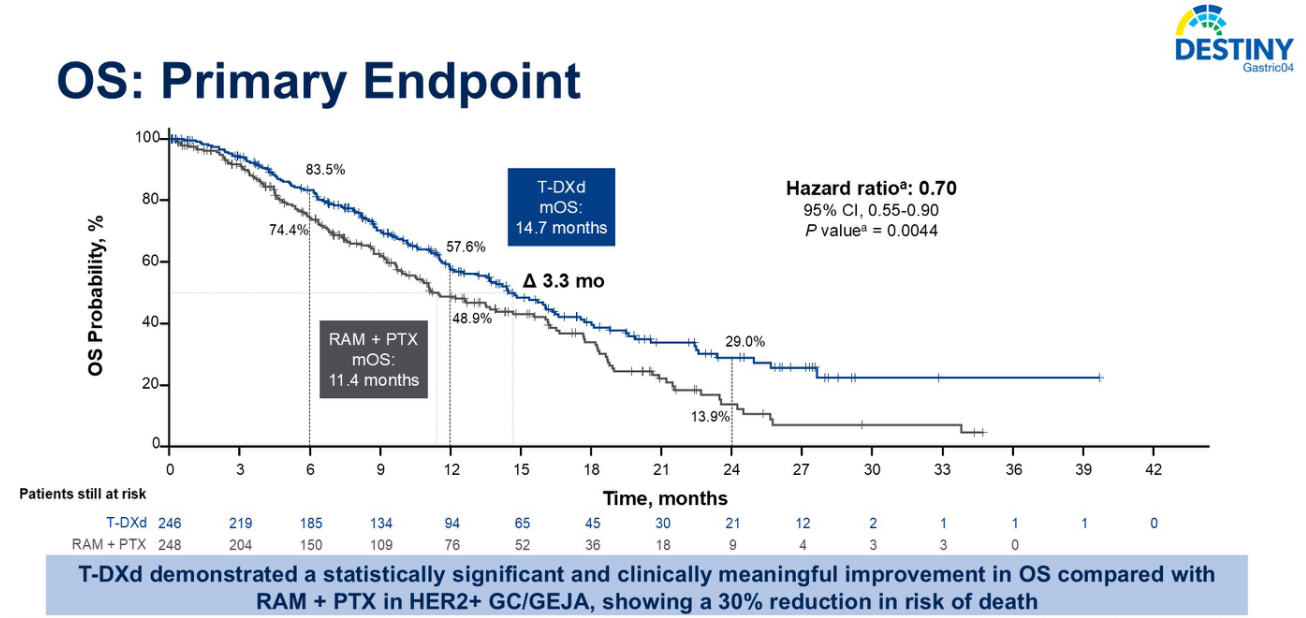
一年生存率方面,T-DXd组为58%,Ram-Pac组为49%。两年生存率方面,T-DXd组为29%,Ram-Pac组为14%,提示T-DXd具有长期生存获益。
敏感性分析进一步证实OS获益
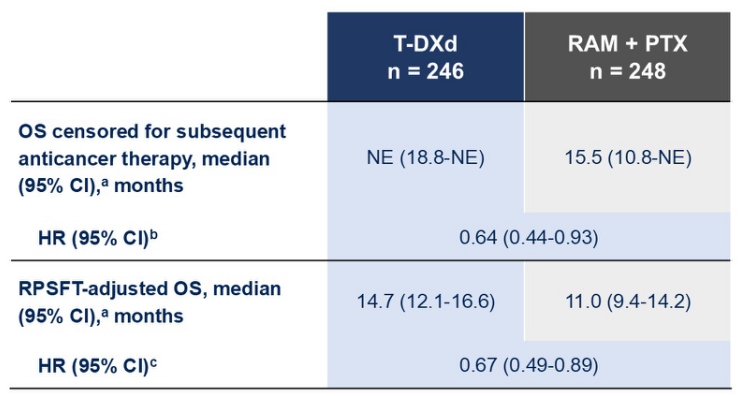
为了调整后续治疗对生存期的影响,研究进行了预设的OS敏感性分析。在对后续抗癌治疗进行审查后,OS的HR为0.64(图4)。在通过RPSFT分析调整Ram-Pac组后续接受HER2 ADC治疗的影响后,OS的HR为0.67。这些结果与主要分析一致,进一步证实了T-DXd的生存优势。
OS亚组分析:获益广泛且一致
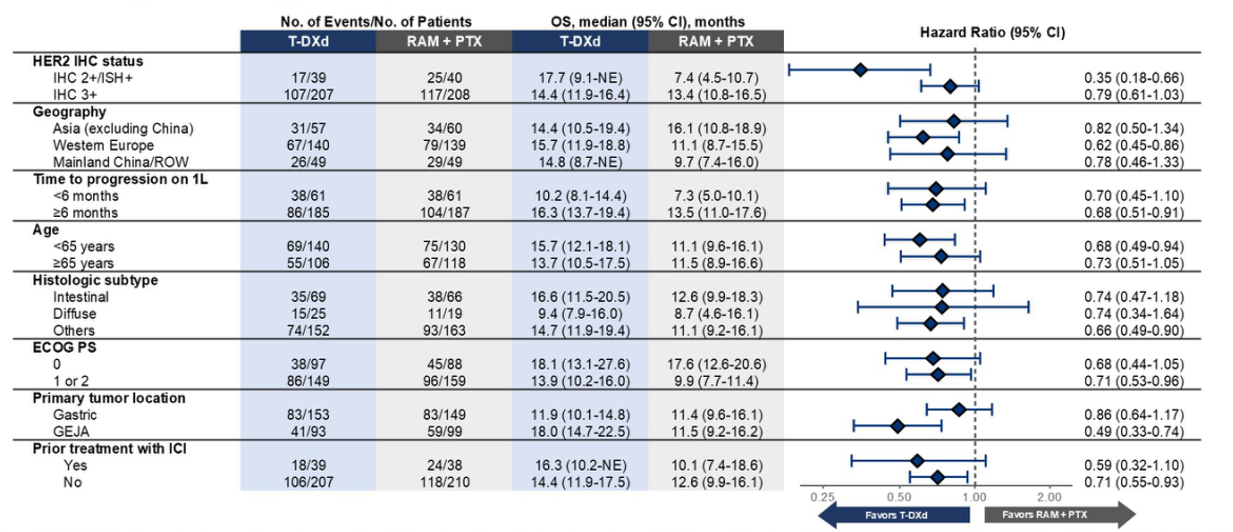
OS获益在大多数亚组中均得以维持。尽管IHC 2+患者样本量较小,但其HR低于IHC 3+患者。亚洲患者对照组的中位OS长于其他地区,这可能与亚洲地区后续T-DXd的使用有关。然而,OS的HR在所有区域亚组中均倾向于T-DXd(图5)。
PFS和ORR均显著改善
PFS:显著延长无进展生存期
研究者评估的PFS作为次要终点,也显示出显著优势。PFS曲线同样显示早期分离,并持续维持差异。T-DXd组的中位PFS为6.7个月,Ram-Pac组为5.6个月(HR=0.74,P=0.0074)。一年PFS率分别为23%(T-DXd)和14%(Ram-Pac)(图6)。
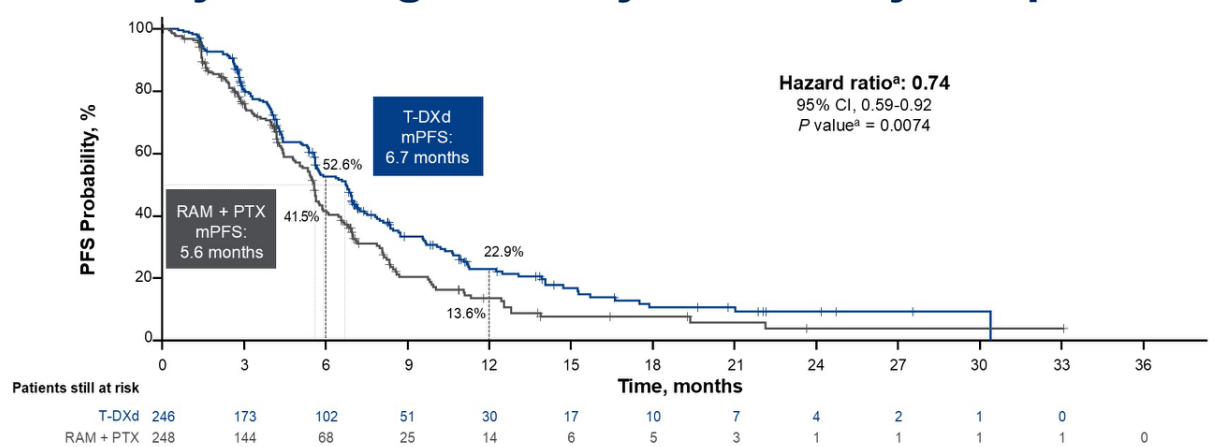
PFS获益在所有亚组中也得到了维持,PFS的HR在HER2状态和地理区域上几乎相似。
ORR与DoR:显著提升缓解率和缓解持续时间
T-DXd组的客观缓解率(ORR)显著高于Ram-Pac组。研究者评估的确认ORR为44%(T-DXd)对比29%(Ram-Pac),T-DXd组的ORR提高了15%(图7)。
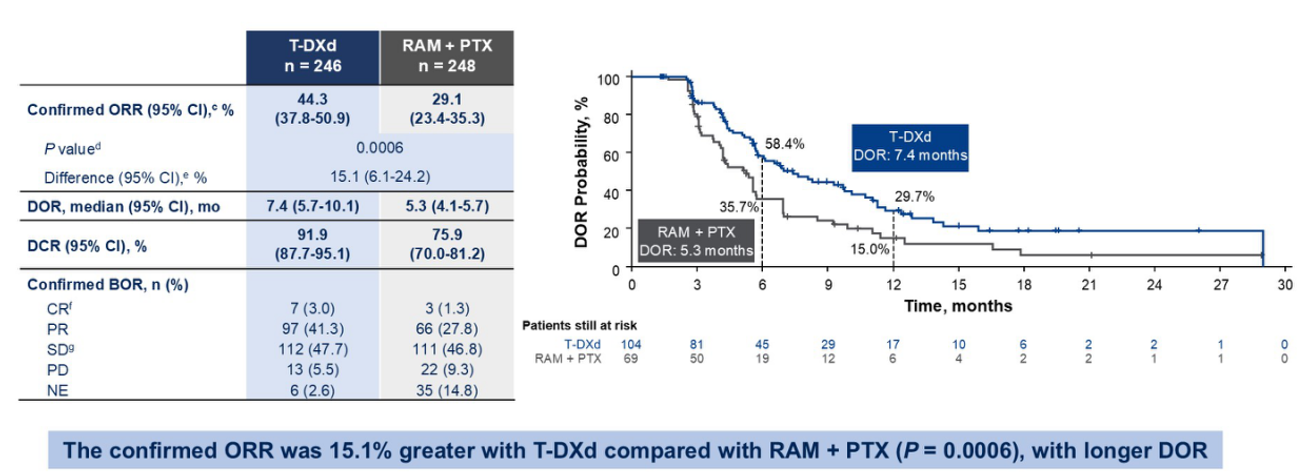
缓解持续时间(DoR)方面,T-DXd组也更长。中位DoR为7.4个月(T-DXd)对比5.3个月(Ram-Pac),T-DXd组在6个月时仍有超过20%的患者持续缓解。疾病控制率(DCR)也更高。
安全性可控,未见新的安全信号
两组间严重不良事件(SAE)的发生率相似(图8)。因治疗相关不良事件(TRAEs)导致治疗中止的比例,T-DXd组为12%,Ram-Pac组为13%。两组治疗相关死亡率均低于2%。
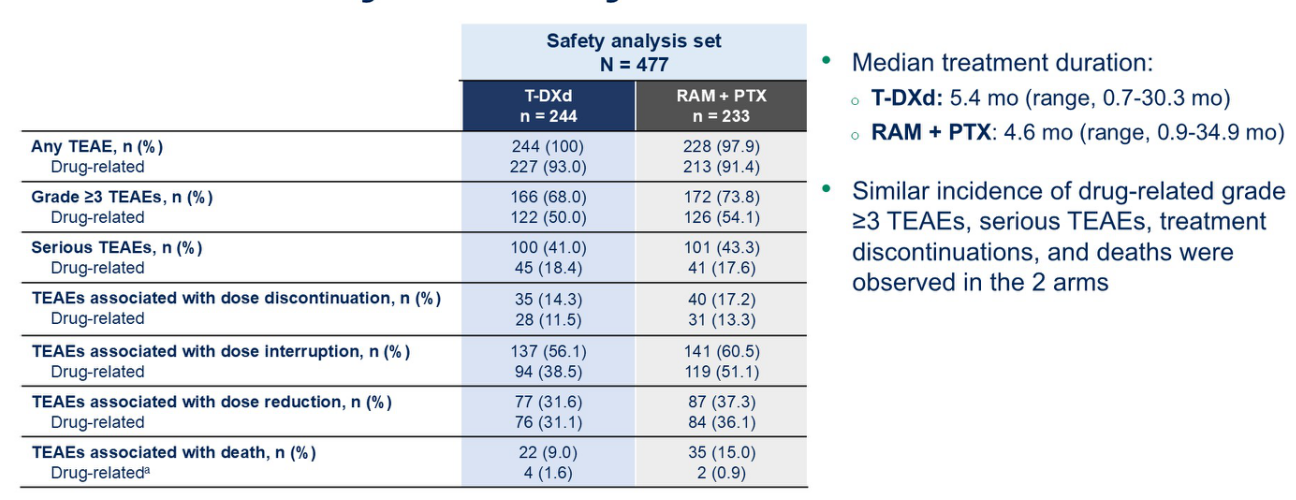
T-DXd常见毒性包括疲劳、骨髓抑制和胃肠道毒性。Ram-Pac常见毒性包括骨髓抑制、疲劳、周围神经病变和高血压。
经独立裁定,T-DXd组有14%的患者发生间质性肺病(ILD)和肺炎,但大多数为1级和2级事件,仅1例患者出现3级ILD,无4级和5级事件。相比之下,Ram-Pac组有3例患者出现3级或更高级别的ILD,包括1例5级事件。左心室射血分数(LVEF)降低在两组中均罕见,且无明显差异。
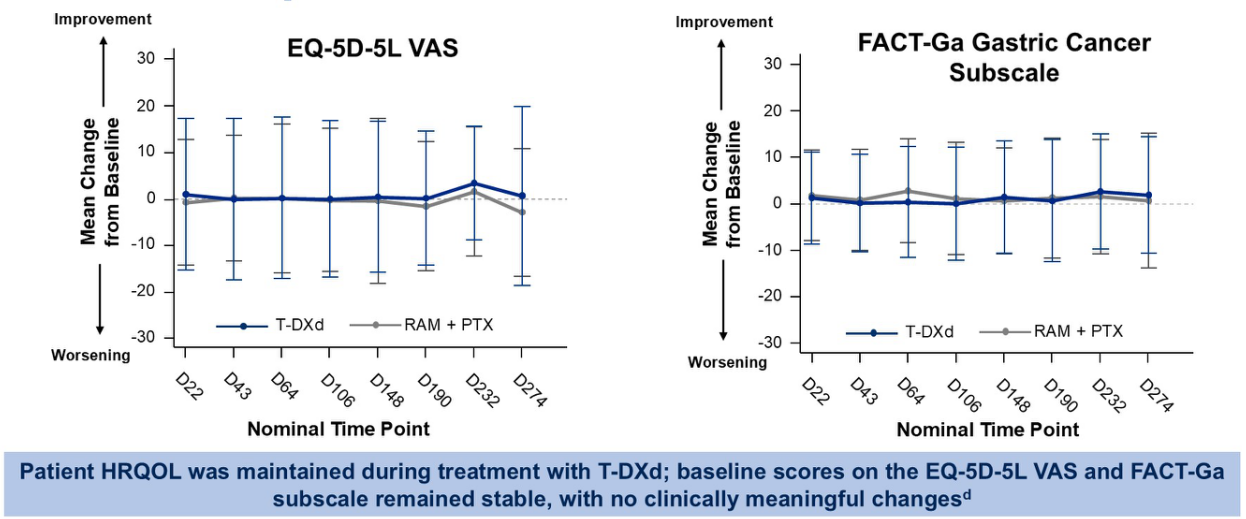
患者报告结局(PROs)方面,根据EQ-5D-5L和FACT-Ga胃癌亚量表评估,研究期间患者生活质量保持稳定,两组间具有可比性(图9)。
排版编辑:肿瘤资讯-Kingsley











 苏公网安备32059002004080号
苏公网安备32059002004080号


