第61届美国临床肿瘤学会年会(ASCO)在美国芝加哥圆满落幕,来自全球近4万名肿瘤领域的临床医生及科研工作者共同分享这场盛大的学术盛宴。众多重要的临床研究口头汇报后,结果也发表于顶级期刊。这些研究结果不仅改变了指南,同时也为相关创新药物获批提供了关键的循证医学证据。【肿瘤资讯】整理相关研究进展,与国内同行分享。本期两项研究ASCO口头汇报后,结果同步发表于Lancet和Annals of Oncology。
芦比替定联合阿替利珠单抗一线维持治疗广泛期小细胞肺癌的疗效及安全性:一项随机、多中心、开放标签、III期临床研究

研究背景
自2019年开始,免疫检查点抑制剂联合含铂双药治疗是广泛期小细胞肺癌(ES-SCLC)一线标准治疗方案。IMpower133研究中,化疗基础联合阿替利珠单抗并继续阿替利珠单抗维持治疗,改善了患者的总生存期(OS)和无进展生存期(PFS),但获益较有限,提示应当探索新的治疗策略。芦比替定是一款合成的烷基化药物,可通过结合肿瘤细胞转录因子,促进肿瘤细胞死亡。在一项II期篮子研究中,芦比替定二线治疗ES-SCLC具有良好的抗肿瘤活性并获批后线治疗。
临床前研究数据显示,芦比替定可改善肿瘤微环境并与免疫检查点抑制剂具有协同作用。在一项前期临床研究中,芦比替定 3.2mg/m2,每3周一次联合标准剂量阿替利珠单抗可耐受,没有出现非预期不良反应,客观缓解率(ORR)为57.7%,中位PFS为4.9个月;而在另一项临床研究中,芦比替定联合帕博利珠单抗(N=28)在未接受免疫治疗的患者中,ORR为46.4%,中位PFS为4.6个月,中位OS为10.5个月。因此,研究者提出研究假设,标准阿替利珠单抗维持治疗联合芦比替定可以提高ES-SCLC维持治疗的疗效。
研究方法
IMforte 是一项随机、多中心、开放标签、III期临床研究,研究纳入年龄≥18周岁、组织病理学或细胞病理学确认的ES-SCLC患者,PS评分0~1分,既往接受过免疫检查点抑制剂治疗或存在脑转移的患者排除入组。患者首先接受4周期标准剂量的依托泊苷联合卡铂及阿替利珠单抗治疗,未出现疾病进展的患者,按1:1的比例随机分为阿替利珠单药维持,或在此基础上联合芦比替定 3.2mg/m2。主要研究终点为独立评审委员会评估的PFS和OS,次要研究终点包括研究者评估的PFS、ORR、安全性等。
研究结果
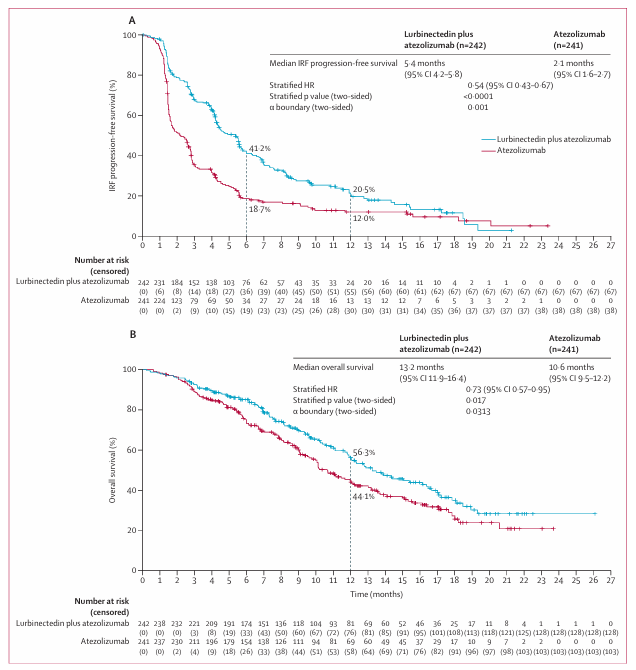
从2021年11月至2024年1月,共计660例患者接受维持治疗,芦比替定联合阿替利珠单抗组和阿替利珠单抗组分别纳入242例和241例患者。OS首次期中分析,即PFS最终分析时,中位随访时间(至随机化后)为15.0个月,除年龄外(联合治疗组年龄小于65周岁的患者比例更多,49% vs. 37%),两组基线特点均衡可比。数据分析时,两组分别有72%和84%的患者出现疾病进展或死亡事件,中位PFS分别为5.4个月和2.1个月,HR=0.54,P<0.0001(预设的显著性水准0.001),6个月PFS率分别为41.2%和18.7%,12个月PFS率分别为20.5%和12.0%。
在首次预设的OS分析时,两组分别有47%和56%的患者出现死亡事件,中位OS分别为13.2个月和10.6个月,HR=0.73,P=0.017(预设显著性水准0.0313),12个月OS率分别为56.3%和44.1%。有肝转移的患者,两组中位PFS分别为4.4个月和1.6个月,HR=0.45;诱导治疗期存在客观缓解患者的中位PFS分别为5.6个月和2.4个月,HR=0.53。评估为疾病稳定(SD)患者的中位PFS分别为2.8个月和1.6个月,HR=0.72。在维持治疗阶段,两组ORR分别为19%和10%,中位缓解持续时间(DoR)分别为9.0个月和5.6个月。
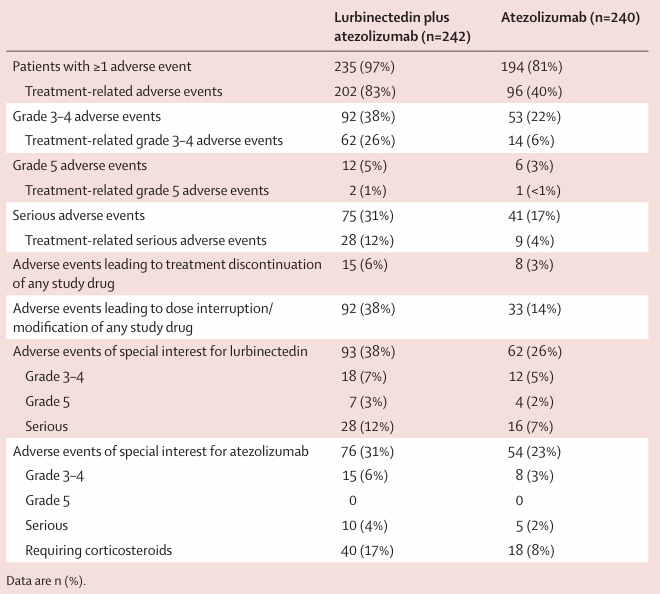
安全性:两组分别有242例和240例患者纳入安全性分析,任何级别治疗相关不良反应发生率分别为83%和40%,3级以上治疗相关不良反应发生率分别为26%和6%,5级治疗相关不良反应发生率分别为1%和<1%,严重治疗相关不良反应发生率分别为12%和4%,因不良反应而导致治疗永久终止的患者占比分别为6%和3%。最常见的3~4级不良反应为血液学毒性,包括贫血8% vs. 1%,中性粒细胞下降7% vs. 7%,中性粒细胞缺乏性发热5% vs. 小于1%,血小板计数下降5% vs. 小于1%。
研究结论
对于ES-SCLC患者的维持治疗,在阿替利珠单抗基础上给予芦比替定,可改善患者的PFS和OS。芦比替定联合阿替利珠单抗代表了一线维持治疗新的策略。
赛沃替尼联合奥希替尼治疗奥希替尼耐药后存在EGFR突变及MET过表达和/或扩增患者的疗效及安全性:II期SAVANNAH研究

研究背景
奥希替尼单药或联合化疗是EGFR敏感突变晚期非小细胞肺癌(NSCLC)患者的一线标准治疗。尽管初始疗效较好,但多数患者可以因耐药而导致疾病进展。最常见的耐药机制是获得性MET扩增或蛋白过表达。临床前研究显示,MET扩增发生率差异较大,从7%~50%不等,这可能与检测方法、样本类型、阈值选择的差异有关。荧光原位杂交仍然是检测MET扩增的金标准,而二代测序技术目前应用最为广泛,免疫组化则主要用于检测MET过表达。基于耐药机制选择治疗方案是指南推荐的治疗策略,但目前并没有基于MET扩增或蛋白过表达的免化疗治疗方案。
赛沃替尼是一款口服高选择性MET抑制剂,已在中国获批治疗MET第14外显子跳跃突变的晚期NSCLC患者。在EGFR突变且MET过表达的患者中,赛沃替尼联合奥希替尼在既往研究中展示了可接受的安全性及令人鼓舞的抗肿瘤活性。
研究方法
SAVANNAH是一项国际、II期临床研究,旨在探索奥希替尼联合赛沃替尼治疗EGFR突变且获得性MET扩增或过表达的NSCLC患者,患者既往接受奥希替尼后出现疾病进展,分期为局部晚期或转移性且经过组织病理学/细胞病理学确认为NSCLC患者,需要收集患者组织进行MET检测。
初始方案中,MET过表达定义为:≥50%的肿瘤细胞染色强度为3+ ,MET扩增定义为通过荧光原位杂交检测,染色体/着丝粒的比值≥2或拷贝数≥5。为确定MET基因异常合适的阈值,研究对按照方案1~6版本收集的患者数据进行了分析,结果发现,基于以下定义筛选的患者,疗效更好:>90%的肿瘤细胞染色强度3+或拷贝数≥10的患者(定义为高水平MET异常)。因此,从第7版方案开始,入组患者仅局限于高水平MET异常的患者。同时,为了探索奥希替尼与赛沃替尼的相互作用,方案1-6版探索了赛沃替尼不同剂量及给药频率与奥希替尼的联合,赛沃替尼的剂量为:300 mg,口服,每日一次、300 mg,口服,每日两次和600 mg,口服,每日一次。最终确认的推荐剂量为:赛沃替尼300 mg,口服,每日两次联合奥希替尼80mg,口服,每日一次。主要研究终点为ORR,分析人群为高水平MET异常的患者。
研究结果
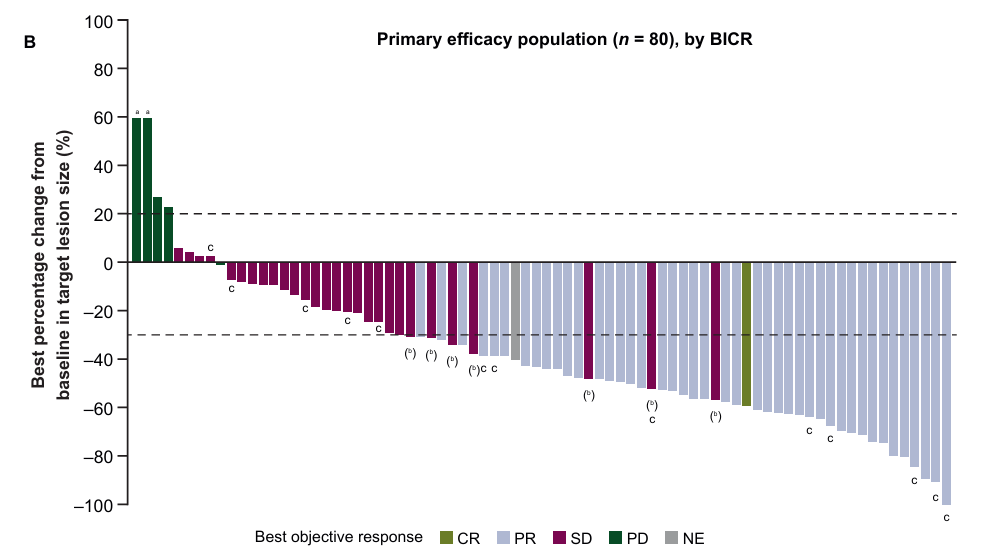
从2019年1月至2024年1月,共1064例患者接受筛查,369例患者接受治疗,365例患者接受至少一次研究药物的治疗。80例患者组成主要分析集(即接受赛沃替尼300 mg,口服,每日两次联合奥希替尼80mg,人群为MET高水平异常的患者),中位年龄66周岁,70.0%为女性,PS评分1分患者占比60.0%,38.8%的患者有脑转移。ORR为56.3%,中位DoR为7.1个月,中位PFS为7.5个月。单纯接受赛沃替尼300 mg,口服,每日两次的患者,ORR仅为16%,中位DoR为4.5个月,中位PFS为3.7个月;在≥50%的肿瘤细胞表达3+或拷贝数≥5的患者,塞沃替尼300 mg,口服,每日一次联合奥希替尼的ORR为31.6%,中位DoR为8.5个月。
安全性:341例至少接受一次赛沃替尼联合奥希替尼治疗的患者中,3级以上全因不良反应发生率为51.0%。较常见的任何级别不良反应为:外周水肿46.0%、恶心40.5%、腹泻23.2%。最常见的3级以上不良反应及发生率分别为外周水肿4.4%、肺血栓4.4%、肺炎4.1%、呼吸困难4.1%。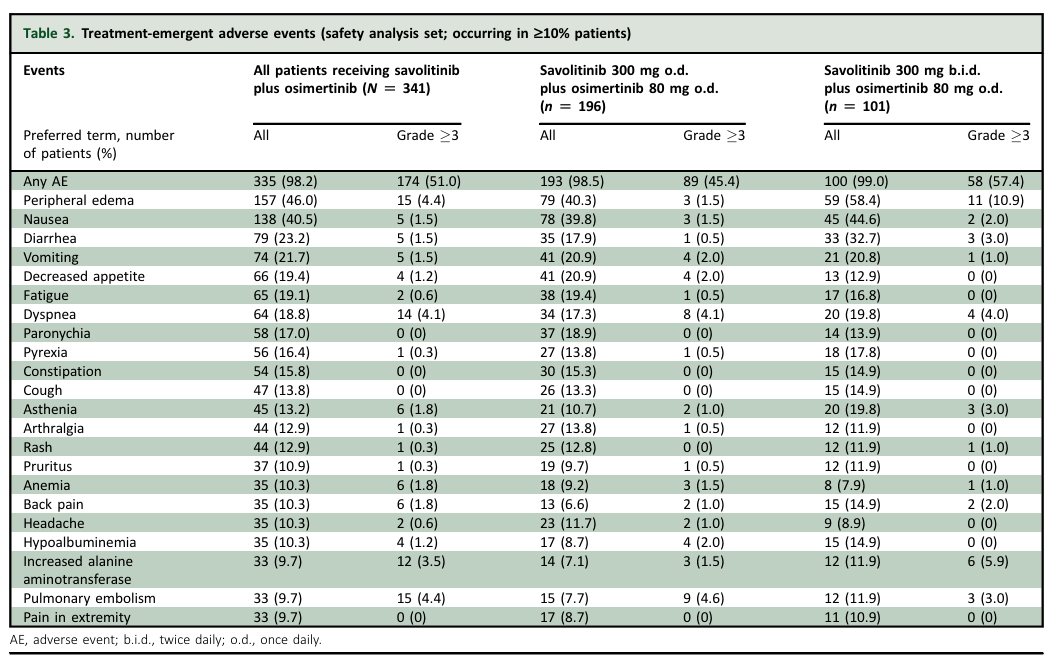
研究结论
赛沃替尼300 mg,口服,每日两次联合奥希替尼在携带EGFR突变且奥希替尼耐药后MET高水平异常的患者中具有良好的抗肿瘤活性。联合治疗耐受性良好,可能可以提供新的治疗选择。
研究启示与思考
ES-SCLC维持治疗一直是临床的“老大难”问题,现有的维持治疗策略效果差,Rova-T等药物在内的维持治疗均未能取得成功。IMforte研究结果有可能为维持治疗提供新的治疗选择。安全性方面,芦比替定最常见的不良反应为血液学毒性,与含铂双药治疗的毒性类似。这一组合策略前移至一线治疗未来值得探索。去年WCLC大会上,上海市胸科医院韩宝惠教授也公布了一种维持治疗策略,安罗替尼联合度伐利尤单抗维持治疗的中位PFS超过5个月。整体而言,小细胞肺癌的维持治疗策略值得更多探索和研究。
目前三代EGFR-TKI耐药后,虽然治疗选择众多,但缺乏基于机制基础的、较高效的治疗策略。本文第二项研究聚焦于靶向药物耐药后MET异常患者的靶向联合治疗,为EGFR突变耐药后靶向治疗提供了新证据。今年ASCO大会上,III期SACHI研究结果为奥希替尼进展后,奥希替尼联合赛沃替尼用于MET扩增NSCLC患者的靶向治疗提供了重要的III期研究证据。在EGFR突变耐药后MET异常研究领域,除了联合MET-TKI外,联合MET-ADC同样有所探索。今年5月,Annals of Oncology发表了Telisotuzumab vedotin——一款针对MET的ADC联合奥希替尼后线治疗奥希替尼耐药后患者的研究结果。研究共纳入38例患者,MET蛋白过表达定义为>25%的肿瘤细胞染色为3+。Telisotuzumab vedotin的治疗剂量为1.6mg/kg和1.9mg/kg,两个剂量分别入组20例和18例患者,整体ORR为50.0%,中位PFS为7.4个月,最常见的不良反应包括外周神经炎50%、外周水肿32%及以恶心24%。期待该领域未来更多探索。
[1]Paz-Ares L, Borghaei H, Liu SV, et al. Efficacy and safety of first-line maintenance therapy with lurbinectedin plus atezolizumab in extensive-stage small-cell lung cancer (IMforte): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2025 May 30:S0140-6736(25)01011-6. doi: 10.1016/S0140-6736(25)01011-6. Epub ahead of print. PMID: 40473449.
[2]de Marinis F, Kim TM, Bonanno L, Cheng S, et al. Savolitinib plus osimertinib in epidermal growth factor receptor (EGFR)-mutated advanced non-small cell lung cancer with MET overexpression and/or amplification following disease progression on osimertinib: primary results from the phase II SAVANNAH study. Ann Oncol. 2025 May 22:S0923-7534(25)00157-7. doi: 10.1016/j.annonc.2025.04.003. Epub ahead of print. PMID: 40461383.Available online 2 June 2025
[3]Horinouchi H, Cho BC, Camidge DR, et al. Results from a phase Ib study of telisotuzumab vedotin in combination with osimertinib in patients with c-Met protein-overexpressing, EGFR-mutated locally advanced/metastatic non-small-cell lung cancer (NSCLC) after progression on prior osimertinib. Ann Oncol. 2025 May;36(5):583-591. doi: 10.1016/j.annonc.2025.01.001. Epub 2025 Jan 11. PMID: 39805351.
排版编辑:肿瘤资讯-Yuno











 苏公网安备32059002004080号
苏公网安备32059002004080号


