癌症是我国重大的公共卫生问题,严重影响我国居民的身体健康、国民经济和社会发展。随着检测技术的快速发展,神经营养因子受体络氨酸激酶(NTRK)基因融合已在多种肿瘤中发现,是肿瘤发生发展的关键驱动因子[1]。因此,NTRK基因融合实体瘤的精准检测及其靶向治疗已成为临床关注焦点。最新发表在“JCO precision oncology”的文章“拉罗替尼与真实世界中非TRK抑制剂治疗TRK融合肿瘤患者的比较分析”为这一领域提供了重要循证证据。本次特邀华中科技大学同济医学院附属协和医院董晓荣教授和上海交通大学医学院附属上海儿童医学中心高怡瑾教授进行深入探讨和点评。
NTRK基因融合靶向治疗开辟广谱抗癌新路径
NTRK基因(NTRK1、NTRK2和NTRK3)编码促肌球蛋白受体激酶(TRK)蛋白家族,在生物过程和细胞功能的调节中发挥关键作用,可作为多种成人和儿童肿瘤的主要致癌驱动因子[2,3]。NTRK基因融合在不同肿瘤类型中的发生率存在差异,其中部分罕见肿瘤(如分泌性乳腺癌、婴儿纤维肉瘤)中检出率高达90%,在常见肿瘤(如非小细胞肺癌和结直肠癌)中不足0.5%[4,5]。这一特性为开发不受肿瘤类型限制、靶向NTRK基因融合的“广谱抗癌疗法”提供重要依据[6]。
拉罗替尼的获益再创新高:成人实体瘤患者生存期达5年以上
由于NTRK基因融合的总体罕见性和涉及肿瘤类型的异质性,在TRK融合肿瘤中进行随机对照试验极具挑战。近日,拉罗替尼 vs 真实世界(RW)中接受非TRK抑制剂治疗TRK融合肿瘤患者的数据已全文载于国际期刊,为拉罗替尼在实体瘤中的临床应用提供了强有力的循证依据[7]。
研究方法
本研究采用回顾性队列设计,对比分析了拉罗替尼临床试验组与RW标准治疗(SOC)组患者的疗效差异。临床试验组纳入≥18周岁的NTRK基因融合晚期/转移性实体瘤患者。RW患者数据源自四项权威回顾性数据库和全球病历回顾研究。主要终点是总生存期(OS),次要终点包括治疗持续时间(DOT)和至下次治疗时间(TTNT),探索性终点为无进展生存期(PFS)(图1)。
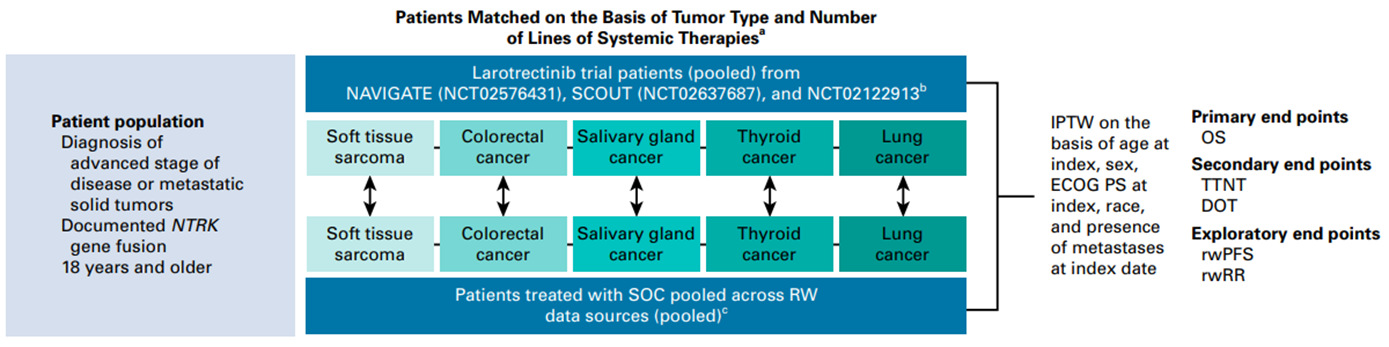
研究结果
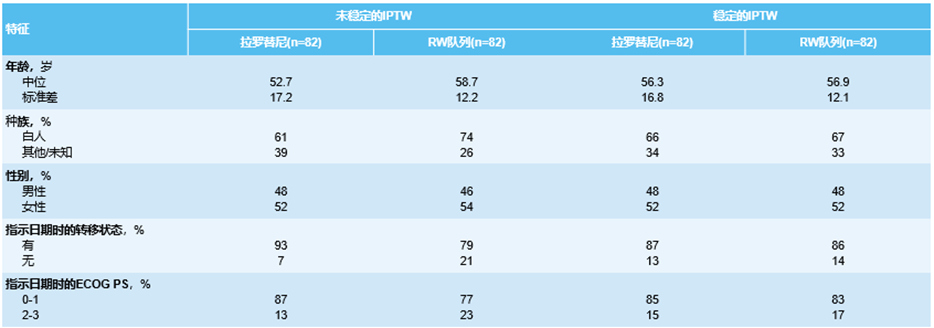
该研究共纳入126例接受拉罗替尼治疗的临床试验患者和144例接受SOC的RW患者,经1:1匹配后,最终形成两组各82例患者的队列(表1)。在应用稳定逆概率加权(IPTW)对数据集进行处理后,所有协变量均达到良好平衡(表2)。
表1. 按肿瘤类型和治疗线数进行设计匹配后的流失表
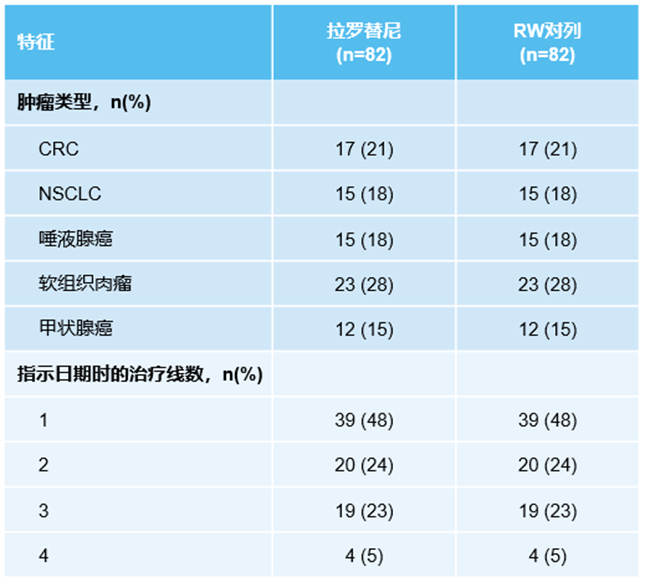
表2. 人口统计学特征(加权前 vs 加权后)
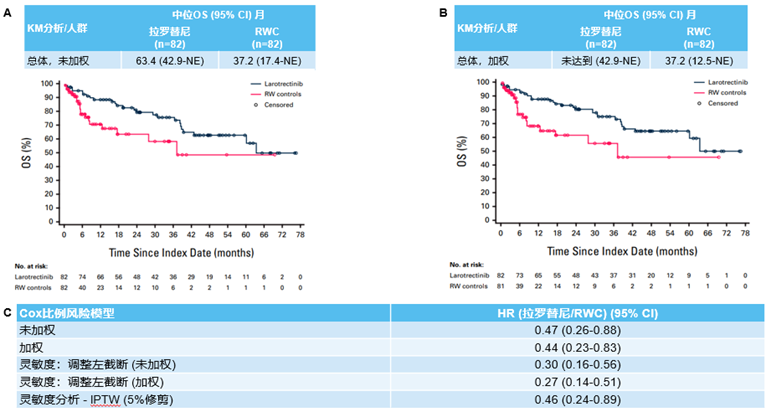
在未加权患者中,拉罗替尼治疗组患者的中位OS为63.4个月(95% CI, 42.9-NE),优于RW对照组的37.2个月(95%CI:17.4-NE);在加权患者中,接受拉罗替尼治疗组患者的中位OS尚未达到(NR),RW对照组为37.2个月(95% CI, 12.5-NE)。结果显示,无论是未加权分析(HR=0.47,95%CI:0.26-0.88)还是加权后分析(HR=0.44,95%CI:0.23-0.83),拉罗替尼治疗均可显著降低患者死亡风险(图2)。
在未加权患者中,拉罗替尼组中位DOT为29.3个月(95%CI:15.7-38.6),而RW组仅为3.5个月(95%CI:2.8-4.7),HR为0.24(95%CI:0.17-0.36);经加权调整后,拉罗替尼组中位DOT进一步延长至30.8个月(95%CI:18.2-47.6),RW组维持在3.4个月(95%CI:2.7-4.7),HR为0.23(95%CI:0.15-0.33)(图3)。
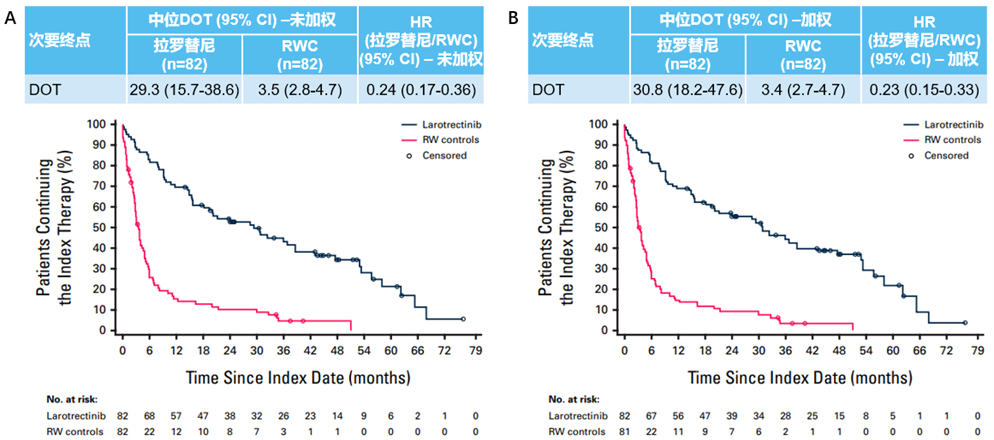
拉罗替尼组患者的中位TTNT显著优于RW对照组。在未加权分析中,拉罗替尼组中位TTNT为58.1个月(95%CI:53.2-NE),而RW组仅为10个月(95%CI:6.7-17.7),HR为0.24(95%CI:0.14-0.40);经加权调整后,拉罗替尼组中位TTNT未达到(NE),RW组保持相似水平(10.6个月,95%CI:6.1-17.7),HR为0.22(95%CI:0.13-0.38)(图4)。
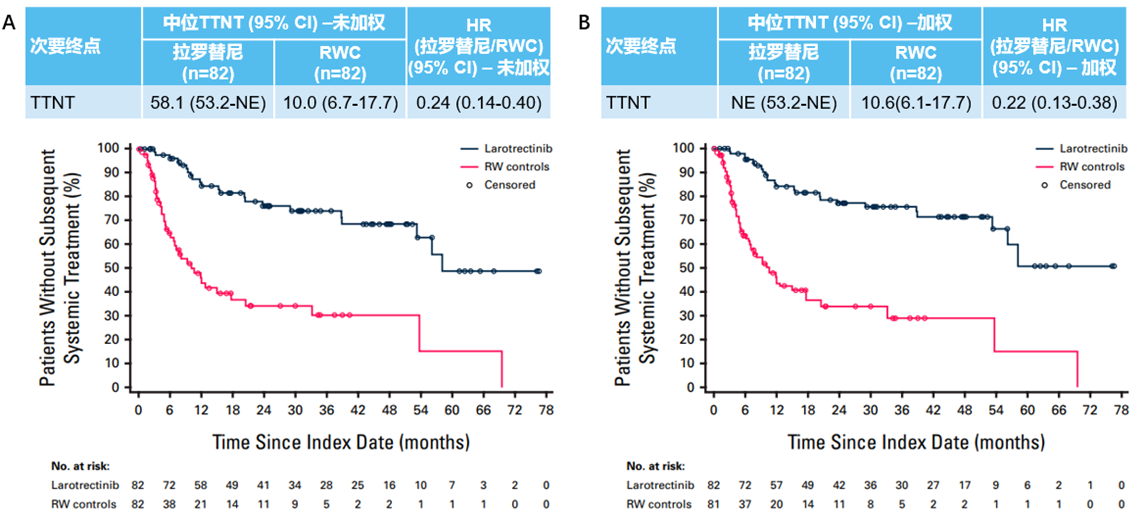
经加权调整后,拉罗替尼治疗组患者的中位PFS显著优于RW对照组。基于放射科医师评估,拉罗替尼组中位PFS为36.8个月(95%CI:25.8-58.2),较RW组的5.2个月(95%CI:3.5-6.8)显著延长,HR为0.29(95%CI:0.18-0.46);基于肿瘤科医师评估与此一致,拉罗替尼组中位PFS保持36.8个月(95%CI:25.8-58.2),RW组为5.9个月(95%CI:3.7-10.2),HR为0.33(95%CI:0.20-0.53)(图5)。
综上所述,在NTRK基因融合成人实体瘤患者中,与SOC相比,拉罗替尼治疗在所有评估终点均显示出更优的生存获益和更长的事件发生时间。本研究数据为拉罗替尼在该人群中的疗效提供了有力佐证。
权威指南一致力荐:拉罗替尼为NTRK基因融合实体瘤患者的主要选择
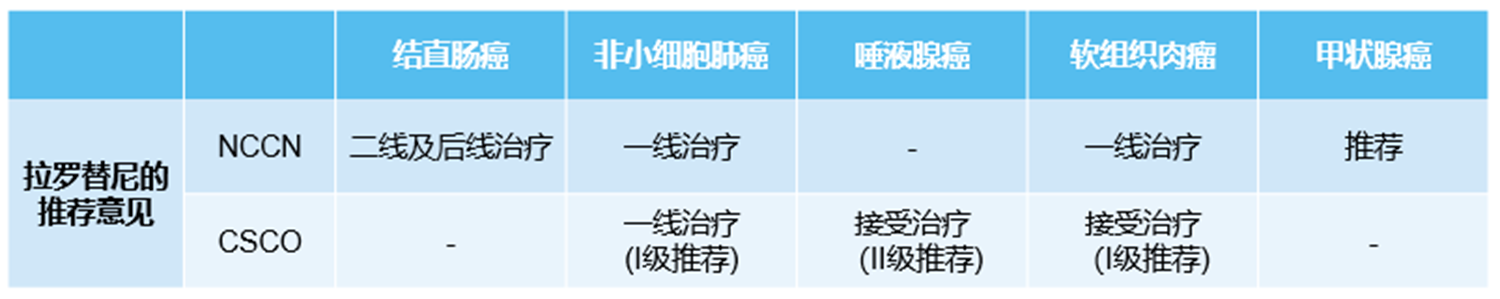
基于拉罗替尼治疗NTRK基因融合实体瘤患者突出的临床获益,目前已获得国内外多部权威指南推荐,成为NTRK基因融合实体瘤治疗的重要选择(表3)。
表3. 国内外指南对拉罗替尼治疗NTRK基因融合肿瘤的推荐
检测先行:NTRK基因融合全面筛查助力精准医疗
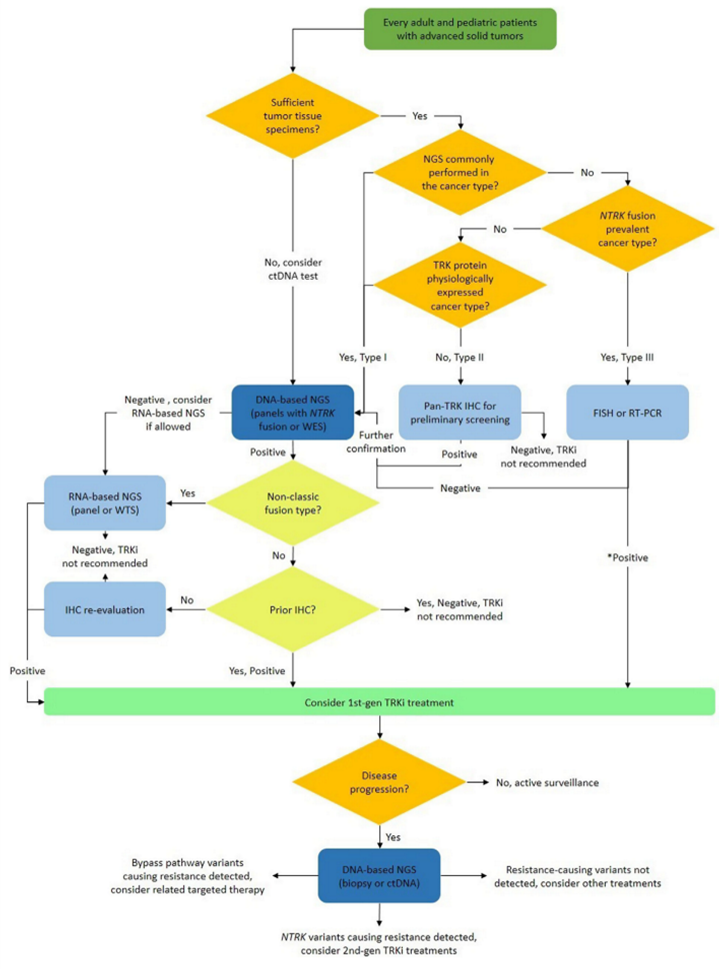
NTRK基因融合作为首个获监管机构批准的泛癌种靶向治疗生物标志物,其检测在肿瘤精准诊疗中具有重要意义。然而,目前我国患者NTRK基因融合检测率仅为1.3%,低于日本(3.4%)、法国(3.7%)和德国(5.6%)等国家[8]。2022年我国首部《中国实体瘤NTRK基因融合临床诊疗专家共识》正式发布,为NTRK基因融合实体瘤的诊疗提供了规范指导(图6)[9]。该共识明确建议:所有晚期成人和儿童实体瘤患者均应进行NTRK基因融合检测,首选覆盖NTRK基因内含子区域的NGS DNA panel或全外显子组检测。对于初筛阳性病例,可进一步采用ETV6-NTRK3 FISH、RT-PCR或pan-TRK IHC等方法进行验证。确诊为NTRK基因融合阳性的患者,推荐使用拉罗替尼等TRK抑制剂或参加相关临床试验。全面及时的检测不仅能为患者提供靶向治疗机会、改善预后,还可为TRK抑制剂的临床应用和肿瘤精准医疗发展奠定基础。
成人肿瘤学专家点评
华中科技大学协和医院肿瘤中心胸部肿瘤科
主任
中国临床肿瘤学会理事
中国抗癌协会非小细胞肺癌专业委员会 常委
中国抗癌协会免疫治疗专业委员会 常委
中国临床肿瘤学会非小细胞肺癌专家委员会 常委
中国临床肿瘤学会免疫专业委员会 常委
中国临床肿瘤学会肿瘤生物标志物专家委员会 常委
中国临床肿瘤学会血管靶向专家委员会 常委
湖北省抗癌协会肿瘤免疫治疗专业委员会 主任委员
湖北省女医师协会精准医疗专业委员会 主任委员湖北省医学生物免疫学会肿瘤专委会 主任委员
拉罗替尼与真实世界中接受SOC治疗患者对比数据的全文发表,进一步增强拉罗替尼治疗成人实体瘤患者的信心,同时克服了单臂临床试验的局限性。在成人实体瘤患者中,加权调整后接受拉罗替尼治疗患者的中位OS尚未达到,中位PFS达36.8个月,其生存获益显著优于接受SOC患者。同时拉罗替尼组展现出更长的治疗持续时间,加权后中位DOT为30.8个月。此外,拉罗替尼已获国内外权威指南一致推荐,成为NTRK基因融合实体瘤患者的首选治疗。为实现拉罗替尼最佳治疗效果,关键在于规范化的NTRK基因融合检测。采用NGS等精准检测技术可准确识别潜在获益人群,践行“精准检测指导精准治疗”的现代肿瘤诊疗理念。随着检测技术的不断进步和普及,将有更多NTRK基因融合患者能够从这一创新靶向药物中获益。
儿童肿瘤学专家点评
中国抗癌协会小儿肿瘤专业委会副主任委员(8th, 9th)
中华医学会儿科学分会(18th 19th) 肿瘤学组副组长
上海市抗癌协会儿童肿瘤专业委员会主任委员
擅长领域:淋巴瘤和组织细胞疾病,并负责各种实体肿瘤(包括神经肿瘤)治疗
先后在香港中文大学威尔斯亲王医院、奥地利Tyrolean肿瘤研究所、美国MD Anderson肿瘤中心、美国Common Wealth University Virginia和美国St. Jude儿童研究院访学;并于2018年4月-2019年4月在美国Cincinnati Children‘s Hospital Medical Center肿瘤血液病研究所 (CBDI)工作一年
儿童患者中NTRK基因融合发生率相对较高[10]。临床研究数据显示,拉罗替尼一线治疗NTRK基因融合儿童实体瘤患者6个周期内的ORR达60%,2年EFS和OS率达80%和93.3%;对于IFS患者的疗效更为显著,6个周期内的ORR高达94%[11]。值得注意的是,对于伴CNS转移的NTRK基因融合儿童患者,拉罗替尼同样显示出卓越疗效[12]。这些数据充分证实了拉罗替尼在NTRK基因融合儿童实体瘤治疗中的重要地位。拉罗替尼不仅显著提高了IFS及其他NTRK基因融合儿童患者的疗效,更为实现局部肿瘤的非致残性手术切除创造了有利条件。期待更多拉罗替尼治疗儿童患者的长期随访数据发表,进一步明确拉罗替尼在儿童肿瘤治疗中的优势,为临床实践提供更充分的循证依据。
[1] Laetsch TW, et al. Expert Rev Anticancer Ther. 2019 Jan;19(1):1-10.
[2] Amatu A, et al. Ann Oncol. 2019 Nov 1;30(Suppl_8):viii5-viii15.
[3] Cocco E, et al. Nat Rev Clin Oncol. 2018 Dec;15(12):731-747.
[4] O'Haire S, et al. Sci Rep. 2023 Mar 13;13(1):4116.
[5] Westphalen CB, et al. NPJ Precis Oncol. 2021 Jul 20;5(1):69.
[6] Awada A, et al. Crit Rev Oncol Hematol. 2022 Jan;169:103564.
[7] Brose MS, et al. JCO Precis Oncol. 2025 Apr;9:e2400500.
[8] Kriti Jindal, et al. 2021 ESMO. abstract 102P.
[9] Xu C, et al. Thorac Cancer. 2022 Nov;13(21):3084-3097.
[10] Marchetti A, et al. Pathologica. 2022 Jun;114(3):199-216.
[11] Laetsch TW, et al. J Clin Oncol. 2025 Apr;43(10):1188-1197.
[12] Lamoureux AA, et al. Clin Cancer Res. 2025 Feb 3;31(3):561-572.
审核码:PP-VIT-CN-0081-1
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


