肺癌是中国和全球范围内发病率和病死率较高的恶性肿瘤之一[1],多数患者出现症状就诊时已属晚期,整体生存率较低。肺鳞癌属于非小细胞肺癌(NSCLC)中的一种,由于其中驱动基因阳性患者比例较低,目前国内晚期肺鳞癌的治疗以含铂类的双药化疗以及免疫治疗为主[2]。然而,患者治疗期间常伴有肿瘤治疗所致血小板减少症(CTIT),不仅导致出血风险增加,还使肿瘤治疗药物使用的剂量和频率受限,最终影响临床治疗效果[3],因此临床肿瘤治疗中积极管理CTIT至关重要。
本期天津医科大学总医院孟凡路医师分享了一例肺鳞癌患者化疗联合免疫治疗期间CTIT的管理,天津医科大学总医院钟殿胜教授进行了精彩点评,本期特别整理,期待为肺鳞癌治疗期间CTIT的防治与管理提供参考。
病例分享专家
天津医科大学总医院 肿瘤内科 博士 副主任医师
天津医科大学总医院“青年技术骨干”
天津医疗健康学会肺部肿瘤MDT专委会 秘书长 常委
天津抗癌协会靶向治疗专委会 副主任委员
中国医疗保健国际交流促进会肿瘤内科分会委员
中国老年保健协会肺癌专委会委员
北京医学奖励基金会肺癌医学青年专家委员会委员
天津市抗癌协会肺癌青委会委员
天津市中西结合学会呼吸病专业委员会委员
天津市抗癌协会中西医结合肿瘤治疗专业委员会委员
病例资料
基本信息
一般资料:患者男,66岁。
主诉:干咳伴喘息1月,发现肺、肝占位1月2周。
现病史:2022年1月医院体检查腹部B超提示轻度脂肪肝、肝囊肿,肝内低回声团,建议进一步检查。2022年1月12日行正电子发射计算机断层扫描(PET-CT)检查,考虑肺癌、左肺门和纵隔内淋巴结转移瘤、肝转移瘤以及骨转移。2022年1月14日就诊于我院。
既往史、个人史、家族史:高血压病史10余年;40年吸烟史,40支/天,已戒烟5年;否认肿瘤家族史。
辅助检查
胸腹强化CT:考虑左肺下叶周围型肺癌(3.3cm×2.6cm),伴左肺门及纵隔多发淋巴结转移。考虑肝内多发转移瘤,左侧肾上腺略饱满。
骨ECT:双侧肩胛骨、胸骨、双侧部分肋骨、左侧髂骨、右侧股骨远端等部位骨骼多发异常示踪剂相对浓集区,考虑骨转移性病变可能性大。
头强化MRI:(-)。
颈胸腰椎MRI:颈1-7椎体及部分附件、胸1-12椎体及部分附件、腰1-5及1-3体及部分附件异常信号,考虑转移。
CT引导下经皮肺穿刺活检:(肺CNB):非小细胞癌,倾向鳞状细胞癌。免疫组化示:癌细胞P63、P40和CK5/6阳性,Hepatocyte弱阳性,TTF-1部分弱阳性,CK7局灶阳性,AFP、Syn、NapsinA和Arg-1阴性,Ki-67 index约70%。
基因检测:TMB 7.3,MSS,TP53突变(exon6 H193R 52%)、RB1突变,TSC1缺失 0.34、BRCA缺失 0.49,CD274扩增 2.6,JAK2扩增 2.6;PD-L1 TPS 98%,CPS 99;CD8淋巴细胞8%阳性,肿瘤中淋巴细胞浸润,不活跃。
临床诊断
左肺鳞癌(IV期;淋巴结、肝、骨转移;PD-L1 TPS 98%,CPS 99)。
治疗经过
1、2022年1月~10月27日 入组临床试验,接受免疫治疗
患者拒绝化疗,入组TIGIT临床试验,接受12个周期的BGB-A317(替雷利珠单抗)+BGB-A1217治疗。6个周期后进行疗效评估,结果显示肝、肺部肿瘤获得部分缓解(PR)。12个周期后进行疗效评估,结果显示左肺、纵隔淋巴结疾病进展(PD)。
2、2022年11月25日~2023年1月2日 放疗
纵隔淋巴结、左肺下叶放疗(60Gy/30f)。放疗后1周进行疗效评估,结果为PD。
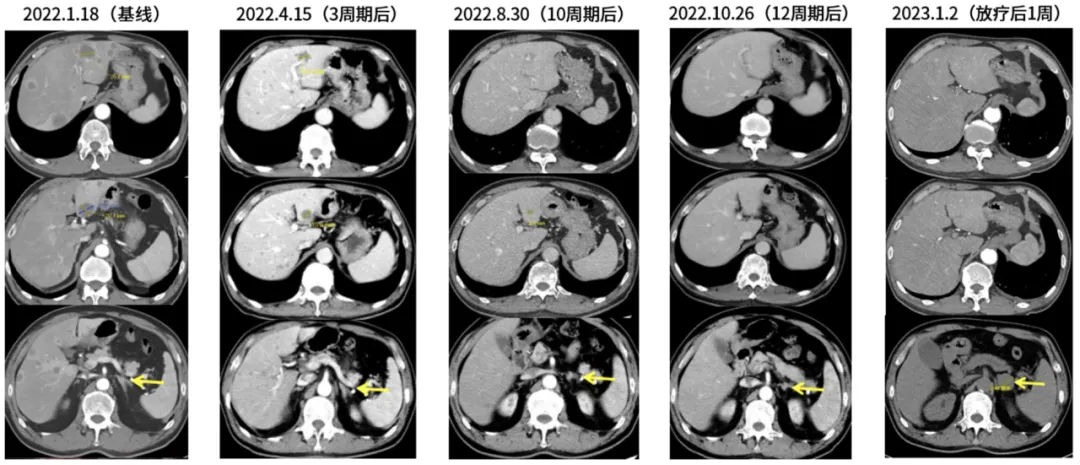
3、2023年1月4~1月9日 全科讨论后续治疗
进行B超引导下右颈淋巴结及右颈肩部肿物穿刺活检,证实为来自肺的转移性鳞癌。颈部淋巴结基因检测示:MET扩增3.01,MYC扩增5.59,MAPK1扩增3.07,KIT扩增3.53,TP53、ATRX、BMPR1A、MTOR、RB1、RECQL4突变,BRCA2、CD274、FGF19、JAK2、PDGFRA等拷贝数变异,PD-L1 TPS 99%,MSS。免疫微环境CD8+T细胞 0.09%,TIME II型。血TMB 10.71,血TP53等基因突变。当时患者合并病毒性肺炎,全科讨论后决定先行紫杉醇联合卡铂化疗,后续联合免疫治疗。
4、2023年1月9日 白蛋白紫杉醇+卡铂化疗
患者接受白蛋白紫杉醇+卡铂治疗。化疗后右颈肿物缩小变平,但在第8天出现血小板减少症,至化疗后第17天,血小板计数降至31×109/L,予以升板治疗。
5、2023年2月10日 帕博利珠单抗治疗
予以帕博利珠单抗治疗。治疗后患者右颈淋巴结肿大,腰部及右腿疼痛,体重下降10kg。
6、2023年3月3日 帕博利珠单抗+白蛋白紫杉醇治疗
帕博利珠单抗+白蛋白紫杉醇治疗。治疗当天检测血小板计数为128×109/L。为避免后续治疗中发生严重血小板减少症,进行CTIT二级预防。
7、2023年3月22日 疗效评估
患者复查发现肺、纵隔淋巴结缩小,右颈部同前,左肾上腺增大,腹腔结节增大。评估疗效为疾病稳定(SD)。患者腰部、右下肢、右肩疼痛加重。腰椎转移伴L5压缩性骨折。
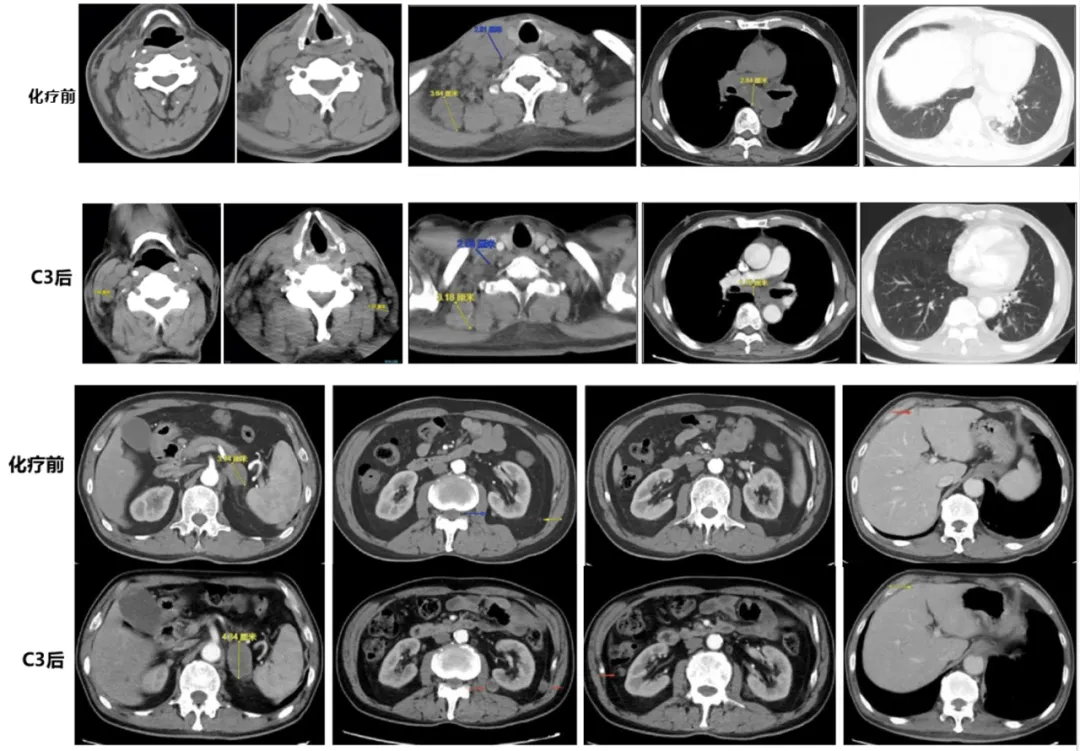
图2 化疗联合免疫治疗前后影像学检查结果
注:C3后指帕博利珠单抗+白蛋白紫杉醇治疗后
8、2023年3月24日 下一步治疗
患者当前诊断为左肺下叶鳞癌(cT3N3M1,IV期;KPS 80分),右颈、左肺门、纵隔、腹腔淋巴结转移,右颈肩皮下转移,多发肝、骨转移,左肾上腺、腹腔转移;高血压病3级(中危);双肺气肿;腰5病理性骨折,且有疼痛,为免疫治疗耐药后,后续拟进行帕博利珠单抗+白蛋白紫杉醇+安罗替尼治疗。
CTIT治疗经过
1、2023年1月9日 CTIT治疗
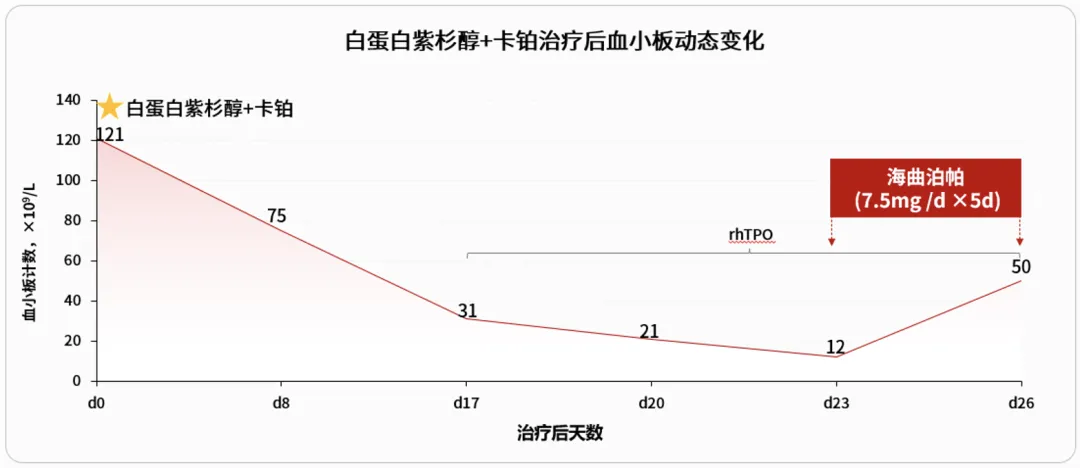
患者接受第1周期白蛋白紫杉醇+卡铂治疗后第8天出现血小板减少症,至化疗后第17天,血小板计数降至31×109/L,予以重组人血小板生成素(rhTPO)治疗后血小板计数仍下降,至化疗后23天出现4级血小板减少症(12×109/L),故暂停化疗,在rhTPO的基础上联合海曲泊帕(7.5mg/天,连续给药5天)治疗。海曲泊帕联合rhTPO治疗3天后血小板计数升至50×109/L。
2、2023年3月3日 CTIT二级预防
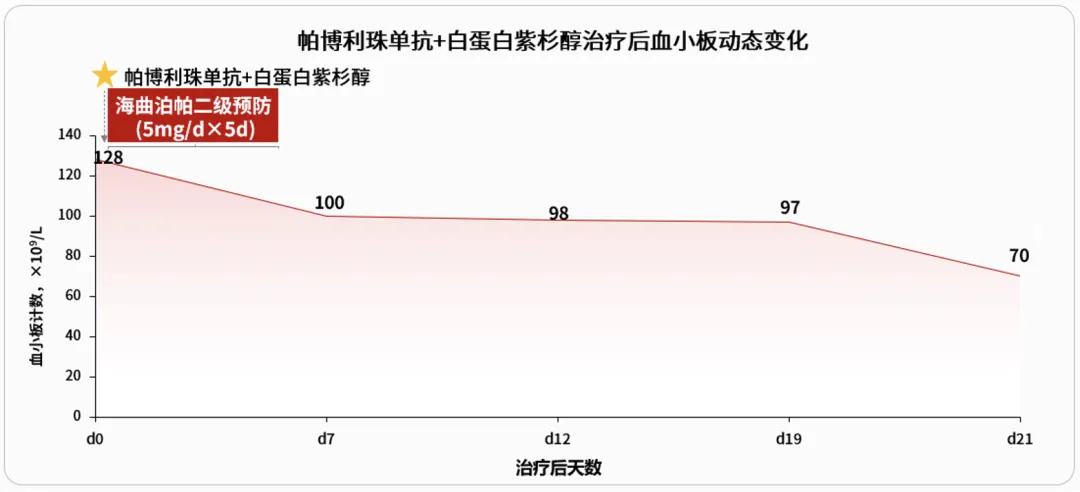
接受第3周期帕博利珠单抗+白蛋白紫杉醇治疗当天检测患者血小板计数为128×109/L。考虑患者在前期化疗中已出现4级CTIT,为避免再次发生重度CTIT,使用海曲泊帕(5mg/天,连续给药5天)进行预防。预防性给予海曲泊帕后,整个治疗周期未再发生重度CTIT。
诊疗思考
肺鳞癌因少有驱动基因突变而难以从靶向治疗中获益,故患者预后差,治疗更具挑战[4]。随着近年来免疫治疗的发展,化疗联合免疫治疗使肺鳞癌患者的预后有所改善。该例晚期肺鳞癌患者无驱动基因、且PD-L1 TPS≥50%,双药联合化疗和/或免疫治疗是该类患者的标准治疗方案[5]。患者拒绝化疗,入组临床试验接受BGB-A317+BGB-A1217治疗,但治疗后8个月疾病进展,此时化疗联合免疫治疗仍是控制其疾病进展的有效手段。考虑到当时患者合并病毒性肺炎,全科讨论后决定先行化疗,后续联合免疫治疗。
患者按计划进行化疗,化疗后第17天发生3级CTIT,为避免患者因为CTIT而影响后续抗肿瘤治疗正常进行,给予rhTPO升板治疗。然而,rhTPO单药治疗6天后CTIT未见好转,且加重至4级。完善骨髓检查发现巨核系减低,骨髓增生极度低下,三系造血细胞缺乏。考虑促血小板生成素受体激动剂(TPO-RA)海曲泊帕与rhTPO联合使用可发挥促血小板生成的协同增效作用[3],故在rhTPO基础上联用了海曲泊帕(7.5mg/天,连续治疗5天)。两者联合治疗3天后,患者血小板计数恢复至50×109/L。
尽管患者经海曲泊帕联合治疗后CTIT逐步恢复,但前期重度CTIT的发生还是导致了后一周期化疗的暂停。考虑到海曲泊帕在相关临床研究中亦展现出良好的预防疗效,获2023年中国临床肿瘤协会(CSCO)《肿瘤治疗所致血小板减少症诊疗指南》推荐用于CTIT的二级预防(II级推荐,2A类证据),决定在患者进行化疗联合免疫治疗时给予海曲泊帕,以防止后续治疗期间再次发生更为严重的CTIT而影响治疗进程。患者预防性使用海曲泊帕后取得了良好的疗效,血小板计数最低值(70×109/L)较前次化疗(12×109/L)明显提升,后续也未发生重度CTIT。此外,该化疗联合免疫治疗方案每3周为一个周期,患者大多数时间院外居家,口服制剂海曲泊帕在稳定升板的同时为CTIT的院外管理提供了便利。
[1] 中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2023版)[J].中华医学杂志, 2023, 103(27):2037.
[2] 侯欣,王志伟,贾梦英,等. 白蛋白结合紫杉醇联合铂类一线治疗晚期肺鳞癌患者的临床研究[J]. 云南医药,2019,40(5):393-395.
[3] 中国临床肿瘤学会指南工作委员会.中国临床肿瘤协会(CSCO)肿瘤治疗所致血小板减少症诊疗指南2023[M]. 北京:人民卫生出版社,2023.
[4] 高鸣,周清.晚期肺鳞癌治疗进展[J].中国肺癌杂志, 2020, 23(10):9.
[5] 中国临床肿瘤学会指南工作委员会.中国临床肿瘤协会(CSCO)非小细胞肺癌诊疗指南2023[M]. 北京:人民卫生出版社,2023.
[6] 中华医学会肿瘤学分会肿瘤支持康复治疗学组.肿瘤治疗相关血小板减少症的临床管理专家共识[J].肿瘤, 2021, 41(12):812-827.
[7] 中国抗癌协会肿瘤临床化疗专业委员会, 中国抗癌协会肿瘤支持治疗专业委员会. 中国肿瘤药物相关血小板减少诊疗专家共识(2023版)[J]. 中华医学杂志, 2023, 103(33) : 2579-2590.
[8] Zhou X, et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitor-based combination therapies in clinical trials: a systematic review and meta-analysis. Lancet Oncol, 2021,22(9):1265-1274.
[9] Jun Ma, et al. A multicenter, randomized phase II trial on the efficacy and safety of hetrombopag for the treatment of chemotherapy-induced thrombocytopenia in patients with advanced solid tumors. 2023 European Congress of Internal Medicine, Abstract 2360.
[10] Haifeng Qin. Annals of Oncology (2022) 33 (suppl_9): S1560-S1597.
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


