2025年4月18日至19日,泉城济南迎来了中国临床肿瘤学界的年度盛会——2025 CSCO诊疗指南大会。本次大会由中国临床肿瘤学会(CSCO)与北京市希思科临床肿瘤学研究基金会联合主办,旨在发布并解读最新版CSCO系列肿瘤诊疗指南,分享前沿进展,提升临床实践水平。在众多更新的指南中,《2025 CSCO非小细胞肺癌诊疗指南》的发布备受关注。专场会议由中国医学科学院肿瘤医院山西医院王洁教授、上海市东方医院周彩存教授和吉林省肿瘤医院程颖教授主持,同济大学附属东方医院周斐教授对“驱动基因阳性晚期非小细胞肺癌(NSCLC)部分的指南更新要点”进行了系统解读。【肿瘤资讯】特别整理重点内容,以飨读者。

EGFR突变晚期NSCLC
EGFR敏感突变一线治疗
新增瑞厄替尼、瑞齐替尼、佐利替尼作为I级推荐。
瑞厄替尼: 基于随机对照III期注册临床研究(SHC013-III-01)的关键数据,瑞厄替尼对比吉非替尼在EGFR敏感突变晚期非小细胞肺癌(NSCLC)患者中取得了更优的无进展生存期(中位PFS:19.3 vs 9.8个月,HR=0.46)表现。依据该研究结果,瑞厄替尼已于2024年9月获得国家药品监督管理局(NMPA)正式批准,用于EGFR敏感突变晚期NSCLC患者的一线治疗。因此,2025版指南将其新增为I级推荐。
瑞齐替尼: 同样作为国产第三代EGFR-TKI,其III期临床研究(REZOR)结果显示,瑞齐替尼对比吉非替尼显著改善患者PFS(19.3个月 vs 9.6个月,HR=0.48)。该药已于2024年11月获NMPA批准用于一线治疗。基于此强力证据,指南亦将瑞齐替尼新增为I级推荐。
佐利替尼(Zorifertinib): EVEREST研究是一项针对伴有中枢神经系统(CNS)转移的EGFR敏感突变晚期NSCLC患者的III期随机对照研究,评估了佐利替尼对比吉非替尼或厄洛替尼的疗效。结果显示,佐利替尼显著延长了该亚组患者的PFS。目前佐利替尼已获NMPA批准用于此适应症。因此,指南新增佐利替尼作为伴CNS转移NSCLC一线治疗的I级推荐。
上调奥希替尼联合化疗为I级推荐: FLAURA2研究评估了奥希替尼联合含铂双药化疗对比奥希替尼单药一线治疗EGFR敏感突变患者的疗效与安全性。结果表明,联合方案显著延长了PFS(25.5 vs 16.7 个月),并且观察到总生存期(OS)获益趋势(数据成熟度41%,HR=0.75)。基于该研究结果,FDA和NMPA已于2024年先后批准此联合方案。鉴于此,2025版CSCO指南将奥希替尼联合化疗上调为I级推荐。
新增埃万妥单抗联合Lazertinib为III级推荐: MARIPOSA研究评估了EGFR/c-MET双特异性抗体埃万妥单抗联合第三代EGFR-TKI Lazertinib对比奥希替尼单药一线治疗。结果显示,联合方案显著延长PFS(23.7 vs 16.6个月)。2025年ELCC会议报道的最新数据显示,该联合方案也展现出OS获益趋势,预估OS延长可能超过一年。目前此方案已获FDA批准。因此,指南将其新增为III级推荐。
新增注释: 推荐三代EGFR-TKI为EGFR敏感突变局部晚期/晚期NSCLC治疗优选,不再单独标注。
EGFR Exon20ins一线治疗
上调埃万妥单抗联合化疗为I级推荐: PAPILLON研究评估了埃万妥单抗联合化疗对比单纯化疗一线治疗EGFR外显子20插入突变(Exon20ins)晚期NSCLC的疗效。结果显示,联合方案显著延长PFS(11.4 vs 6.7 个月)、提高客观缓解率(ORR)(73% vs 47%),且OS曲线提示可能带来长期生存获益(HR=0.675)。基于此研究,NMPA已于2025年2月批准该方案用于一线治疗。因此,指南将埃万妥单抗联合化疗上调为I级推荐。

EGFR TKI耐药后线治疗
新增瑞齐替尼、瑞厄替尼、利厄替尼为I级推荐。 该推荐基于各自的关键性注册研究(均为单臂研究)结果,瑞齐替尼、瑞厄替尼、利厄替尼这三款国产第三代EGFR-TKI均显示出超过60%的ORR和约11-12个月的中位PFS。目前这三款药物均已获得NMPA批准用于此适应症。因此,指南将这三款药物新增为伴T790M突变患者后线治疗的I级推荐。
新增依沃西单抗联合化疗为I级推荐。 HARMONi-A研究(III期)表明,PD-1/VEGF双特异性抗体依沃西单抗联合化疗对比单纯化疗显著改善了EGFR-TKI治疗后进展人群的PFS(7.1 vs 4.8个月)和OS(17.1 vs 14.5 个月,HR=0.7)。基于该研究数据,依沃西单抗联合化疗已获NMPA批准并纳入医保,用于EGFR-TKI治疗后的后线治疗。因此,指南将其新增为I级推荐。
上调信迪利单抗+贝伐珠单抗+化疗(培美曲塞+顺铂)为I级推荐: ORANGE-31研究(III期)评估了信迪利单抗联合贝伐珠单抗及化疗对比单纯化疗用于EGFR-TKI耐药后患者的疗效。结果显示,“四药联合”方案显著延长PFS并提高ORR。该方案已获NMPA批准并纳入医保。因此,指南将其上调为I级推荐。
新增芦康沙妥珠单抗(SKB264)为II级推荐: 芦康沙妥珠单抗是一款靶向TROP-2的抗体药物偶联物(ADC)。在早期的KL264-01研究中,其在EGFR敏感突变NSCLC后线治疗中已展现出良好前景(ORR 55%, mPFS 9.3个月)。关键性III期研究OptiTROP-Lung03已获得阳性结果,显示无论在ORR、PFS还是OS方面均取得统计学显著改善(具体数据将在ASCO 2025公布)。基于OptiTROP-Lung03研究结果,NMPA已批准其用于EGFR-TKI及含铂化疗治疗失败的局部晚期或转移性EGFR突变NSCLC成人患者。因此,指南将其新增为II级推荐,期待III期确证性研究的完整数据。
新增埃万妥单抗单抗联合化疗为II级推荐:MARIPOSA-2研究评估了埃万妥单抗联合含铂双药化疗对比单纯化疗用于奥希替尼治疗失败后的患者。结果显示,联合方案显著延长PFS,并观察到OS获益趋势(HR=0.73)。该方案已获FDA批准,但尚未在中国获批。因此,指南将其新增为II级推荐。

ALK融合阳性NSCLC
新增依奉阿克为一线治疗I级推荐: TQ-B3139-III-01研究是一项III期临床研究,评估了国产第二代ALK抑制剂依奉阿克对比克唑替尼一线治疗ALK阳性晚期NSCLC的疗效。结果显示,依奉阿克显著延长患者PFS(中位PFS 24.97 vs 11.6个月)。基于此研究,依奉阿克已获NMPA批准。因此,指南将其新增为一线治疗的I级推荐。
更新伊鲁阿克、洛拉替尼随访数据:
伊鲁阿克: INSPIRE研究的更新数据显示,伊鲁阿克对比克唑替尼显著延长PFS,中位PFS达到38.6个月( vs 14.6个月,HR=0.31)。
洛拉替尼: CROWN研究的5年随访数据显示,洛拉替尼组中位PFS仍未达到,5年PFS率高达60%(HR=0.19),进一步证实了第三代ALK抑制剂带来的持久缓解,标志着晚期肺癌向慢病化管理迈进。
数据注释复瑞替尼:REMARK研究显示,国产第二代ALK抑制剂复瑞替尼对比克唑替尼一线治疗显著延长PFS(未达到vs 13.9个月,HR=0.23)。尽管疗效数据亮眼,但该药物尚未获NMPA批准,因此指南对其进行数据注释。
关于“优选”标注的更新: 三代、二代ALK-TKI推荐级别优先于一代ALK-TKI。

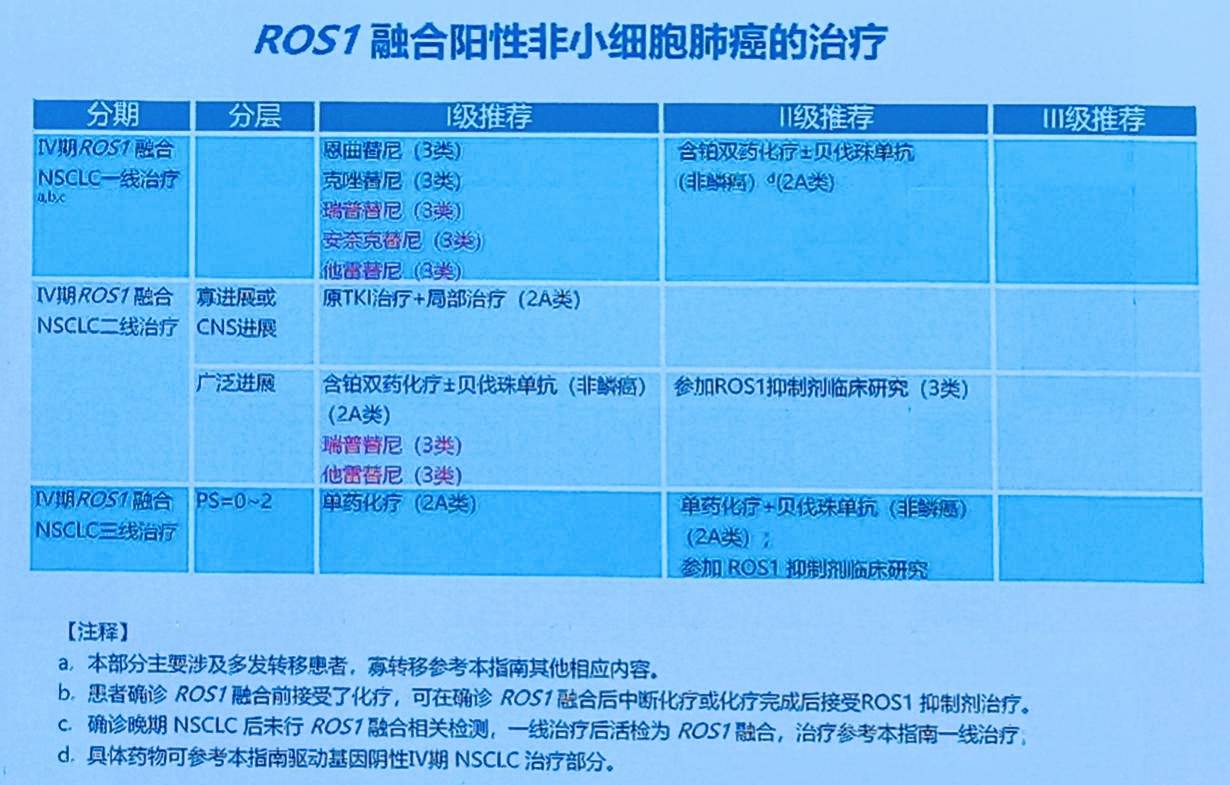
ROS1融合阳性NSCLC
一线治疗
新增他雷替尼为I级推荐: TRUST-II研究显示,国产ROS1抑制剂他雷替尼在初治ROS1阳性患者中展现出极佳疗效,ORR高达88%,中位PFS达到45.6个月,具有“Best-in-class”潜力。基于此研究,他雷替尼已获NMPA批准。因此,指南将其新增为I级推荐。
新增安奈克替尼为I级推荐: 基于其注册性单臂研究数据(初治患者ORR 81.08%, mPFS 17.2个月)及NMPA的批准,安奈克替尼亦被新增为I级推荐。
上调瑞普替尼为I级推荐: 基于TRIDENT-1研究数据,瑞波替尼已于2024年5月获NMPA批准并纳入医保用于一线治疗。因此,指南将其从去年的III级推荐上调为I级推荐。
后线治疗
新增他雷替尼为I级推荐: TRUST-II研究的后线治疗队列数据显示,泰莱替尼在经治患者中ORR达到62%,中位PFS为9.7个月。基于此数据及NMPA的批准,指南将其新增为后线治疗的I级推荐。
上调瑞普替尼为I级推荐: 基于TRIDENT-1研究的后线治疗数据及NMPA的批准,瑞波替尼亦被上调为后线治疗的I级推荐。
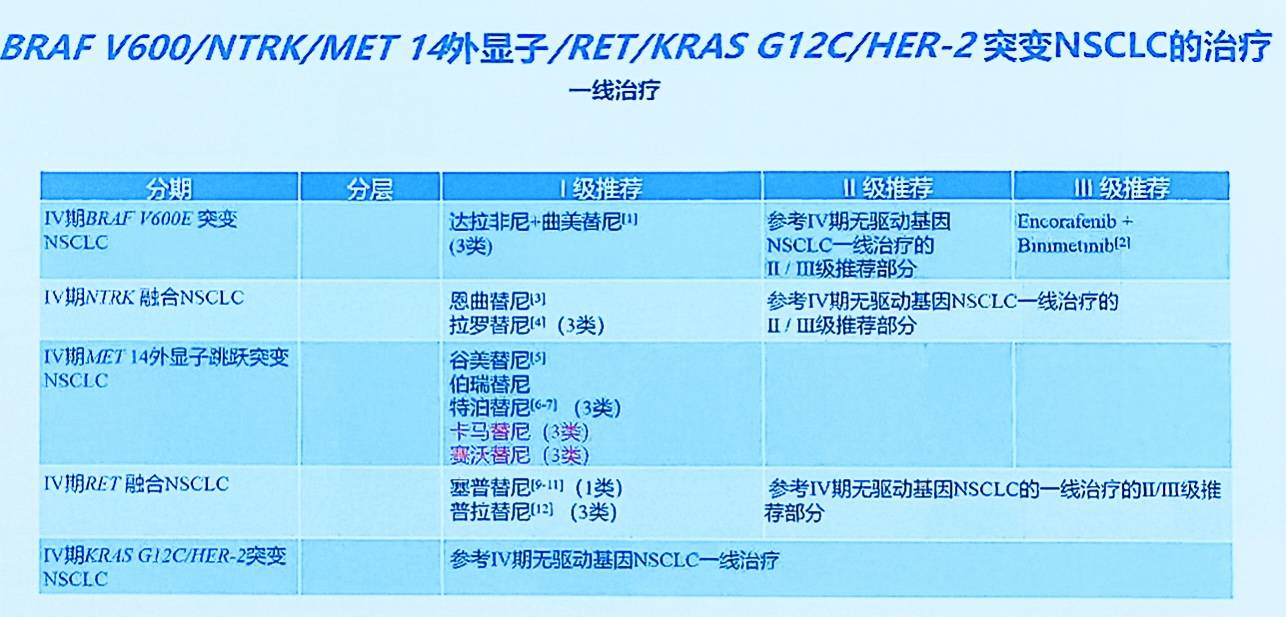
罕见驱动突变NSCLC
MET外显子14跳跃突变(METex14跳突)NSCLC
一线治疗:
上调卡马替尼作为I级推荐。基于METRY mono-1和GeoMETry-C研究结果(一线ORR达68%, mPFS 12.5个月)及2024年6月的NMPA批准,卡马替尼被上调为一线治疗的I级推荐。
上调赛沃替尼为I级推荐:基于其III期确证性临床研究结果(一线ORR 62%, mPFS 13.7个月)及2025年的NMPA批准,赛沃替尼亦被上调为一线治疗的I级推荐。
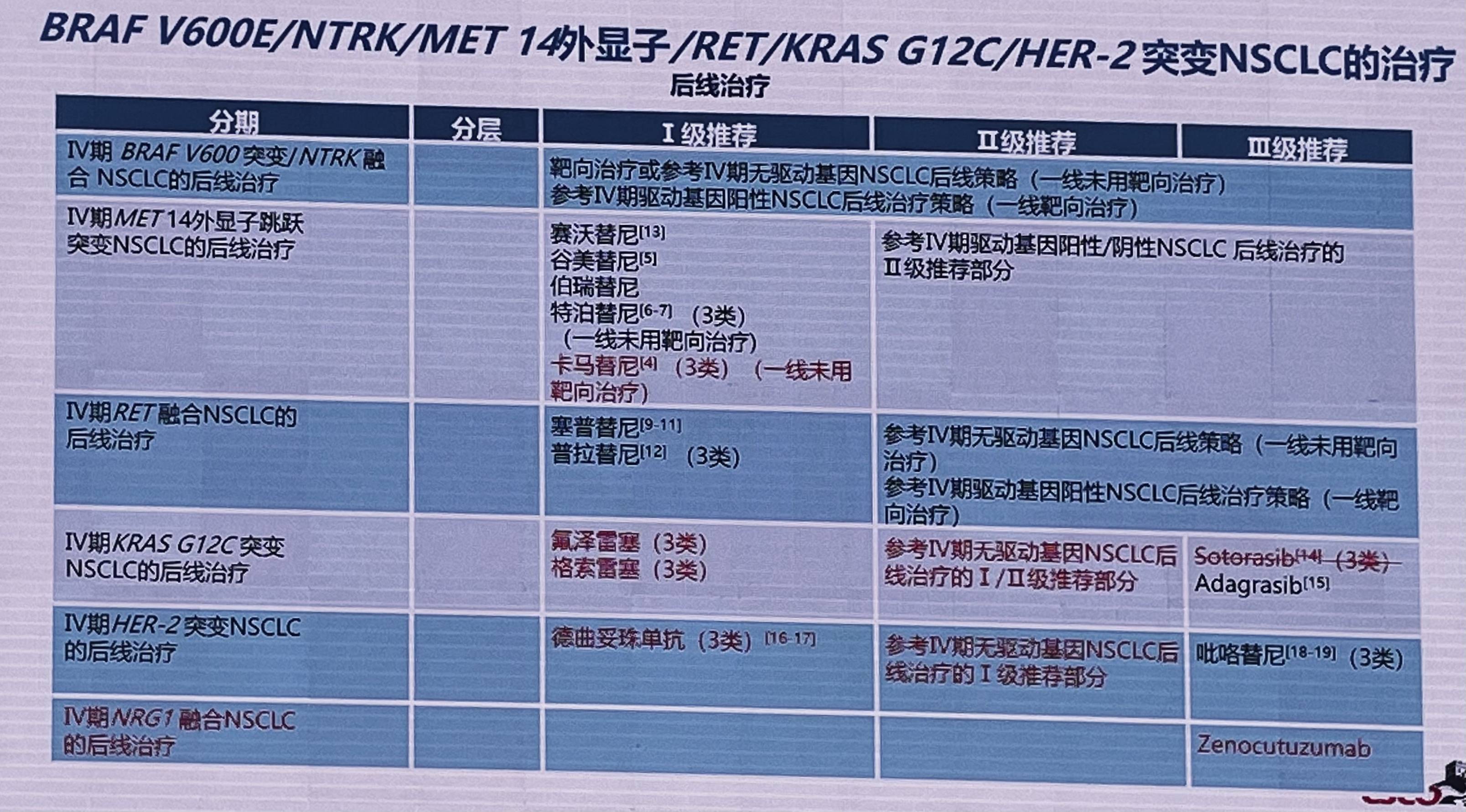
后线治疗:
上调卡马替尼为I级推荐。基于GEOMETRY mono-1研究的后线数据,卡马替尼在METex14跳突患者后线治疗中的推荐级别也相应上调为I级推荐。
KRASG12C突变晚期NSCLC
新增氟泽雷塞为I级推荐: 基于其II期注册研究结果(二线及以上治疗ORR 49.1%, mPFS 9.7个月)及NMPA的批准,氟泽雷塞被新增为后线治疗的I级推荐。
上调格索雷赛为I级推荐: 基于其II期注册研究结果(二线及以上治疗ORR 52%, mPFS 9.1个月, mOS 14.1个月)及NMPA的批准,格索雷赛亦被上调为后线治疗的I级推荐。
数据注释戈来雷塞: 其注册研究也显示了良好数据(ORR 47.9%, mPFS 8.2个月, mOS 13.6个月),但尚未获NMPA批准,故进行数据注释。
HER2突变/过表达NSCLC
HER2突变NSCLC后线治疗:
上调德曲妥珠单抗(T-DXd)为I级推荐。 基于DESTINY-Lung05中国人群研究确认了与全球数据一致的优异疗效(ORR 58.3%)及NMPA的批准,T-DXd被上调为HER2突变NSCLC后线治疗的I级推荐。
数据注释瑞康曲妥珠单抗(SHR-A1811)、Zongertinib以及BAY2927088。瑞康曲妥珠单抗在经治的不可切除或转移性HER2突变NSCLC后线治疗中展现的良好疗效(ORR 为73.4%, mPFS 11.5个月,NMPA拟纳入优先评审);Zongertinib(初治ORR 达71%)和BAY2927088(初治ORR 72%,获FDA/NMPA突破性疗法认定)的早期临床数据。
HER2过表达(IHC 3+)NSCLC:
数据注释T-DXd。基于DESTINY-Lung03研究(评估T-DXd 5.4 mg/kg剂量)结果(HER2过表达患者ORR 44%, mPFS 8.2个月, mOS 17.1个月)及FDA已批准该适应症(包括NSCLC),由于目前NMPA尚未批准,指南故对其进行数据注释。
NRG1融合阳性晚期NSCLC
新增Zenocutuzumab为后线治疗III级推荐: Zenocutuzumab是一种靶向HER2/HER3的双特异性抗体。一项国际多中心II期研究(eNRGy)评估了其在NRG1融合阳性实体瘤(包括NSCLC)中的疗效。NSCLC队列结果显示,ORR为29%,mPFS为6.8个月,中位缓解持续时间(DoR)为12.7个月。基于该研究及FDA已批准该适应症,指南新增Zenocutuzumab作为NRG1融合阳性NSCLC后线治疗的III级推荐。
排版编辑:肿瘤资讯-Nydia
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


