目前,激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2−)早期乳腺癌 (EBC) 患者的标准治疗包括使用芳香化酶抑制剂 (AI) 或他莫昔芬 (TAM) 进行辅助内分泌治疗。为了进一步探讨AI 与 TAM 对 HR+/HER2- EBC 患者的疗效,研究人员进行了一项荟萃分析[1],其结果于近期发表于The Breast上。【肿瘤资讯】在此进行整理,以飨读者。
研究背景
HR+/HER2−乳腺癌是EBC最常见的亚型[2]。HR+/HER2− EBC患者的治疗标准包括至少5年的辅助内分泌治疗(ET)[2,3]。历史上,TAM是首个广泛用于辅助治疗的内分泌治疗药物;随后AI类药物(如阿那曲唑、来曲唑和依西美坦)的引入和批准,最终促使治疗指南推荐绝经后患者使用AI或TAM,而绝经前HR+/HER2− EBC患者一般使用AI联合卵巢功能抑制(OFS)或TAM±OFS。
选择AI还是TAM作为辅助内分泌治疗取决于复发风险、疾病特征、绝经状态和患者偏好等因素。真实世界研究显示,两类药物的治疗模式因地区而异,通常AI占ET初始治疗的大部分[4-7]。AI和TAM的应用模式也因绝经状态不同而存在差异,绝经前患者中使用TAM的比例更高。然而,随着时间的推移,绝经前患者中AI的使用呈增加趋势,OFS的应用也逐步增多,尤其在复发风险较高的患者中[8]。
在HR+绝经后患者中,与TAM相比,AI可降低复发率[9]。针对绝经前患者的临床试验表明,AI联合OFS相比TAM联合OFS或单用TAM更具获益[10,11]。此外,基于随机临床试验(RCTs)患者个体数据的荟萃分析支持AI在降低绝经后患者复发方面优于TAM[12]。对于绝经前患者,类似的荟萃分析显示,AI联合OFS在降低复发风险方面优于TAM联合OFS[13]。这些荟萃分析纳入了所有HR+ EBC患者(无论HER2状态),因此包含HER2阳性和阴性患者[12,13]。本研究聚焦HR+/HER2− EBC患者,开展了一项AI±OFS对比TAM±OFS的试验级荟萃分析。
研究方法
研究人员通过检索主要医学文献数据库(例如PubMed;从建库至2023年10月)和会议数据(截至2023年12月),进行了一项系统性文献综述。纳入荟萃分析的研究为报告了AI与TAM对比的无病生存(DFS)风险比的3期随机对照试验(RCTs),这些研究中至少80%的患者为HR+/HER2− EBC患者(或有可用的亚组数据),无论患者的绝经状态和是否使用OFS。我们采用通用不变性方法计算DFS风险比的汇总效应估计值及95%置信区间(CI),进行了基础分析(所有RCTs),并针对仅使用非甾体芳香化酶抑制剂(NSAI)、绝经前患者和绝经后患者的RCTs进行了场景分析。
研究结果
系统性文献综述
通过系统性文献检索共获得136项研究,从中筛选出5项RCTs(SOFT、HOBOE、BIG 1–98、N-SAS BC03及NCT01352091)纳入荟萃分析(表1)。
表1
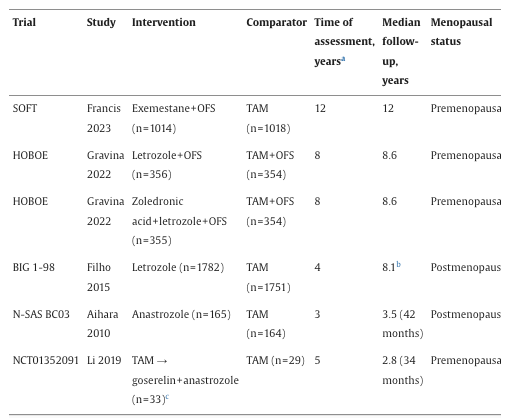
HOBOE试验包含两个AI治疗组(来曲唑+OFS;或唑来膦酸+来曲唑+OFS)与TAM+OFS的对比,每个AI组均独立进行比较。NCT01352091试验中,患者先接受2–3年TAM治疗,随后随机分配至阿那曲唑+戈舍瑞林组或继续TAM组(总治疗时长为5年)。需注意的是,TEXT试验未纳入本次荟萃分析,因其已发表数据与SOFT试验合并,故不符合系统性文献综述的纳入标准。
在5项RCTs中,3项针对绝经前患者,2项针对绝经后患者(表1)。非甾体类AI(4项试验)为最常用的TAM对照药物。5项试验共纳入7138例患者,中位随访时间为2.8–12年:SOFT(12年)、HOBOE(AI组均为8.6年)、BIG 1–98(8.1年)、N-SAS BC03(3.5年)及NCT01352091(2.8年)。
荟萃分析:基础案例与情景分析
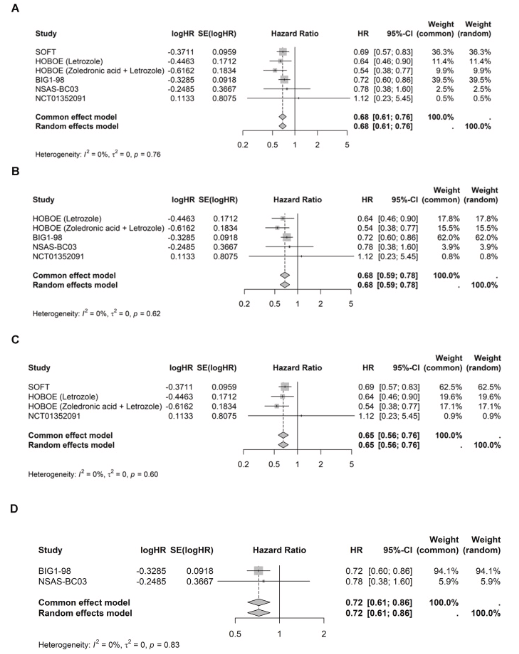
在基础案例与情景分析中,异质性指数I²=0表明无显著异质性,因此固定效应模型(FEM)与随机效应模型(REM)结果一致。基础案例分析(纳入全部5项RCTs)显示,与TAM±OFS相比,AI±OFS显著改善DFS,合并风险比为0.68(95%CI:0.61–0.76;P<0.0001)(图1A),对应复发或死亡风险降低32%。针对仅纳入非甾体类AI(NSAI)研究(HOBOE、BIG 1–98、N-SAS BC03及NCT01352091)的情景分析结果与基础案例一致,NSAI±OFS显著优于TAM±OFS(合并风险比=0.68,95%CI:0.59–0.78;P<0.0001)(图1B)。
在仅包含绝经前患者的研究(SOFT、HOBOE及NCT01352091)中,AI+OFS组的DFS显著优于TAM±OFS组(合并风险比=0.65,95%CI:0.56–0.76;P<0.0001)(图1C)。针对绝经后患者的研究(BIG 1–98与N-SAS BC03)同样显示AI对比TAM的DFS获益,合并风险比为0.72(95%CI:0.61–0.86;P=0.001)(图1D)。
敏感性分析
将TEXT试验数据(与SOFT试验数据合并)纳入所有基线研究后,结果仍保持一致,支持AI±OFS的疗效优势。固定效应模型(合并风险比=0.74;95%CI:0.67–0.81)与随机效应模型(合并风险比=0.72;95%CI:0.64–0.82)均显示相似结果,异质性为I²=2%(表2)。在仅纳入绝经前患者的情景分析中(含TEXT数据),固定效应与随机效应模型结果一致(合并风险比=0.77;95%CI:0.69–0.85),异质性I²=0。
表2

研究结论
本荟萃分析比较了AI联合OFS与TAM联合OFS的疗效,分析了5项试验中发表的DFS数据。因这些试验中总生存期(OS)数据有限,故未纳入分析。结果显示,与TAM±OFS相比,AI±OFS可降低复发风险,这一结果在基础分析、仅使用NSAI的治疗方案,以及绝经前和绝经后患者中均一致。这些发现与先前的分析一致,进一步支持AI较TAM在辅助治疗HR+/HER2− EBC上或可更为有效。
[1]Janni W, Untch M, Harbeck N, et al. Systematic literature review and trial-level meta-analysis of aromatase inhibitors vs tamoxifen in patients with HR+/HER2− early breast cancer. The Breast. 2025;81(6):104429.
[2] N. Howlader, S.F. Altekruse, C.I. Li, V.W. Chen, C.A. Clarke, L.A. Ries, K.A. Cronin.US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status.J Natl Cancer Inst, 106 (5) (2014), Article dju055.
[3]B. Pistilli, C. Lohrisch, J. Sheade, G.F. Fleming.Personalizing adjuvant endocrine therapy for early-stage hormone receptor-positive breast cancer.Am Soc Clin Oncol Educ Book, 42 (2022), pp. 1-13.
[4]H. Zhao, X. Lei, J. Niu, N. Zhang, Z. Duan, M. Chavez-MacGregor, S.H. Giordano.Prescription patterns, initiation, and 5-Year adherence to adjuvant hormonal therapy among commercially insured patients with breast cancer.JCO Oncology Practice, 17 (6) (2021), pp. e794-e808.
[5]N. Gremke, S. Griewing, S. Chaudhari, S. Upadhyaya, I. Nikolov, K. Kostev, M. Kalder.Persistence with tamoxifen and aromatase inhibitors in Germany: a retrospective cohort study with 284,383 patients.J Cancer Res Clin Oncol, 149 (8) (2023), pp. 4555-4562.
[6]A.R. Ferreira, A. Palha, L. Correia, P. Filipe, V. Rodrigues, A. Miranda, et al.
Treatment adoption and relative effectiveness of aromatase inhibitors compared to tamoxifen in early breast cancer: a multi-institutional observational study.Breast, 37 (2018), pp. 107-113.
[7]C. Criscitiello, D. Spurden, A. Rider, R. Williams, M. Corsaro, J. Pike, E.H. Law
82P A multinational study of real-world treatment patterns among patients with early stage HR+/HER2- breast cancer (BC), vol. 31, Ann Oncol (2020), pp. S42-S43.
[8] H. Record, E. Clelland, H.T. Rothschild, M. Kaur, A.J. Chien, M. Melisko, et al.
Tamoxifen or aromatase inhibitors with ovarian function suppression in pre-menopausal stage I-III lobular breast cancer.npj Breast Cancer, 9 (1) (2023), p. 88.
[9]A. HowellATAC trial update.Lancet, 365 (9466) (2005), pp. 1225-1226.
[10]O. Pagani, M.M. Regan, B.A. Walley, G.F. Fleming, M. Colleoni, I. Láng, et al.
Adjuvant exemestane with ovarian suppression in premenopausal breast cancer.N Engl J Med, 371 (2) (2014), pp. 107-118.
[11]P.A. Francis, O. Pagani, G.F. Fleming, B.A. Walley, M. Colleoni, I. Láng, et al.
Tailoring adjuvant endocrine therapy for premenopausal breast cancer
N Engl J Med, 379 (2) (2018), pp. 122-137.
[12]M. Dowsett, J. Cuzick, J. Ingle, A. Coates, J. Forbes, J. Bliss, et al.
Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen.J Clin Oncol, 28 (3) (2010), pp. 509-518.
[13]R. Bradley, J. Braybrooke, R. Gray, R.K. Hills, Z. Liu, H. Pan, et al.Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials.Lancet Oncol, 23 (3) (2022), pp. 382-392.
审批码:KIS0044388
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


