由中国临床肿瘤学会(CSCO)与北京市希思科临床肿瘤学研究基金会联合主办的2025年CSCO指南大会于4月18日至19日在济南山东大厦隆重举行。4月19日下午,非小细胞肺癌(NSCLC)诊疗专场如期召开,吸引了全国肺癌领域顶尖专家学者参与。
专场会议由中国医学科学院肿瘤医院山西医院王洁教授、上海市东方医院周彩存教授和吉林省肿瘤医院程颖教授主持,中国医学科学院肿瘤医院段建春教授对“早期/局晚期/驱动基因阴性晚期非小细胞肺癌指南更新要点”进行了系统解读。新版指南基于最新循证医学证据,为临床实践提供了权威指导。
作为中国肺癌诊疗的风向标,CSCO指南的年度更新持续推动规范化与个体化治疗,为临床实践提供重要参考。本次会议通过多学科视角,深入探讨早中期及晚期NSCLC的诊疗优化,助力患者长期生存获益。

分子分型部分
对于可手术I-III期NSCLC
新增“术后IB期非鳞NSCLC进行EGFR突变检测,指导辅助靶向治疗”作为I级推荐。这项调整基于III期ADAURA研究,奥希替尼术后辅助治疗IB-ⅢA期EGFR突变阳性NSCLC,DFS及OS显著获益,HR分别为0.20和0.49。
对于不可手术III期及IV期NSCLC
上调“术后IB/II/III期NSCLC进行ALK融合检测,指导辅助靶向治疗”作为I级推荐。这项调整基于ALINA研究阳性结果。NMPA于2024年7月5日批准阿来替尼新适应证上市,用于ALK阳性NSCLC患者肿瘤完全切除后术后的辅助治疗。
上调“对于非鳞NSCLC组织样本,进行HER2突变检测”作为I级推荐。
新增/shangtiao“HER-2免疫组化过表达检测”作为III级推荐。这项调整基于NCCN指南推荐德曲妥珠单抗用于经治HER2 IHC 3+NSCLC。
新增“采用NGS 技术检测 NRG1融合”作为III级推荐。2024年12月4日,FDA批准HER2和HER3双特导性抗体Zenocutuzumab上市,用于治疗接受系统治疗中或治疗后疾病出现进展的携带神经调节蛋白1(NRG1)基因融合的晚期、不可切除或转移性胰腺癌或非小细胞肺癌(NSCLC)成年患者。
新增注释:“肿瘤标本无法获取或量少无法检测时,可采用外周血循环肿瘤DNA(ctDNA)行MET14外显子跳跃突变检测;*相应临床研究入组患者时均采用UICC/AJCC TNM第七版肺癌分期标准,lb期纳入为T≥4cm患者”

早/中期原发性NSCLC的治疗(可手术)
可手术IA、IB期NSCLC的治疗部分
新增“IB期适宜手术患者,根治性手术且术后检测为EGFR敏感突变阳性患者,术后奥希替尼辅助治疗”作为I级推荐;
新增注释:奥希替尼辅助治疗推荐3年;
删除:术后奥希替尼辅助治疗中“辅助化疗”的限定
上述调整基于奥希替尼术后辅助治疗IB-ⅢA期EGFR突变阳性NSCLC的ADAURA研究。基于该研究,奥希替尼于分别于2020年12月18日和2021年4月8日被FDA和NMPA批准用于EGFR敏感突变的IB-IIIA期NSCLC患者术后辅助治疗。

可手术IIA、IIB期NSCLC的治疗部分
上调“根治性手术且术后检测为ALK融合患者,术后阿来替尼辅助治疗”作为I级推荐。
上调“含铂化疗联合帕博利珠单抗/替雷利珠单抗/度伐利尤单抗新辅助+辅助治疗”作为I级推荐。
上调“新辅助含铂化疗联合纳武利尤单抗治疗后的纳武利尤单抗辅助治疗”作为 II级推荐。

可手术IIIA、IIIB期NSCLC的治疗部分
上调“根治性手术且术后检测为ALK融合患者,术后阿来替尼辅助治疗”作为I级推荐。该调整基于ALINA研究,阿来替尼 vs. 化疗术后辅助治疗可切除IB-ⅢA期ALK+NSCLC,II-IIIA期人群mDFS:NR vs. 44.4个月,HR=0.24;IB-IIIA期人群mDFS:NR vs. 41.3个月,HR=0.24。基于ALINA研究,FDA于2024年4月18日常规批准,NMPA于2024年6月28日常规批准阿来替尼用于ALK阳性的IB期-IIIA期NSCLC惠者术后辅助治疗。
上调“含铂化疗联合帕博利珠单抗/替雷利珠单抗/度伐利尤单抗新辅助+辅助治疗”作为I级推荐。该调整基于KEYNOTE-671研究亚组数据(帕博利珠单抗+化疗 vs. 化疗用于II-IIIB期NSCLC围术期治疗,mEFS:47.2 vs. 18.3个月,HR=0.59, mOS:NR vs. 52.4个月,HR=0.72)、RATIONALE-315研究数据(替雷利珠单抗+化疗用于可切除II-IIIA期NSCLC围术期治疗,MPR:56.2% vs.15.0%,mEFS: NR vs. NR,HR=0.56)以及AEGEAN第二次期中分析数据(度伐利尤单抗+化疗 vs. 化疗用于IIA-IIIB期NSCLC围术期治疗,mEFS:NR vs. 30.0个月 HR=0.69,pCR: 17.2% vs 4.3%)。
上调“含铂化疗联合纳武利尤单抗新辅助+辅助治疗”作为II级推荐。该调整基于CheckMate 77T更新EFS数据(纳武利尤单抗+化疗 vs. 化疗用于可切除II-IIIB期NSCLC围术期治疗,mEFS:40.1 vs. 17.0个月,HR=0.59;pCR:25.3% vs. 4.7%;MPR:35.4% vs. 12.1%)、CheckMate 816研究4年数据更新(纳武利尤单抗联合化疗持续显示生存获益,4年EFS率达49%,4年0S率达到71%)以及IMpowver 010研究5年数据更新(阿替利珠单抗辅助治疗持续显示生存获益,5年DFS率达到53.2%,5年0S率达74.8%)。
更新注释:新辅助治疗部分,增加CheckMate 816研究4年更新数据;辅助治疗部分,增加IMpower 010研究5年更新数据。

不可手术IIIA/IIIB/IIIC期NSCLC的治疗
新增“奥希替尼作为EGFR(19del/ L858R)突变患者同步或序贯放化疗后的巩固治疗”作为I级推荐。该调整基于LAURA研究,奥希替尼用于III期EGFRm不可切除NSCLC,全球队列PFS:39.1 vs. 5.6个月;中国队列PFS:NR vs. 3.7个月。
新增“分子检测为EGFR敏感突变型,阿美替尼作为同步或序贯放化疗后的巩固治疗”作为I级推荐。该调整基于POLESTAR研究,阿美替尼用于III期EGFRm不可切除NSCLC,mPFS30.4 vs. 3.8个月。
新增“度伐利尤单抗作为序贯放化疗后的巩固治疗”作为I级推荐;该调整基于中国主导的随机、双育、国际多中心III期临床研究PACIFIC-5研究,度伐利尤单抗巩固治疗同步或序贯放化疗后无进展的不可切除III期NSCLC惠者,与安慰剂相比,度伐利尤单抗巩固治疗取得有统计学意义和临床意义的PFS改善,mPFS:14.0 vs. 6.5个月,HR=0.75;首次中期分析显示,OS有改善趋势。

驱动基因阴性晚期NSCLC的治疗
驱动基因阴性晚期非鳞NSCLC一线治疗部分(PS=0-1患者)
新增“斯鲁利单抗联合培美曲塞和卡铂一线治疗”作为I级推荐;该推荐基于ASTRUM-002研究,较安慰剂+化疗,斯鲁利单抗联合化疗一线治疗晚期非鳞NSCLC取得PFS和OS显著获益,疾病进展或死亡风险降低45%,达到方案预设的有效标准。
新增“依沃西单抗”作为II级推荐。该推荐基于HARMONi-2研究,依沃西单抗(AK112)vs. 帕博利珠单抗一线治疗PD-L1阳性晚期NSCLC的III期研究,结果显示,IRC评估的mPFS为11.14个月 vs. 5.82个月(HR,0.51;p<0.0001);非鳞亚组PFS HR=0.54。

驱动基因阴性晚期肺鳞癌一线治疗部分(PS=0-1患者)
新增“依沃西单抗”作为II级推荐。该推荐基于HARMONi-2研究,依沃西单抗(AK112)vs. 帕博利珠单抗一线治疗PD-L1阳性晚期NSCLC的III期研究,结果显示,IRC评估的mPFS为11.14个月 vs. 5.82个月(HR,0.51;p<0.0001);鳞癌亚组PFS HR=0.48。

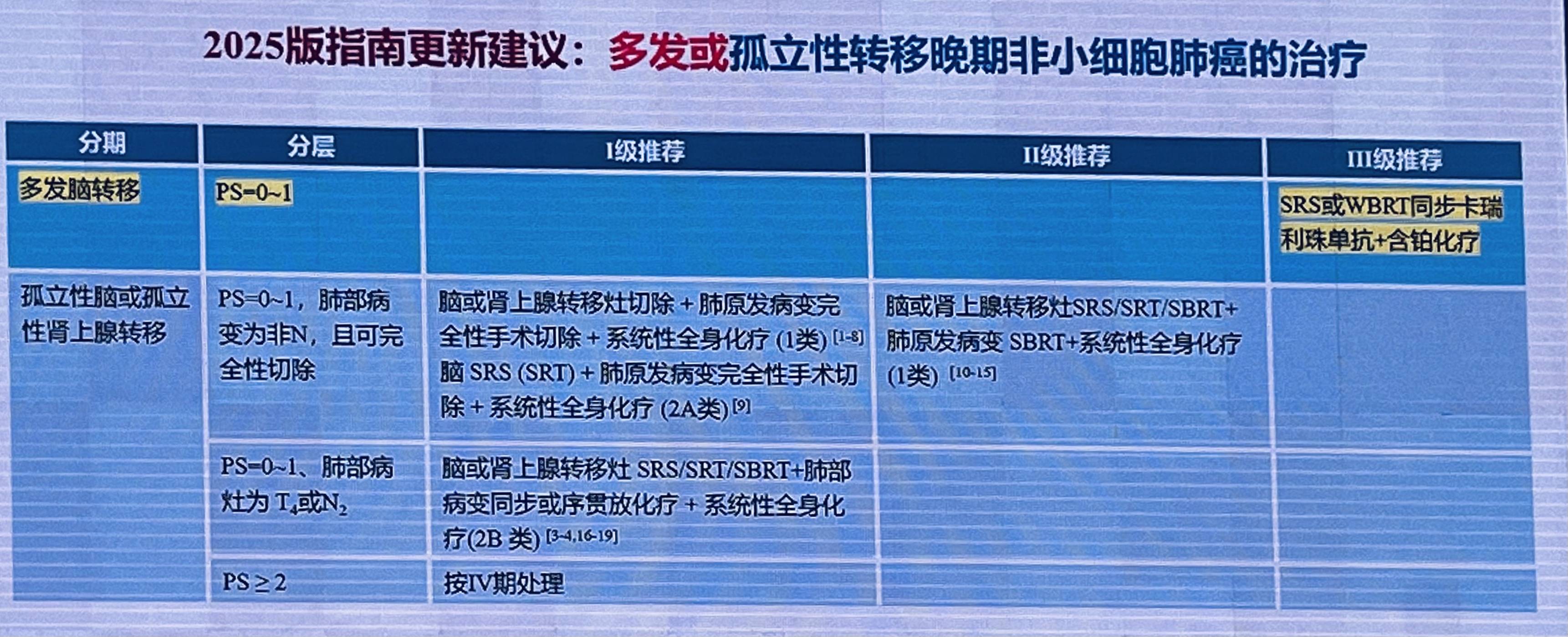
多发或孤立性转移NSCLC治疗
新增“卡瑞利珠单抗联合SRT/BRT及含铂化疗一线治疗驱动基因阴性多发脑转移NSCLC患者”III级推荐。该推荐基于CTONG 2003研究数据,卡瑞利珠单抗联合SRT/BRT及含铂化疗 vs. 安慰剂联合SRT/BRT及含铂化疗的中位iPFS为12.7 vs. 9.9个月,HR=0.45;中位PFS为9.7 vs. 6.7,HR=0.57。
新增“SRT/BRT同步卡瑞利珠单抗及含铂化疗一线治疗驱动基因阴性、合并脑转移NSCLC脑转移患者”作为III级推荐;研究显示,采用该方案可取的6个月PFS率为71.7%(95%C1:58.9%-81.1%);中位PFS为10.7个月(95%CI:7.5-15.7);中位iPFS为16.1个月(95% CI:13.0-NR);中位OS为20.9个月(95%CI:13.8-27.7)。
排版编辑:肿瘤资讯-Nydia











 苏公网安备32059002004080号
苏公网安备32059002004080号


