膀胱癌是全球第9大最常见癌症类型,男性发病率为女性3倍[1]。大多数膀胱癌在早期确诊,但疾病复发和恶化率非常高,根据肿瘤是否侵犯至肌层可分为非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)[2]。NMIBC约占75%,对于高危NMIBC患者,当前的标准治疗是经尿道切除膀胱肿瘤(TURBT) 后给予膀胱内灌注卡介苗 (BCG)。但部分高危NMIBC患者BCG无应答,复发率可达40%-80%,而进展率也为25%-45%,这类患者只能进行根治性膀胱全切术[3]。而MIBC患者推荐的标准治疗仍是以根治性膀胱全切术为主的综合治疗,患者术后生存质量严重下降,亟需更多的治疗手段为患者长期有质量的生存提供支持[4]。随着免疫治疗在尿路上皮癌发挥越来越大的作用,各项研究都在如火如荼的进行着,KEYNOTE-057、SWOG-S1605等研究显示出免疫治疗在NMIBC发挥着较好的抗肿瘤效应[5, 6],而ABLE、PURE-01、ABACUS等研究都显示出免疫治疗在MBIC的优秀疗效[7, 8, 9]。基于此,我们中心设计了一组系列研究(TRUCE-01:MIBC、TRUCE-02:NMIBC),以探索免疫联合治疗在不同阶段尿路上皮癌中的疗效及安全性,旨在为更多不同类型患者提供保留膀胱的策略,为医生提供更佳精准的治方案。
本期特邀专家——胡海龙 教授
泌尿外科副主任,主任医师,博士生导师
美国梅奥诊所及南加州大学访问学者
天津市泌尿外科研究所基因工程实验室 副主任
天津市中西医结合学会泌尿外科专委会 主委
中国中西医结合学会泌尿外科专委会 常务委员
中华医学会泌尿外科专委会机器人学组 委员
中国医疗保健国际交流促进会泌尿男性生殖医学分会 委员
《泌尿外科杂志(电子版)》第五届编辑委员会 常务编委
北京癌症防治学会泌尿肿瘤专业委员会 副主任委员
天津市医师学会泌尿外科专业委员会 委员
天津市抗癌协会肿瘤微创外科专业委员会 委员
天津市医学会医学鉴定分会 委员
TRUCE-01:替雷利珠单抗联合低剂量白蛋白紫杉醇新辅助治疗MIBC的Ⅱ期临床研究
研究设计:
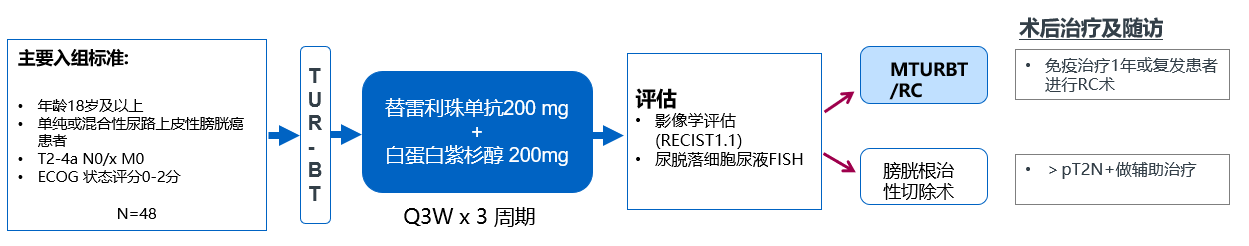
纳入48例患者:年龄18岁及以上, T2-4a N0/x M0单纯或混合性尿路上皮性膀胱癌患者,ECOG 状态评分0-2分。入组患者在第1天静脉注射替雷利珠单抗200mg ,第2天静脉注射白蛋白紫杉醇200mg, 每21天1个周期,共3个周期的治疗。手术治疗在最后一次治疗后2-6周内进行。对于接受mTURBT治疗的患者,推荐最多8个周期化疗和最多1年的替雷利珠单抗(17个周期)治疗。
主要研究终点:cCR, 次要终点包括:安全性、DSS、EFS、OS、MFS、TRAE。
研究结果:
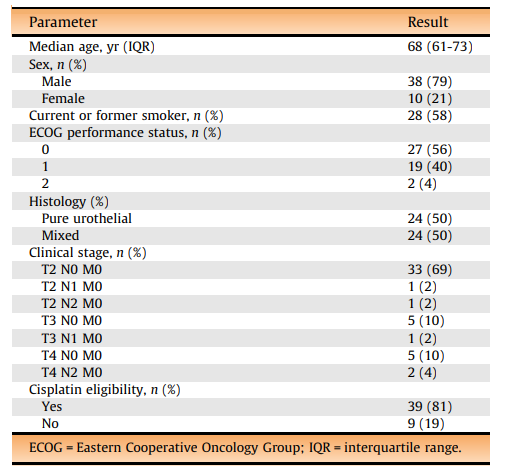
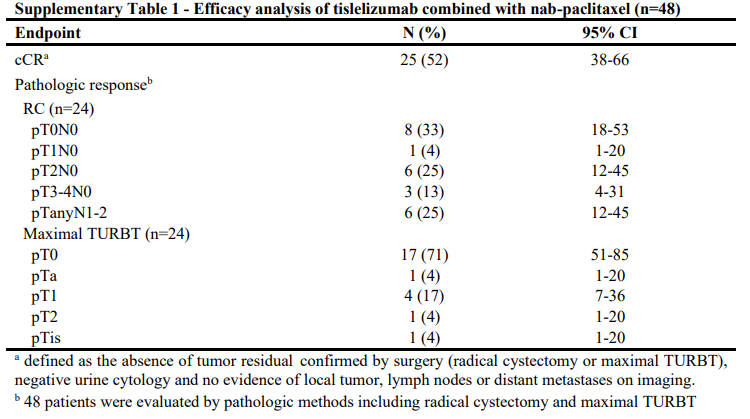
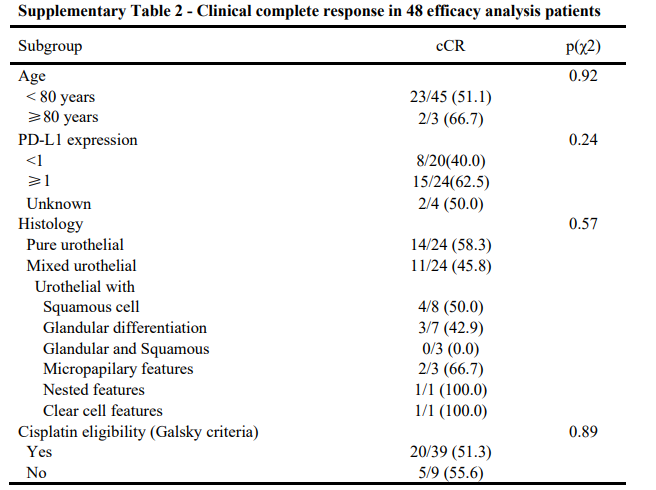
在疗效分析的48例患者中,25例达到cCR ,cCR率为52%
在24/48例(50%)接受mTURBT评估疗效的患者中,17例达到病理T0状态。其余6例患者存在残留pTa (n=1)、pTis (n=1)或pT1 (n=4)疾病,1例存在T2。
在治疗后接受RC术的24例患者中,8例达到pT0N0状态,1例残留pT1N0疾病。cCR在62.5%的肿瘤患者PD-L1表达为21%,40%的肿瘤患者PD-L1表达<1% (p=0.24)。纯尿路上皮组和混合尿路上皮组的cCR无显著差异(58.3% vs 45.8%;p = 0.57)。9例顺铂不合格患者中有5例(55.6%)和20/39例顺铂合格患者(51.3%)达到了cCR (p= 0.89)。
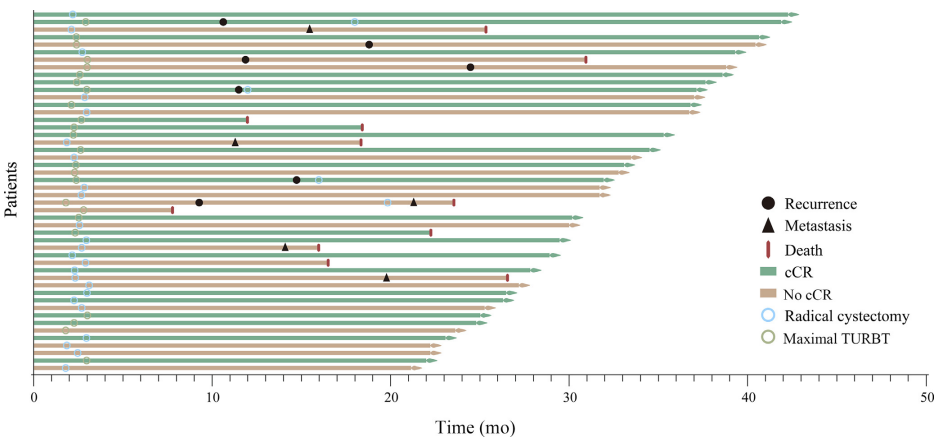
截至数据截止日(2024年1月1日),最新入组患者已随访21个月,中位随访时间为29.2个月。16例患者出现临床事件,包括7例疾病复发,5例转移,11例死亡(5例死于疾病进展,6例死于非疾病相关原因)
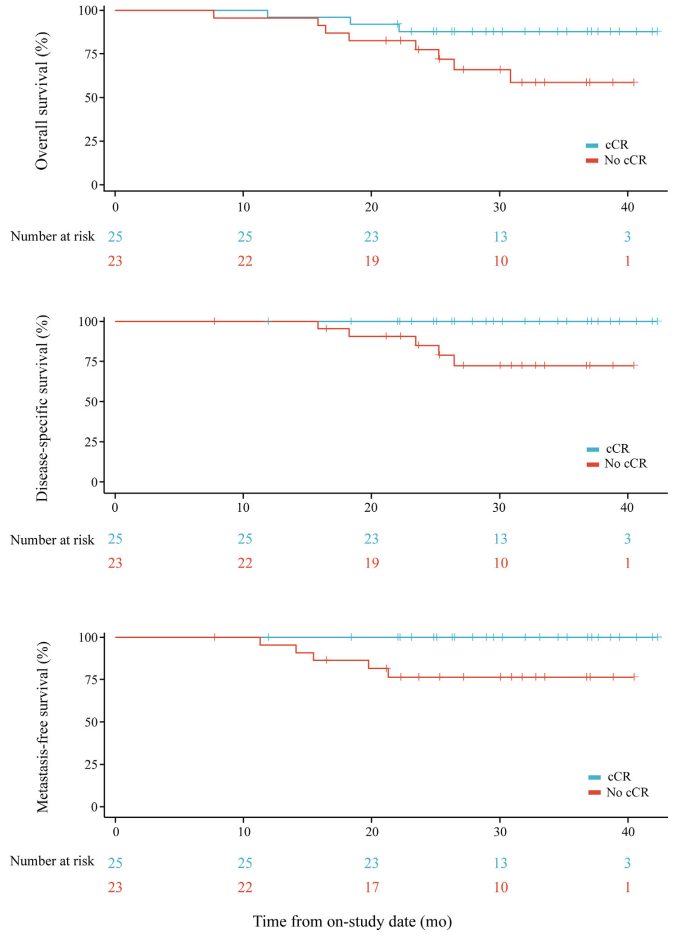
中位EFS和OS未达到,1年EFS和OS率分别为85.4%和95.8%。
cCR组OS优于无cCR组, DSS和MFS显著优于无cCR组。
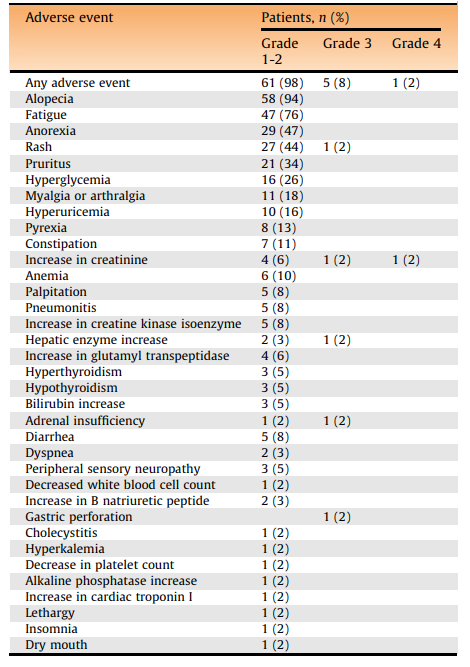
在ITT 人群(n=62)中,61名患者(98%)发生了TRAE,其中6名患者(9.7%)为3-4级。没有与TRAE相关的死亡报告,最常见的TRAE是脱发(94%)、疲劳(76%),厌食症(47%),皮疹(45%),瘙痒(34%)和高血糖症(26%)。3-4级irAE包括肌酐升高(n=2)、皮疹(n=1)、肝酶水平升高(n=1)、肾上腺功能不全(n=1)和胃穿孔(n=1)。在研究期间,17例患者出现2-3期肾损害(GFR<60 ml/min/1.73 m2)
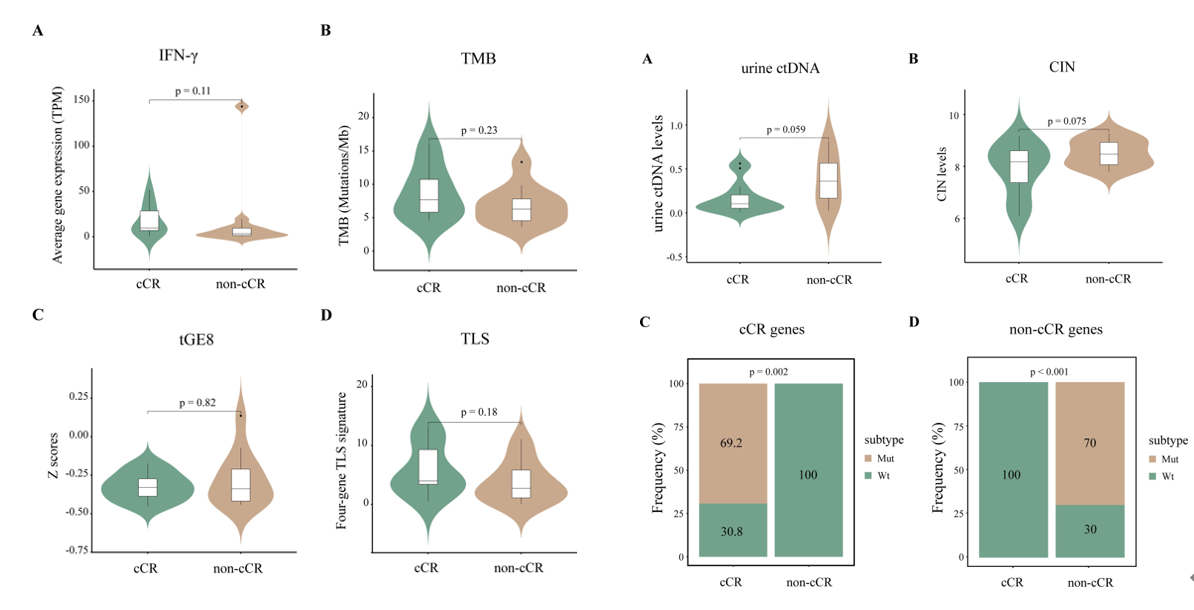 在有效人群中,收集23个基线肿瘤组织和15个治疗后组织进行分析,IFN-y特征(p=0.11)、TMB特征(p=0.245)、tGE8特征(p=0.8213)、TLS特征(p=0.180)均显示在cCR组和non-cCR组间无统计学差异。cCR组尿循环肿瘤DNA水平低于无cCR组,cCR组有降低CIN的趋势,RB1和NCOR2(称为cCR基因)仅在cCR组中存在,而CIC、DDR1、ELF3和MTOR(称为非cCR基因)仅在无cCR组中存在。这些基因在各自组中的突变频率约为70%。
在有效人群中,收集23个基线肿瘤组织和15个治疗后组织进行分析,IFN-y特征(p=0.11)、TMB特征(p=0.245)、tGE8特征(p=0.8213)、TLS特征(p=0.180)均显示在cCR组和non-cCR组间无统计学差异。cCR组尿循环肿瘤DNA水平低于无cCR组,cCR组有降低CIN的趋势,RB1和NCOR2(称为cCR基因)仅在cCR组中存在,而CIC、DDR1、ELF3和MTOR(称为非cCR基因)仅在无cCR组中存在。这些基因在各自组中的突变频率约为70%。
研究结论:
1) 对于经过筛选的合适患者,从新辅助到保膀胱的转化是可行的且前景良好,达到cCR的患者可以实现保留膀胱的长期生存。
2) 目前新辅助治疗向MIBC保膀胱转化存在许多热议点,中国已有两部相关共识发布,仍需更多相关数据进一步指导临床实践。
3) 新辅助免疫治疗为MIBC患者保膀胱带来新局面,替雷利珠单抗引领中国UC新辅助/保膀胱治疗临床实践,为更多医患提供保膀胱的机会和选择。
TRUCE-02:替雷利珠单抗联合白蛋白紫杉醇治疗初治极高危NMIBC患者保膀胱的研究
研究设计:
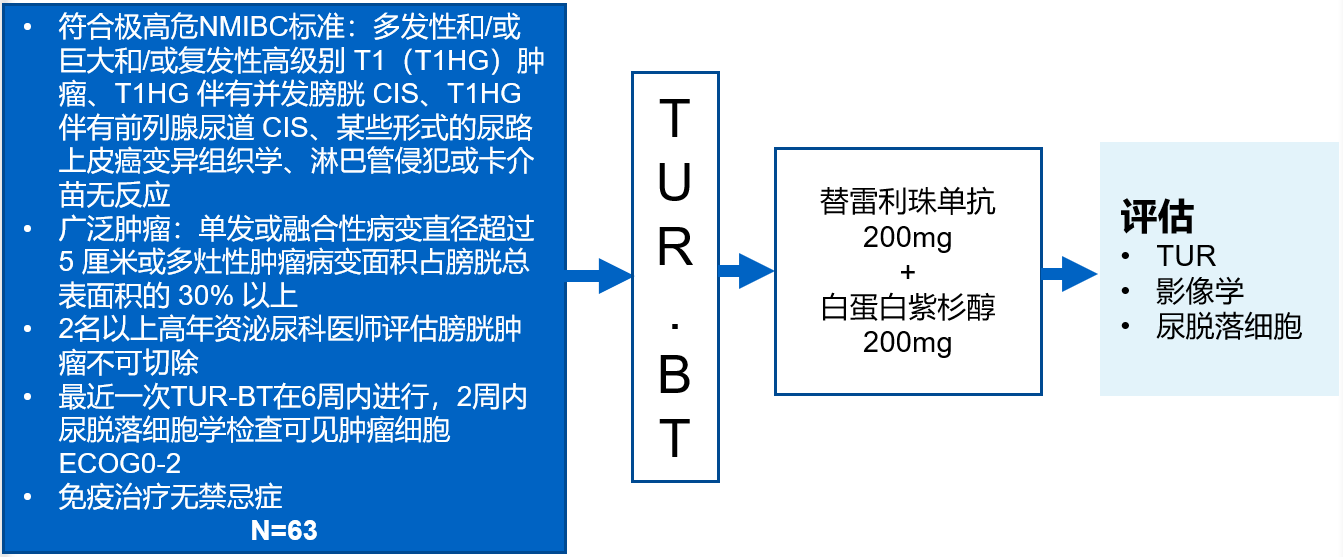
计划纳入63例患者:组织病理学证实为极高危NMIBC(VHR NMIBC),或VHR NMIBC为主要病理组分(>50%)。①患者符合极高危NMIBC标准:多发性和/或巨大和/或复发性高级别 T1(T1HG)肿瘤、T1HG 伴有并发膀胱 CIS、T1HG 伴有前列腺尿道 CIS、某些形式的尿路上皮癌变异组织学、淋巴管侵犯或卡介苗无反应;②广泛肿瘤:单发或融合性病变直径超过 5 厘米或多灶性肿瘤病变面积占膀胱总表面积的 30% 以上;③2名以上高年资泌尿科医师评估膀胱肿瘤不可切除;④最近一次TUR-BT在6周内进行,2周内尿脱落细胞学检查可见肿瘤细胞,ECOG 0-2,免疫治疗无禁忌症。
主要终点:CR;次要终点:CFS、DOR、安全性。
入组患者均在第1天静脉注射替雷利珠单抗200mg,第2天静脉注射白蛋白紫杉醇200mg,每3周1个周期,并在首次给药后约3个月对患者进行初始综合评估。在初始疗效评估中达到CR的患者被推荐最多8个周期白蛋白紫杉醇和最多1年的替雷利珠单抗(17个周期)治疗,或直到疾病复发、进展、不可接受的毒性作用或撤回同意。未达CR的患者停止研究性治疗,并被认为是持续性疾病。
研究结果:
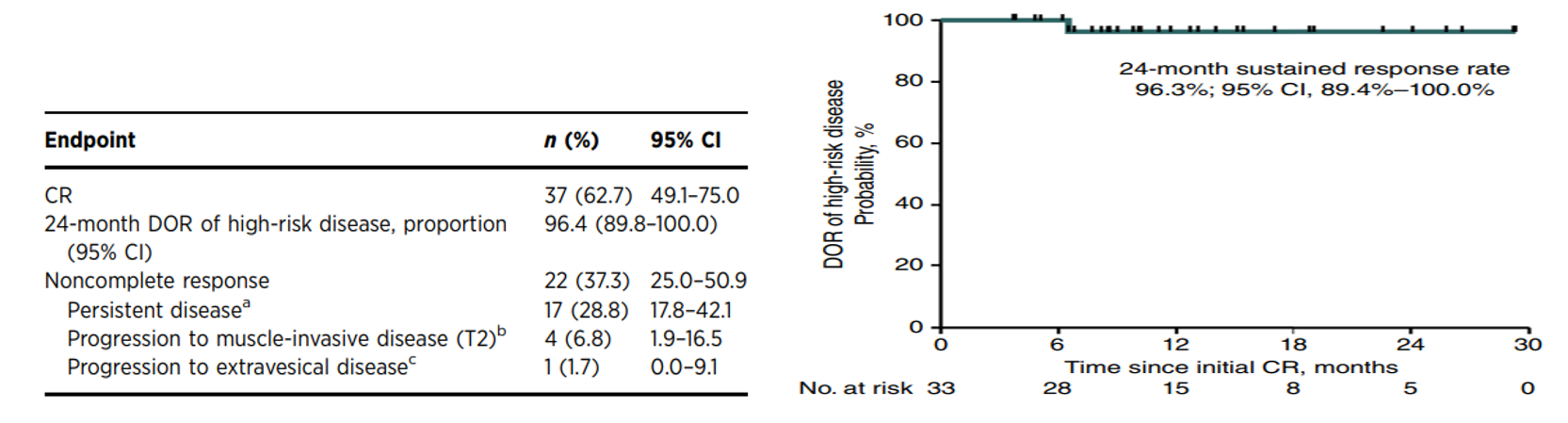 共招募了63名患者,安全性分析包括所有63例患者,疗效分析包括59例患者,中位治疗时间4.8个月,中位给药数为6次。59例疗效分析中,37例达到高风险疾病CR,CR率达62.7%,24个月DOR为96.4%。
共招募了63名患者,安全性分析包括所有63例患者,疗效分析包括59例患者,中位治疗时间4.8个月,中位给药数为6次。59例疗效分析中,37例达到高风险疾病CR,CR率达62.7%,24个月DOR为96.4%。
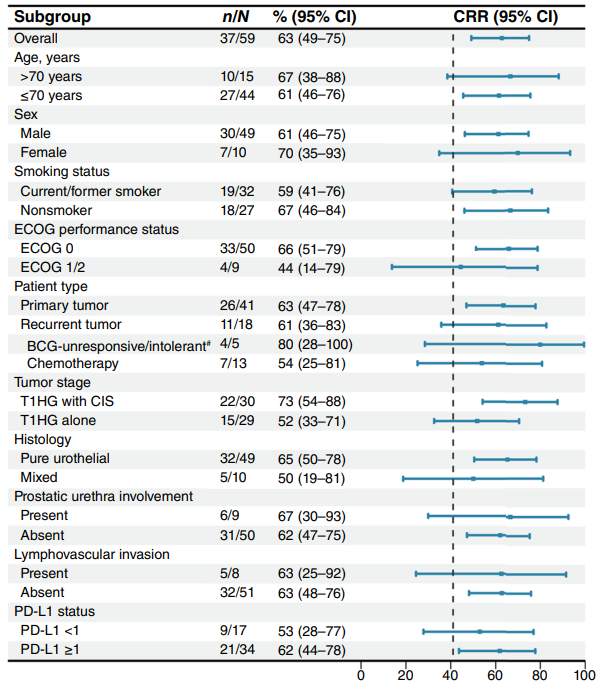
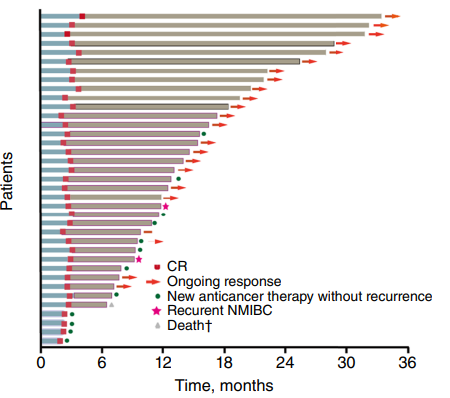
5例BCG无反应或不耐受患者中,4例达到CR。截至数据截止日期,4名BCG无反应性疾病患者中有3名分别达到了CR,持续CR分别为7.7个月、13.1个月和15.4个月。1例BCG不耐受患者,CR持续了18.9个月。在不同分层亚组中观察到一致的CR率。
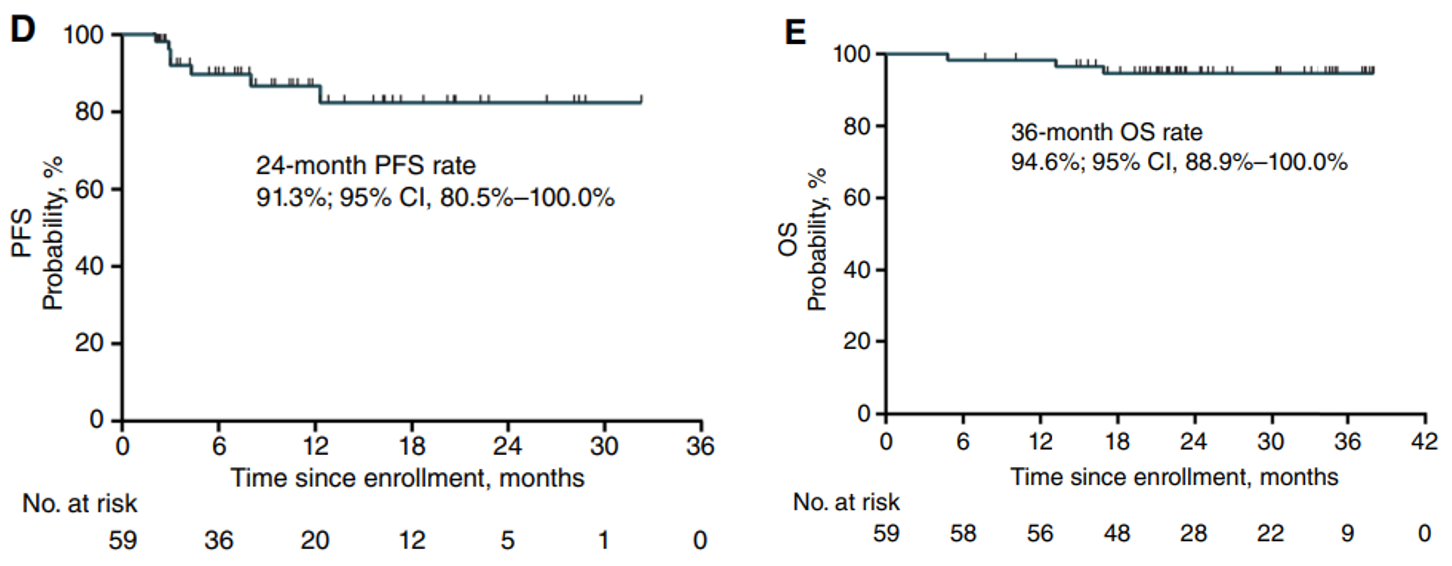
59例患者中,7例(12%)出现疾病进展,未达到mPFS,24个月PFS率为82.4%。截至数据截止日期,3名患者(5%)死亡,mOS未达到,12个月和36个月的OS率为98.3%和94.6%。
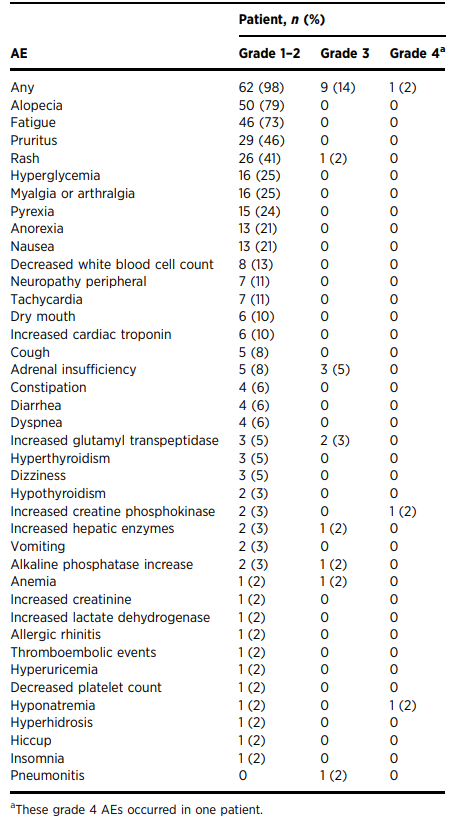
在安全性分析的63例患者中,62例(98%)经历了任何级别的TRAE。 最常见的TRAE包括脱发(79%;50/63)、疲劳(73%;46/63)、瘙痒(46%;29/63)、皮疹(41%;26/63)和高血糖症(25%;16/63)。 9例患者(14%)共经历了12次3至4级TRAE,包括皮疹(1例)、肺炎(1例)、贫血(1例)、肝酶升高(1例)、肾上腺素升高(1例)、肾功能不全(3例)、碱性磷酸酶-谷氨酰转肽酶升高(1例)、低钠血症-肌酸激酶升高-谷氨酰转肽酶升高(1例)3名(5%)患者死于与治疗无关的原因(1名因肿瘤进展,2名因COVID-19)。本研究未进行剂量调整。 然而,共有6名患者(10%)因3至4级TRAE而停止治疗。46例(73%)出现IRAE。 最常见的1级或2级IRAE包括皮肤反应(49%;31/63)和高血糖(25%;16/63)。 8名患者(13%)经历3级IRAE,包括肾上腺功能不全(5%;3/63),肝炎(5%;3/63),皮肤反应(2%;1/63),肺炎(2%;1/63)。 没有4级或5级IRAE的发生。
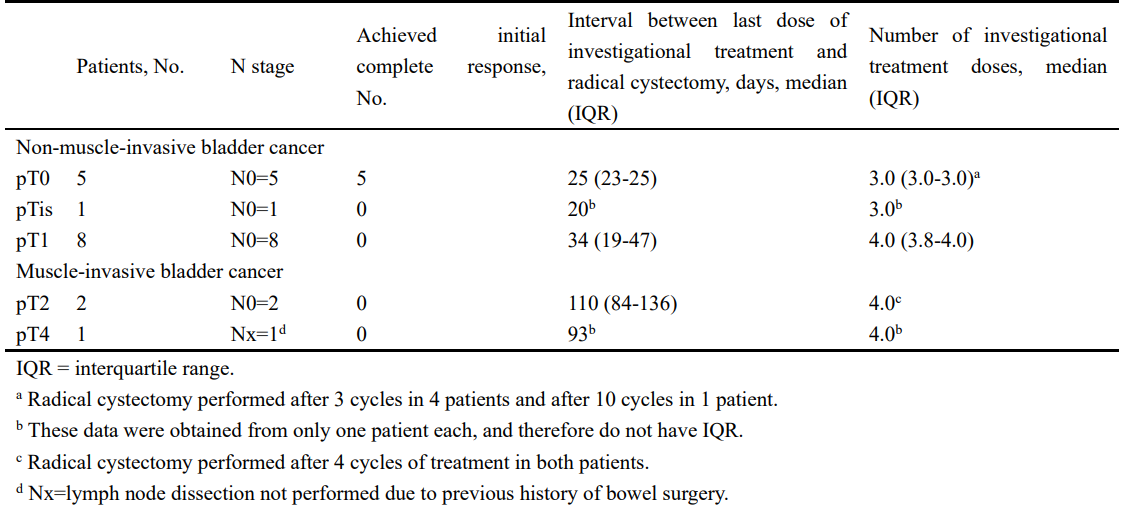
在疗效分析评估的59例患者的后续治疗中,37例(62.7%)为完全缓解,22例(37.3%)为非完全缓解。在37例完全缓解者中,2名患者复发,1名患者死亡。 在22例无应答者中,12例接受了RC术。 在这12例患者中,9例(75%)未表现出病理性升期。其余三名患者(25%)经历了升期:两名患者分别在最后一次研究治疗后84天和136天被诊断为pT2N0,而一名患者在治疗后93天被确定为pT4NxM0状态。
研究结论:
对于灌注失败或有保留膀胱需求的极高危NMIBC患者,亟需新的有效治疗手段。联合治疗模式层出不穷:无论是初治或BCG无应答的高危NMIBC患者,替雷利珠单抗联合方案在保膀胱策略中均显示了良好的疗效和安全性。
文章发表
TRUCE-01:


2022年AUA:口头报告;2024年1月全文发表:European Urology Oncology,IF:8.2,一区。
TRUCE-02:


2022年ASCO:口头报告;2025年1月全文发表:Clinical Cancer Research,IF:11.5,一区。
看到TRUCE-01、02取得了令人惊喜的数据及成绩,我们又陆续开展了TRUCE-03(替雷联合白紫新辅助治疗UTUC)、TRUCE-04(替雷联合RC-48治疗HR-NMIBC),取得了初步理想的数据,并发表在2023年SIU(国际泌尿外科学会)的壁报、2024年EAU(欧洲泌尿外科协会)的口头报告。


接下来我们会根据以往的经验,尤其是研究中存在的不足,改良策略,细化方案,为医生提供更优的治疗策略,为患者提供更多的治疗选择。
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2020 [ J ]. CA Cancer J Clin, 2020,70:7 - 30.
[2] PARK JC, CITRIN DE, AGARWAL PK, et al. Mutimodal management of muscle invasive bladder cancer [J]. Curr Probl Cancer, 2014,38(3) :80 - 108.
[3] SYI. VESTER RJ,VAN DER MEIJDEN AP,OOSTERI.INCK W.et al.Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables:a combined analysis of 2596 patients{rom seven EORTC trials[J].Eur Urol,2006,49(3):466 477
[4] Wifes JA, Bruins FM, Carrion A, et al. European Association of Urology guidelines on muscle-invasive and metastatie bladder cancer: summary of the 2023 guidelines [J]. Eur Urol, 2024, 85:17-31. DOI: 10. 1016/j. eururo. 2023. 08. 016.
[5] Balar AV, Kamat AM, Kulkarni GS, et al. Pembrolizumab monotherapy for the treatment of high-risk non-muscle-invasive bladder cancer unresponsive to BCG (KEYNOTE-057): an open-label, single-arm, multicentre, phase 2 study. Lancet Oncol. 2021 Jul;22(7):919-930.
[6] Black PC, Tangen CM, Singh P, et al. Phase 2 Trial of Atezolizumab in Bacillus Calmette-Guerin-unresponsive High-risk Non-muscle-invasive Bladder Cancer: SWOG S1605. Eur Urol. 2023 Dec;84(6):536-544.
[7] 2020, ASCO-GU, abstract 520
[8] Andrea Necchi, Andrea Anichini, Daniele Raggi, et al. Pembrolizumab as Neoadjuvant Therapy Before Radical Cystectomy in Patients With Muscle-Invasive Urothelial Bladder Carcinoma (PURE-01): An Open-Label, Single-Arm, Phase II Study. J Clin Oncol. 2018 Dec 1;36(34):3353-3360.
[9] Powles T, Kockx M, Rodriguez-Vida A, et al. Clinical efficacy and biomarker analysis of neoadjuvant atezolizumab in operable urothelial carcinoma in the ABACUS trial. Nat Med. 2019 Nov;25(11):1706-1714.
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


