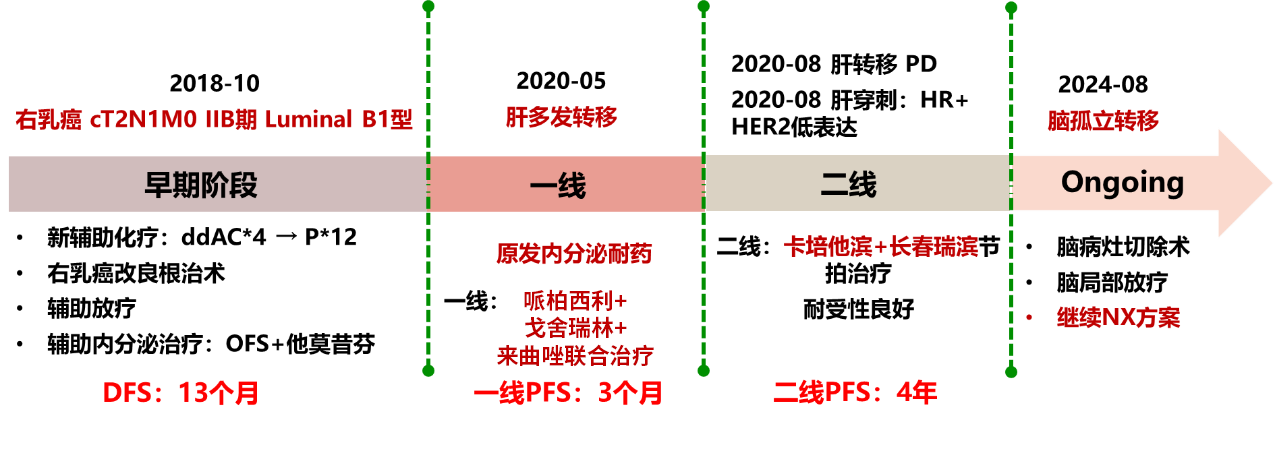
激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2-)乳腺癌是最常见的乳腺癌亚型,约占所有乳腺癌的2/3[1]。内分泌治疗是HR+乳腺癌的主要治疗手段,然而随着治疗时间的延长,30%~50% 的患者会发生内分泌耐药,从而导致肿瘤复发或进展[2]。本期特别分享一例原发内分泌耐药患者的治疗经历。该患者接受新辅助治疗后进行右乳癌改良根治术、辅助放疗及内分泌治疗,无病生存期(DFS)仅13个月。一线治疗给予哌柏西利+戈舍瑞林+来曲唑联合治疗,无进展生存期(PFS)仅3个月;二线治疗给予卡培他滨+长春瑞滨(NX方案)节拍化疗,PFS达4年。后患者出现孤立性脑转移,经多学科诊疗(MDT),予脑病灶切除术,后进行脑局部放疗,并继续NX方案节拍化疗。目前患者病情稳定,一般状态良好。
病例介绍
李女士(匿名),45岁那年,因发现右乳肿物当地就诊。
乳腺彩超:右乳肿物4cm,BIRADS 4B,右腋窝淋巴结肿大,性质待查。行右乳肿物穿刺;
病理:右乳浸润性导管癌,IHC:ER(90%+)、PR(-)、Her-2 (0)、Ki67(40%+)。腋窝淋巴结穿刺提示转移。全身CT未见转移征象。
诊断:右乳浸润性导管癌 cT2N1M0 IIB期 Luminal B1型。
接受新辅助化疗:ddAC*4→P*12(吡柔比星70mg+环磷酰胺800mg q2w→紫杉醇110mg qw)。
疗效评估:部分缓解(PR)。继而接受右乳腺癌改良根治术+腋窝淋巴结清扫术。
病理:右乳肿物3cm,导管原位癌(95%)伴浸润性导管癌2级(5%),浸润性癌细胞ER(20%~40+)、PR(-)、Her-2(1+)、Ki67(10%~20%+);淋巴结转移(3/15)。
术后分期分型:ypT2N1M0 IIB期 Luminal B1型。行辅助放疗(27次,具体放疗部位及剂量不详)、内分泌治疗(戈舍瑞林+他莫昔芬),DFS仅13个月。
2020年5月,于外院行CT复查发现肝内多发肿物及结节(大者5.8*5.2cm),考虑转移瘤。一线治疗给予哌柏西利+戈舍瑞林+来曲唑,3个月后肝转移瘤较前增大(大者7.8*6.6cm),PFS 3个月。
2020年8月李女士至我院就诊,行肝脏穿刺,病理:肝病灶符合乳腺浸润性导管癌转移,IHC:ER约90%(+)、PR(-) 、HER2 (2+)、Ki67热点区域约20%(+)、GATA-3 (+)、GCDFP-15少数(+)、Mammaglobin部分(+)、E-cad (+)、34βE12(+)、CK19(+)、Hep(-)、AFP(-)。HER2 FISH:阴性。
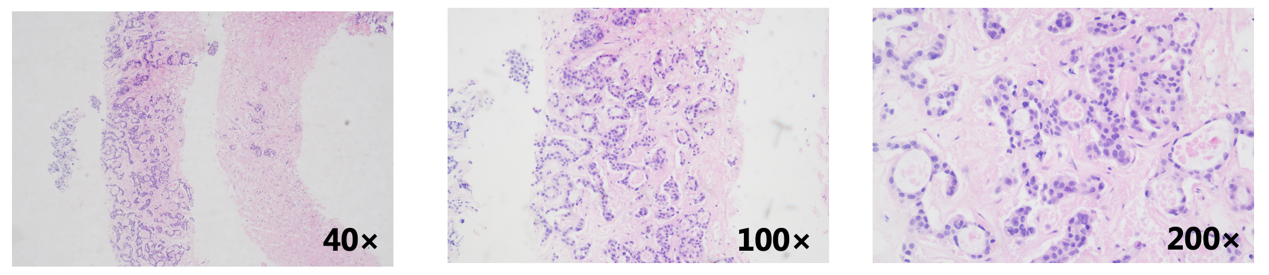
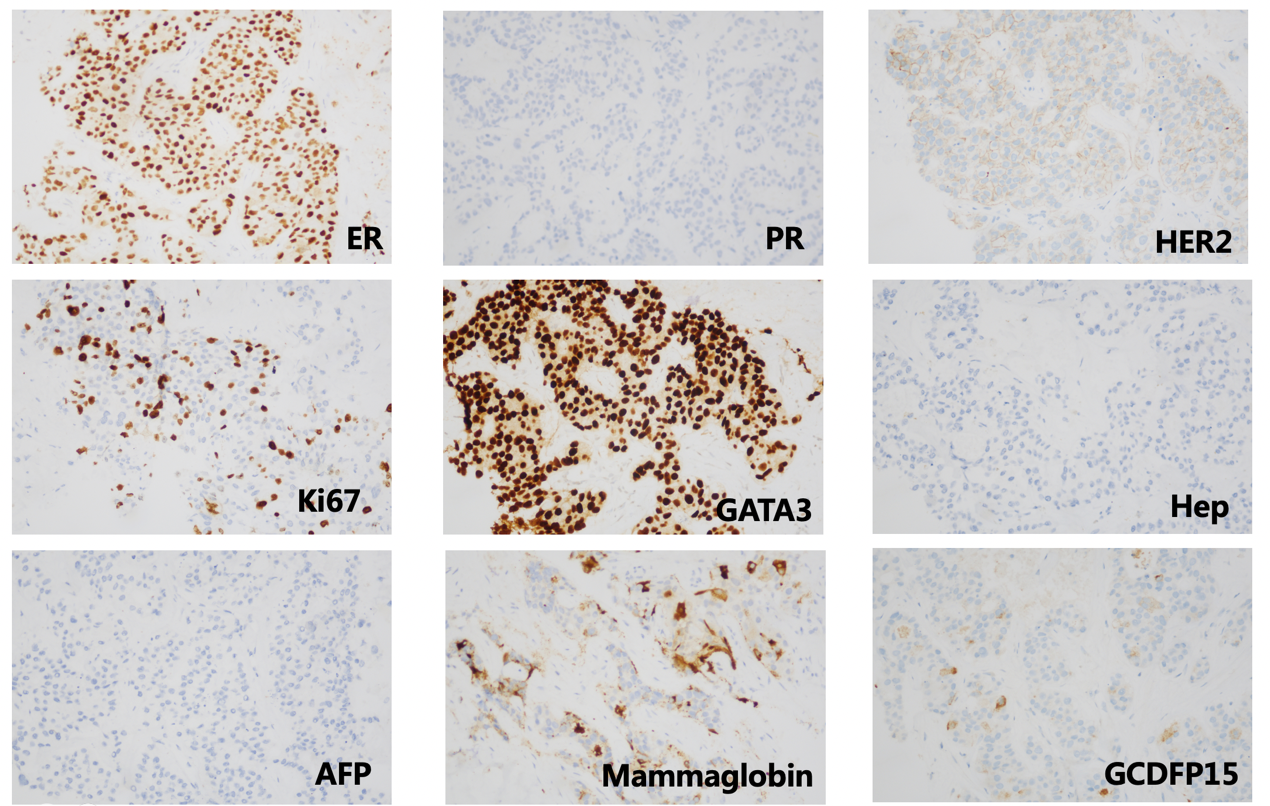
二线治疗
2020-08至今,予NX方案节拍化疗(长春瑞滨软胶囊40mg 每周一、三、五+卡培他滨1g bid)。不良反应轻微(轻度疲乏),耐受性良好。最佳疗效:PR。
PFS:4年。
CT疗效评估:肝转移灶明显减少、缩小
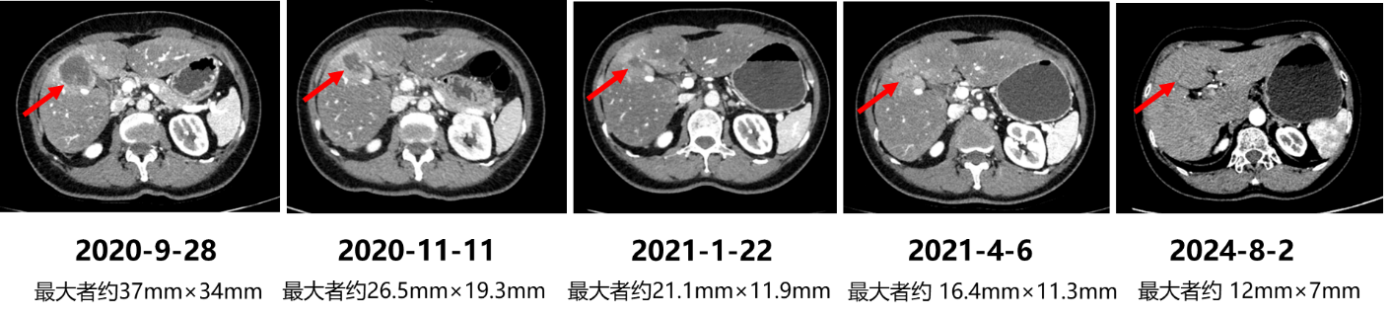
2024年8月,外院复查MR示:左侧颞叶占位(大小约2.5*1.6cm),转移瘤可能 。
2024年8月,我院复查MR示:左侧颞部具强化的结节,考虑转移瘤,脑膜转移与脑实质内转移相鉴别(约 26.5mm×15.5mm)。
2024年8月,我院复查CT示:肝脏病灶较前缩小,较大者1.2*0.7mm,部分结节现显示欠清。
疗效评价:PD。
患者右乳癌术后肝、脑转移,NX治疗期间肝病灶较前明显缩小,新发孤立性脑转移,为了给病人精准治疗方案,联合乳腺内科、放疗科、神经外科等多学科会诊。经MDT讨论,建议:患者出现孤立性脑转移灶,鉴于血脑屏障的存在,药物渗透入脑的效果受限。因此,建议采取脑转移灶切除手术,并在术后对瘤床进行立体定向放疗以巩固疗效。同时,患者的肝转移灶较之前有显著减少和缩小,表明NX治疗方案对外周病灶效果良好,建议继续NX方案治疗,并定期进行疗效评估。
于2024-08行大脑半球病损切除术,病理:符合乳腺浸润性癌转移。IHC: ER(约70%强+)、PR(-)、Her-2(2+)、Ki67(热点区域约80%+)、TROP2(约95%强+)、CK(+)、GATA-3(+)、CA153(+)、TRPS1(+)。HER2 FISH:阴性。
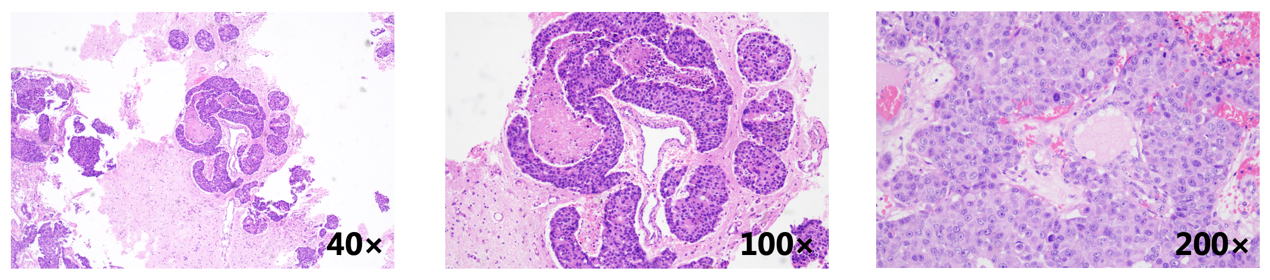
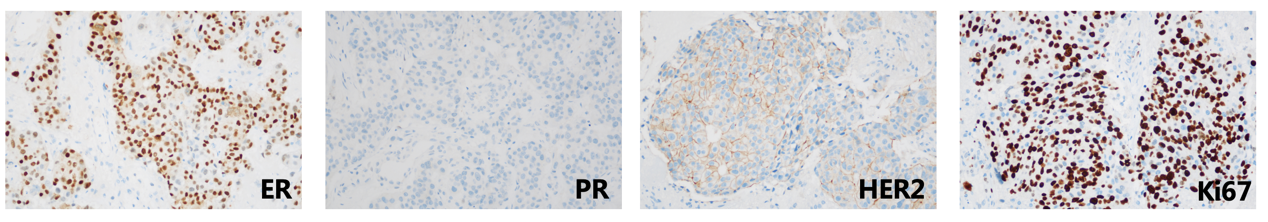
放疗:脑转移瘤SRT 30Gy/5F;
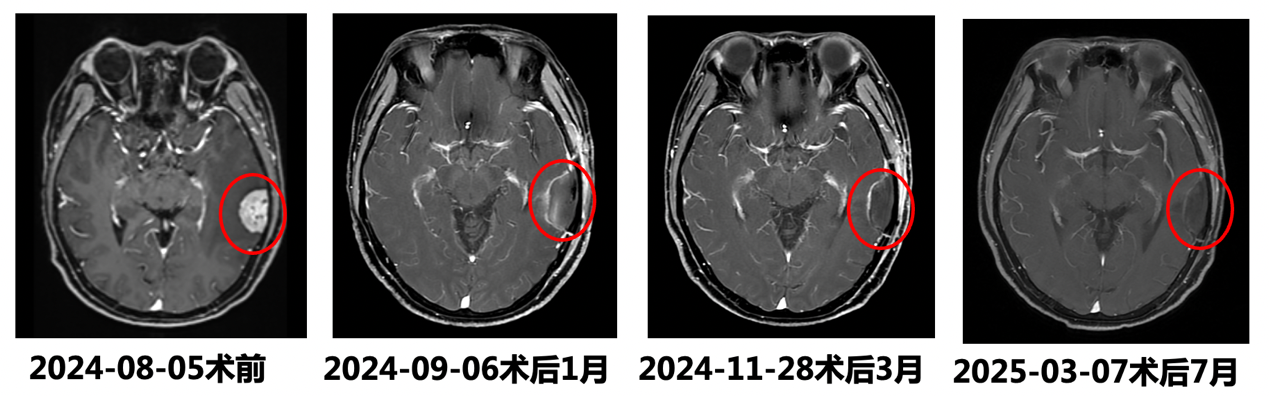
术后1月,复查头颅MR:左侧颞部术后改变,术区残腔形成伴切缘少量出血;术区切缘明显强化,考虑胶质增生与肿瘤残留相鉴别,建议复查。
术后3月及7月,复查头颅MR:左侧颞部术后改变,术区残腔形成,范围大致同前,切缘少量出血,范围较前缩小,其中术区切缘强化,强化范围较前缩小,考虑胶质增生可能,建议继续复查。
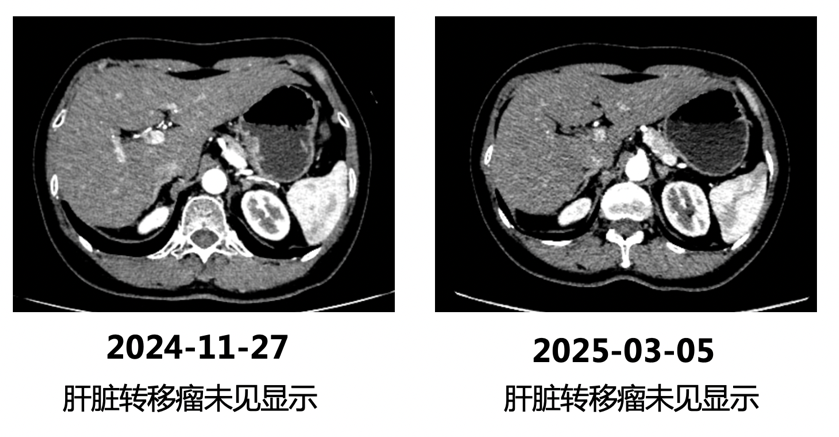
2024年11月及2025年3月,我院复查CT示:肝脏原转移瘤现未见明确显示。疗效CR。
治疗流程图
曾银朵教授:个体化治疗,HR+/HER2-晚期乳腺癌原发内分泌治疗失败后的临床选择
激素受体阳性(HR+)乳腺癌是最常见的乳腺癌亚型,约占全部乳腺癌病例的 60-70%。内分泌治疗是HR+/HER2-乳腺癌的主要治疗手段之一。李女士在病程的早期阶段,依次接受了标准的新辅助化疗、手术、辅助放疗、内分泌治疗,然而,术后仅13个月,病程出现恶化,确诊肝转移。一线接受哌柏西利联合戈舍瑞林及来曲唑,3个月后进展。内分泌治疗原发性耐药指的是患者在辅助治疗阶段≤2年或晚期一线治疗中<6个月即出现病情进展。李女士属于内分泌原发性耐药,经过两种内分泌治疗方案失效,提示患者无法继续从内分泌疗法中获益。
鉴于2020年的药物可获得性,化疗成为首选方案之一。患者已接受蒽环和紫杉类药物治疗后,肝脏出现多发转移灶,疾病负荷大。既往研究数据显示[3], NX方案为既往蒽环和紫杉类耐药的晚期乳腺癌患者提供了长期的疾病控制,达到了长生存。综合评估后,建议李女士采用长春瑞滨联合卡培他滨的口服联合治疗方案。
近几年新药研究发展迅猛,新药获批速度加快,HR阳性乳腺癌内分泌治疗失败后的选择呈现多样化的趋势,包括化疗、PAM通路抑制剂、PARP抑制剂、ADC药物等。
针对晚期乳腺癌患者,建议进行NGS基因检测。如PAM(PI3K/AKT/mTOR )通路异常,可考虑使用 PI3K抑制剂和AKT抑制剂联合内分泌治疗。INOVA120研究[4-5]针对内分泌耐药患者,特别是辅助内分泌治疗期间或结束后12个月内复发的患者。Inavolisib联合哌柏西利和氟维司群显著提高了PIK3CA突变、HR+/HER2-晚期乳腺癌患者的PFS至15.0个月,此方案已获FDA批准治疗相关耐药患者。CAPItello-291研究[6],纳入69% CDK4/6抑制剂经治及36%原发内分泌耐药人群,AKT抑制剂卡匹色替联合氟维司群在二线治疗,mPFS达 7.2个月。综上所述,PI3K抑制剂和AKT抑制剂联合内分泌治疗,为内分泌耐药患者带来了新的治疗治疗选择。
在HR+患者中,大约65%的患者呈现HER2低表达,而大约80%的患者呈现TROP2表达,因此,这类患者是HER2-ADC和TROP2-ADC治疗的潜在受益人群,具体的ADC药物包括T-DXd、SG和Dato-DXd。在HER2-ADC领域,DB-04研究[7]针对经过二线内分泌治疗及一或二线化疗的乳腺癌患者,T-DXd治疗展现了显著疗效,其中位无进展生存期(mPFS)达到了10.1个月。而DB-06研究[8]则针对更早期治疗线(二线或三线;晚期阶段未接受化疗)的HER2低表达或超低表达人群,应用T-DXd治疗后,中位PFS进一步延长至13.2个月。在TROP2-ADC领域,TROPION-Breast01研究[9]纳入既往1-2线化疗人群,Dato-DXd组PFS为6.9个月,TROPiCS-02研究[10]则纳入既往2至4线化疗人群,戈沙妥珠单抗组PFS为5.5个月。综上,HR+/HER2-晚期乳腺癌治疗领域,HER2-ADC(德曲妥珠单抗/T-DXd,针对HER2低表达人群)和 TROP2-ADC(戈沙妥珠单抗/SG,无需行TROP2测定)均是可以选择的药物。
雌激素受体基因(ESR)突变亦是引起内分泌耐药的原因。口服选择性雌激素受体降解剂(SERD),如Elacestrant(EMERALD研究)、Camizestrant(SERENA-2研究)、 Imlunestrant(EMBER-3研究)[11-13],在ER阳性/HER2阴性的晚期乳腺癌患者中,若在既往芳香化酶抑制剂治疗期间或之后出现疾病复发或进展,针对携带ESR1突变的患者,上述口服SERD相比于常规内分泌治疗均显示出显著获益。另外Imlunestrant联合阿贝西利较Imlunestrant单药治疗更能显著提高患者PFS(无论ESR1突变状态如何)。
如HR阳性/HER2阴性,伴BRCA1/2胚系致病突变,OLYMPIAD研究[14]显示,使用奥拉帕利相比研究者选择的化疗,PFS获得明显改善(7ms vs 4.2ms)。
综合以上论述,对于HR阳性/HER2阴性乳腺癌患者,在内分泌治疗出现进展后,存在多样化的治疗策略可供选择。在具体的临床实践中,应根据患者的疾病负荷、过往治疗药物的使用情况、是否存在基因突变以及免疫组化结果等多方面因素,进行综合考量与选择。通过精准的排兵布局,我们能够有效提升转移性乳腺癌患者的生存质量,助力其延长生存期。
金亮教授:协同增效,NX节拍化疗助力内分泌耐药HR+/HER2-晚期乳腺癌患者高质量长生存
化疗是乳腺癌治疗过程中不可或缺的重要手段之一,2024年中国临床肿瘤学会(CSCO)指南推荐:对于内脏转移、既往对内分泌治疗耐药或无最佳内分泌治疗选择的HR+晚期乳腺癌患者,应首选解救化疗。传统化疗的不良反应较大,2000年Hanahan教授提出了节拍化疗的理念[15],通过频繁、定期地给予较低剂量的化疗药物能够长期维持低而有效的浓度范围而不会引起过多的不良反应。此外,在抗肿瘤作用机制上,传统化疗是通过直接破坏肿瘤细胞DNA或抑制DNA合成,而节拍化疗则是通过抑制肿瘤血管生成或是刺激自体免疫功能[16]。一项纳入了11项随机对照研究的荟萃分析显示,晚期乳腺癌患者的一线化疗周期越长,OS和PFS越长[17]。因此节拍化疗能在疗效和毒性间达到最佳平衡,为临床带来更长的治疗周期实现疾病控制从而达到长生存目的。
长春瑞滨软胶囊是微管蛋白抑制剂,不仅可作用于血管内皮细胞,且口服剂型适用于高频率给药,是理想的节拍化疗药物。而相比静脉用药,口服化疗药物更易被接受,对患者日常生活的影响更少[18],可大大增加患者的治疗依从性,使长期化疗成为可能。长春瑞滨软胶囊与卡培他滨均为口服剂型,两者联用在提高疗效的同时,可进一步改善患者的生活质量。VICTOR-2研究[19]探索了长春瑞滨联合卡培他滨双节拍化疗治疗HER2阴性晚期乳腺癌患者的疗效及安全性,该研究纳入的患者中,有72.6%伴有内脏转移。研究结果显示,对于HR+/HER2-的患者,一线治疗的中位至疾病进展时间(TTP)为7.9个月,二线治疗为7.2个月。在亚组分析中,NX方案对于内脏转移的患者表现出更获益的趋势。3/4级不良事件发生率低,整体治疗耐受良好。
基于该研究,本例患者二线给予NX方案节拍化疗,治疗过程顺利,外周病灶控制良好,且患者耐受性良好,PFS长达4年。后患者出现脑部孤立性转移,经MDT讨论,予手术切除,后进行局部放疗。对于无症状脑寡转移患者的系统性治疗可依据肿瘤组织学和分子特征进行选择[20],对于HER2阴性的患者,可采用化疗。结合患者对原系统性治疗方案耐受良好且无明显进展,故临床继续给予NX方案节拍化疗。我们将密切关注患者病情,为患者高质量、长生存保驾护航。
点评专家
专家介绍
逸仙乳腺肿瘤医院 乳腺内科
中山大学孙逸仙纪念医院
广东省胸部肿瘤防治研究会乳腺肿瘤内科专业委员会主任委员
中国医药卫生事业发展基金会乳腺肿瘤学组秘书长
广东省卫生信息网络协会智慧肿瘤研究分会副会长
广东省临床医学学会泛家族遗传性肿瘤防控专业委员会常委
广东省抗癌协会乳腺癌专业委员会委员
广东省胸部肿瘤防治研究会胸部肿瘤脑转移专业委员会委员
中国抗癌协会肿瘤分子医学专业委员会委员
中国抗癌协会肿瘤标志专业委员会会员
主持国家自然科学基金青年基金1项
主持中山大学5010培育项目1项
主持逸仙临床研究培育项目1项
参加编写《临床肿瘤内科学》和《乳腺癌保乳治疗》
英国卡迪夫大学访问学者
参加多项国际及国内多中心临床研究
专家介绍
中山大学孙逸仙纪念医院 乳腺肿瘤中心
英国卡迪夫大学CCMRC访问学者
广东省抗癌协会乳腺癌专委会 委员兼秘书
广东省医师协会乳腺专科医师分会外科组副组长
广东省老年保健协会 乳腺疾病专委会副主委
广东省医疗行业协会 乳腺专科管理分会常委
广东省医疗行业协会 乳腺病整形修复管理分会常委
广东省医疗行业协会 乳腺肿瘤内科管理分会常委
广东省临床医学学会 乳腺癌专业委员会常委
广东省健康管理学会 乳房重建再造及美学专业委员会常委
广州市抗癌协会乳腺癌专委会 委员
汕尾市医学会乳腺病学分会 / 汕尾市医师协会乳腺专科医师分会副主委
病例整理专家
专家介绍
中山大学孙逸仙纪念医院
北京协和医学院肿瘤学博士 中山大学临床医学博士后
北京慢性病防治与健康教育研究会肿瘤免疫治疗专业委员会委员
广东省胸部肿瘤防治研究会乳腺肿瘤内科专业委员会委员
广东省医疗行业协会乳腺内科管理分会委员
《中国肿瘤临床与康复》杂志编委
主持国家自然科学基金、广东省自然科学基金青年基金和中国博士后科学基金,参与国家重大新药创制科技重大专项、广东省自然科学基金、北京市自然科学基金等多项课题
以第一/共同第一作者身份在柳叶刀子刊Lancet Regional Health-Western Pacific、Medcomm、Cancer、Cancer letters等期刊发表SCI论文20余篇,多次在ESMO、ESMO-ASIA、SABCS等会议室作口头报告或壁报交流
[1] F. Miglietta, M. Bottosso, G. Griguolo, et al. Major advancements in metastatic breast cancer treatment: when expanding options means prolonging survival. ESMO Open. 2022 Apr;7(2):100409. doi: 10.1016/j.esmoop.2022.100409. Epub 2022 Feb 26.
[2]Rozeboom B, et al. ER+ metastatic breast cancer: past, present, and a prescription for an apoptosis-targeted future. Am J Cancer Res. 2019, 9(12):2821-2831.
[3] Zhendong, Zheng, Shuxian, Qu, Xiaoxia, Chen, Yongye, Liu, Ying, Piao, Ya-ling, Han, Xiaodong and Xie. “Comparison of vinorelbine plus cisplatin with vinorelbine plus capecitabine in patients with anthracyclines- and taxanes-refractory advanced breast cancer*.” (2014).
[4] Jhaveri K L, Im S A, Saura C, et al. Inavolisib or placebo in combination with palbociclib and fulvestrant in patients with PIK3CA-mutated, hormone receptor-positive, HER2-negative locally advanced or metastatic breast cancer: Phase III INAVO120 primary analysis[C]//Proceedings of the 2023 San Antonio Breast Cancer Symposium, San Antonio, TX, USA. 2023, 2023: 5-9.
[5] Juric D, Kalinsky K, Turner N C, et al. First-line inavolisib/placebo+ palbociclib+ fulvestrant (Inavo/Pbo+ Palbo+ Fulv) in patients (pts) with PIK3CA-mutated, hormone receptor-positive, HER2-negative locally advanced/metastatic breast cancer who relapsed during/within 12 months (mo) of adjuvant endocrine therapy completion: INAVO120 Phase III randomized trial additional analyses[J]. J Clin Oncol, 2024, 42(suppl_16): 1003.
[6]N.C. Turner, M. Oliveira, S.J. Howell, et al. Capivasertib in Hormone Receptor–Positive Advanced Breast Cancer. N Engl J Med. 2023 Jun 1;388(22):2058-2070. doi: 10.1056/NEJMoa2214131.
[7] Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): Results of DESTINY-Breast04, a randomized, phase 3 study[J]. 2022.
[8] Curigliano G, Hu X, Dent R A, et al. Trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy (TPC) in patients (pts) with hormone receptor-positive (HR+), human epidermal growth factor receptor 2 (HER2)-low or HER2-ultralow metastatic breast cancer (mBC) with prior endocrine therapy (ET): Primary results from DESTINY-Breast06 (DB-06)[J]. 2024.
[9] Pernas S, Im S A, Hattori M, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy (CT) in previously treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Patient-reported outcomes (PROs) from the TROPION-Breast01 study[J]. 2024.
[10] Rugo H S, Bardia A, Marmé F, et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial[J]. The Lancet, 2023, 402(10411): 1423-1433.
[11] Bardia A, Aftimos P, Bihani T, et al. EMERALD: Phase III trial of elacestrant (RAD1901) vs endocrine therapy for previously treated ER+ advanced breast cancer[J]. Future oncology, 2019, 15(28): 3209-3218.
[12] Oliveira M, Pominchuk D, Nowecki Z, et al. Camizestrant, a next-generation oral SERD, versus fulvestrant in post-menopausal women with oestrogen receptor-positive, HER2-negative advanced breast cancer (SERENA-2): a multi-dose, open-label, randomised, phase 2 trial[J]. The Lancet Oncology, 2024, 25(11): 1424-1439.
[13] Jhaveri K, Lim E, Jeselsohn R, et al. Abstract PS15-09: Imlunestrant monotherapy and in combination with abemaciclib, with or without an aromatase inhibitor, in estrogen receptor-positive (ER+), HER2-negative (HER2-) advanced breast cancer (aBC): updated results from the EMBER study[J]. Cancer Research, 2024, 84(9_Supplement): PS15-09-PS15-09.
[14]Robson ME,Tung N,Conte P,et al. OlympiAD final overall survival and tolerability results:olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer. Ann Oncol,2019,30(4):558-566.
[15]Hanahan D, et al. J Clin Invest, 2000, 105(8): 1045-1047
[16]Simsek C, et al. J Oncol. 2019 Mar 20;2019:5483791
[17]Gennari A, Stockler M, Puntoni M, et al. Duration of chemotherapy for metastatic breast cancer: a systematic review and meta-analysis of randomized clinical trials. J Clin Oncol 2011;29(16):2144-9.
[18]Eva María Ciruelos, María Nieves Díaz, María Dolores Isla, et al. Patient preference for oral chemotherapy in the treatment of metastatic breast and lung cancer[J].European Journal of Cancer Care, 2019, 28(4).
[19]Cazzaniga ME, et al., Breast Cancer Res Treat 2016;160:501-50.
[20]中国抗癌协会神经肿瘤专业委员会.中国肿瘤整合诊疗指南——脑转移瘤[J].癌症,2023,42(6):304-318.
责任编辑:Annie
排版编辑:Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


