乳腺癌是女性最常见恶性肿瘤之一,发病率居女性恶性肿瘤首位[1],严重影响患者身心健康甚至危及生命。靶向人类表皮生长因子受体2(HER-2)的抗体药物偶联物(ADC)开启了乳腺癌治疗全新篇章,然而ADC治疗中常发生肿瘤治疗所致血小板减少症(CTIT)[2],它不仅严重影响肿瘤治疗进程及临床疗效,而且会增加患者出血风险,因此有效管理CTIT至关重要。
本期内蒙古医科大学附属医院王霞主任医师分享了一例乳腺癌患者ADC辅助治疗期间出现的CTIT的诊疗管理,白俊文教授进行了精彩点评,医脉通特别整理,期待为乳腺癌ADC治疗期间CTIT的处置与管理提供参考。
病例资料
1、基本信息
一般资料:患者女,52岁。
主诉:发现左乳肿物半月余。
现病史:2022年7月5日外院体检B超发现左乳有一约“3cm×2cm”肿物。7月7日于我院进行乳房肿物穿刺术。
专科查体:左乳约4点距乳头4cm处可触及一3.0cm×3.0cm×2.0cm肿物,质地硬,边界欠清,活动度差,边缘不规则。双侧腋下未触及淋巴结肿大。左右锁骨上未触及浅表淋巴结肿大。
2、辅助检查
乳房肿物穿刺术病理活检:左乳浸润性癌(非特殊型,II级,6分)。
免疫组化:HER-2(2+)、ER(>90%,3+)、PR(>90%,3+)、Ki67(热点约25%)。
显色原位杂交法:考虑HER-2基因扩增。
MRI影像检查:左乳外下象限肿块,BI-RADS 5;右乳外下象限(近9点)环状强化,BI-RADS 3;双乳腺实质背景强化,BI-RADS 2。
注:MRI,磁共振;BI-RADS,乳腺影像报告和数据系统
3、临床诊断
乳腺恶性肿瘤(左乳浸润性癌;cT2N0M0,IIA期,HER-2阳性,HR阳性型)。
4、治疗经过
1、2022年7月23日 新辅助化疗
TCbHP方案治疗6个周期。
2、2022年12月4日 新辅助化疗后评估
新辅助化疗后行乳腺MRI提示:左乳外下象限肿块较治疗前略缩小;左乳外下象限(近9点)环状强化无变化。
3、2022年12月6日 手术治疗
行左乳癌保乳术+左腋窝前哨淋巴结活检术。
术后病理回报:左乳浸润性癌,直径1cm,III级,8分;免疫组化示:HER-2(0)、ER(>90%)、PR(>90%),Ki67(20-30%)。腋窝查及前哨淋巴结4枚,均未见癌转移(0/4)。Miller-Payne分级:M1级。结合病理结果,评估患者新辅助化疗后未达病理学完全缓解(non-pCR),根据2022年CSCO乳腺癌诊疗指南,拟定后续治疗方案为:①保乳术后放疗;②恩美曲妥珠单抗(T-DM1;3.6mg/kg,静脉输注给药,每21天为一个周期,共14个周期)靶向治疗;③内分泌治疗:卵巢功能抑制(1-2年)+芳香化酶抑制剂治疗5年,同时补钙治疗;定期门诊复查。
注:ER,雌激素受体;PR,孕激素受体;CSCO,中国临床肿瘤学会
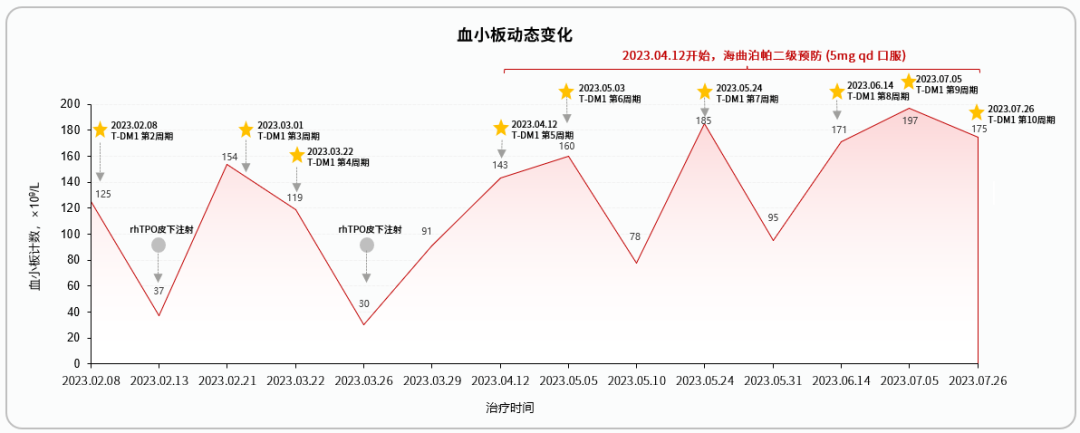
4、2023年1月12日 术后ADC治疗
患者开始接受第1周期T-DM1治疗。
5、2023年2月13日
患者接受第2周期T-DM1治疗后5天,发现全身多发性出血点,多发瘀斑,就诊发现3级血小板减少症,予以升板治疗。
6、2023年3月26日
患者接受第4周期T-DM1治疗后4天再次发生3级血小板减少症,予以升板治疗。
7、2023年4月12日
患者接受第5周期T-DM1治疗。考虑患者在上一周期治疗中已经发生3级CTIT,且T-DM1方案治疗期间CTIT的发生率较高,因此在本周期T-DM1治疗后开始进行CTIT的二级预防。
8、2023年5月3日至今
患者后续按计划完成第6~14周期T-DM1治疗。治疗期间为避免再次发生CTIT,使用海曲泊帕进行二级预防。
5、CTIT治疗经过
1、2023年2月13日 首次升板治疗经过
患者接受第2周期T-DM1治疗后5天发生3级血小板减少症,血小板计数下降至37×109/L,予以重组人血小板生成素(rhTPO)治疗。治疗一周后血小板计数升至154×109/L。
2、2023年3月26日 第二次升板治疗经过
患者接受第4周期T-DM1治疗后4天再次发生3级血小板减少症,血小板计数降至30×109/L,予以rhTPO升板治疗,治疗后血小板计数逐渐恢复。
3、2023年4月12日 CTIT二级预防
患者接受第5周期T-DM1治疗后开始口服海曲泊帕(5mg qd)预防CTIT。2023年5月3日 CTIT二级预防。
患者接受第6周期T-DM1治疗后口服海曲泊帕(5mg qd)进行CTIT的二级预防。治疗后5天患者血小板计数(78×109/L)轻度下降,未发生严重血小板减少症。
4、2023年5月24日 CTIT二级预防
患者接受第7周期T-DM1治疗后口服海曲泊帕(5mg qd)进行CTIT的二级预防。治疗后7天监测患者血小板计数(95×109/L)趋于正常。
5、2023年6月14日、7月5日、7月26日
CTIT二级预防
患者分别在第8、9、10周期T-DM1治疗后口服海曲泊帕(5mg qd)进行CTIT的二级预防。使用海曲泊帕后,患者血小板计数均在正常范围内,未再发生血小板减少症。
6、疗效评价
患者ADC治疗期间发生的CTIT得到有效治疗和预防,正在按期接受抗肿瘤治疗。
诊疗思考
HER-2过表达型乳腺癌复发转移率高、预后较差,经过以曲妥珠单抗为基础的靶向治疗后仍有50%的患者出现进展[3]。ADC药物的出现为HER-2阳性乳腺癌的治疗提供了新选择。T-DM1是首个获批用于实体瘤治疗的ADC药物,其用于HER-2阳性乳腺癌新辅助治疗后仍有残留病灶患者的辅助治疗,可大幅提高无浸润性疾病生存率[4]。本例患者新辅助治疗后未达病理学完全缓解,故参照指南共识建议[4,5],考虑给予患者14个周期的T-DM1治疗。
T-DM1具有靶向、高效的特点,但同时易引发血小板减少症。在亚洲人群中,T-DM1治疗中3级以上CTIT的发生率高达45%[6]。CTIT的发生不仅影响抗肿瘤治疗的效果,还会增加患者出血风险,所以在该患者的治疗中我们特别关注血小板计数的监测。当发现患者发生3级CTIT后,即刻使用rhTPO治疗,治疗后患者血小板计数恢复。
考虑患者治疗方案CTIT的高发性及患者目前在治疗过程中已发生3级CTIT,在下一周期T-DM1治疗后拟进行CTIT二级预防。由于T-DM1每21天给药1次,患者大多数时间院外居家管理,而促血小板生成素受体激动剂(TPO-RA)海曲泊帕为口服制剂,稳定升板的同时能够为CTIT的院外管理提供了很大便利。因此采用该药物进行二级预防。该患者使用海曲泊帕治疗后,血小板计数水平趋于正常,后续T-DM1治疗得以如期进行。
ADC治疗期间发生CTIT的作用机制是什么?发生率有多高?
白俊文教授:ADC药物是将具有靶向作用的单克隆抗体与高抗肿瘤活性的细胞毒性药物通过连接子结合在一起,由于涉及抗体、细胞毒性药物、连接子以及偶联过程,因此ADC治疗期间发生CTIT的机制较为复杂。以T-DM1为例,其可能通过Fcy受体介导或非Fcy受体途径两种机制引起CTIT[2]。T-DM1与Fcy受体IIA结合后,驱动内化以及后续的偶联物降解与DM1释放,进而影响血小板前驱细胞的增殖与分化;此外,T-DM1可能通过胞饮作用进入巨核细胞,随后DM1抑制巨核细胞分化,破坏血小板形成,最终导致CTIT的发生[2]。
血小板减少症是T-DM1的常见不良反应。在全球人群中,T-DM1治疗患者中所有级别血小板减少症发生率约为20%~38%,≥3级的发生率约为2%~13%;亚洲人群中这一不良事件的发生风险更高,所有级别血小板减少症的发生率达52.5%-69.8%,≥3级的发生率约为29.8%-45.0%[6]。因而T-DM1治疗期间需重点关注血小板减少症的防治。
在您看来,ADC药物治疗期间是否有必要进行CTIT的二级预防?
白俊文教授:ADC药物目前主要用于乳腺癌的辅助强化治疗或二线及后线治疗,以改善患者预后[2]。以辅助强化治疗为例,指南建议新辅助治疗后未获得病理学完全缓解的乳腺癌患者接受14个周期的T-DM1治疗[4],而T-DM1容易导致严重血小板减少症,进而引起治疗延迟或中断。在KATHERINE研究中,4.2%的患者因血小板减少症导致T-DM1治疗中断,且有1例患者死于脑出血[7]。国内文献中报道血小板减少出现后中断治疗的情况非常普遍[8]。因此,对于有CTIT高出血风险因素的患者,推荐化疗后6~24小时开始预防性应用促血小板生成药物[8]。《ADC治疗恶性肿瘤临床应用专家共识(2020版)》亦建议使用T-DM1的高出血风险患者可进行二级预防以降低血小板减少症的发生[4]。对于二级预防药物的选择,2023年CSCO《肿瘤治疗所致血小板减少症诊疗指南》推荐,上一周期血小板计数<50×109/L的患者,以及<75×109/L且有出血高风险因素的患者,可使用升板药物,如口服药物海曲泊帕(II级推荐,2A类证据)进行预防[9]。
请您结合本病例谈谈海曲泊帕在ADC治疗相关CTIT治疗和预防中的应用潜力?
白俊文教授:海曲泊帕是中国自主研发的新一代口服小分子非肽类TPO-RA,疗效更强、肝肾毒性更低,已获得2023版CSCO《肿瘤治疗所致血小板减少症诊疗指南》Ⅱ级推荐用于CTIT的治疗和二级预防,在CTIT的治疗和预防方面均具有良好的应用潜力[10]。
治疗方面,2023年欧洲内科医学大会(ECIM)发布的海曲泊帕的Ⅱ期临床研究结果显示[11],与安慰剂相比,海曲泊帕连续给药可显著提高患者的治疗有效率(60.7% vs. 12.9%,OR=10.4,P=0.0001);同时,海曲泊帕联合rhTPO可发挥促血小板生成的协同增效作用,促进CTIT患者的血小板计数快速恢复。
预防方面,海曲泊帕在CTIT领域的Ⅱ期临床研究结果证实,海曲泊帕连续给药可有效保证下一化疗周期的正常进行,有效率达72%,显著高于安慰剂组29%[11],真实世界研究亦显示,海曲泊帕可以有效预防高风险肿瘤患者CTIT的发生,应答率达100%[12]。
本例患者ADC治疗期间两次发生3级CTIT,尽管在升板治疗后血小板计数恢复,但在后续治疗中仍有发生CTIT的风险,且随着治疗周期的叠加,发生的CTIT可能更加严重。加之患者每21天给药1次,大多数时间院外居家管理,给临床CTIT的监测管理带来很大挑战。使用海曲泊帕进行CTIT二级预防后,患者血小板计数趋于正常,有效避免了应用ADC药物可能导致的严重CTIT以及CTIT可能导致的ADC药物减量或停药。此外,海曲泊帕为口服药物,给药便捷,提升了患者的用药依从性,更好地实现了患者ADC治疗期间CTIT的院外管理,保障了ADC治疗的连续性和疗效。总而言之,海曲泊帕可高效、安全地升高患者的血小板计数,且使用便捷,在ADC相关CTIT的治疗和二级预防中具有明显的应用优势。期待本例海曲泊帕用于ADC相关CTIT二级预防的临床案例能够给各位同道提供参考,提升临床及院外CTIT管理水平。
[1]曹毛毛,陈万青.GLOBOCAN 2020全球癌症统计数据解读[J].中国医学前沿杂志:电子版, 2021, 13(3):7.
[2]中国医师协会肿瘤医师分会乳腺癌学组, 中国抗癌协会国际医疗交流分会. 中国乳腺癌抗体药物偶联物安全性管理专家共识[J]. 中华肿瘤杂志, 2022, 44(9):913-927.
[3]李智慧,李志高.恩美曲妥珠单抗T-DM1在HER2阳性乳腺癌中的研究进展[J].实用肿瘤学杂志, 2022, 36(5):477-482.
[4]中国抗癌协会肿瘤药物临床研究专业委员会,国家抗肿瘤药物临床应用监测专家委员会,国家肿瘤质控中心乳腺癌专家委员会,等.抗体药物偶联物治疗恶性肿瘤临床应用专家共识(2020版)[J].中华肿瘤杂志, 2021, 43(1):14.
[5]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022[M]. 北京:人民卫生出版社,2022.
[6]欧开萍,李俏,罗扬,等.恩美曲妥珠单抗治疗HER2阳性乳腺癌致血小板下降的临床特点[J].临床药物治疗杂志, 2021, 19(7):4.
[7]von Minckwitz G, Huang CS, Mano MS, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer[J]. N Engl J Med. 2019 Feb 14;380(7):617-628.
[8]黄尚科,等. 局部晚期HER-2+/HR+乳腺癌新辅助化疗后T-DM1治疗致血小板减少2例并文献复习[J]. 现代肿瘤医学, 2023, 31(15):2846-2850.
[9]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023[M]. 北京:人民卫生出版社,2023.
[10]中国临床肿瘤学会指南工作委员会.中国临床肿瘤协会(CSCO)肿瘤治疗所致血小板减少症诊疗指南2023[M]. 北京:人民卫生出版社,2023.
[11]Jun Ma, et al. A multicenter, randomized phase II trial on the efficacy and safety of hetrombopag for the treatment of chemotherapy-induced thrombocytopenia in patients with advanced solid tumors. 2023 European Congress of Internal Medicine, Abstract 2360.
[12]Haifeng Qin. Annals of Oncology (2022) 33 (suppl_9): S1560-S1597.
排版编辑:肿瘤资讯-展思懿
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


