
中国临床肿瘤学会神经内分泌肿瘤专家委员会. 中国肺和胸腺神经内分泌肿瘤专家共识[J]. 中华肿瘤杂志, 2021, 43(10):989-1000.
DOI: 10.3760/cma.j.cn112152-20210719-00522
肺和胸腺神经内分泌肿瘤 (NENs) 是一种罕见的肿瘤,根据 2021 年发布的第 5 版世界卫生组织胸部肿瘤病理分类,肺和胸腺 NENs 包括典型类癌、不典型类癌、大细胞神经内分泌癌和小细胞癌。尽管近年来肺和胸腺 NENs 发病率逐渐升高,但国内外均缺少针对 NENs 的随机对照临床研究结果以指导临床实践。早期肺和胸腺 NENs 的治疗为外科完全性切除,不可切除的晚期疾病治疗方法包括药物治疗、肽受体放射性核素治疗和局部治疗等。为了进一步提高中国肺和胸腺 NENs 的规范化诊疗水平,中国临床肿瘤学会神经内分泌肿瘤专家委员会在国内外现有临床研究证据的基础上,结合国际指南,经过多学科专家讨论,制定了中国肺和胸腺神经内分泌肿瘤专家共识。共识的内容包括了肺和胸腺 NENs( 除小细胞肺癌外 ) 的流行病学、诊断、病理分类、分期以及治疗与随访等。
【 关键词 】肺和胸腺神经内分泌肿瘤;诊断;治疗;共识
神经内分泌肿瘤 (neuroendocrine neoplasms, NENs) 起源于不同的神经内分泌细胞,可以发生在人体的不同器官,具有高度异质性。肺神经内分泌肿瘤 (lung neuroendocrine neoplasms, L-NENs) 的发病率仅次于胃肠胰腺 NENs(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs) ,但胸腺 NENs 较为罕见。目前肺和胸腺 NENs 的命名及病理分类与 GEP-NENs 存在很大差别,临床诊断与治疗原则与 GEP-NENs 也有诸多不同。针对国内肺和胸腺 NENs 的诊治现状,为了进一步提高国内肺和胸腺 NENs 的规范化诊治水平,中国临床肿瘤学会神经内分泌肿瘤专家委员会经过多学科专家的酝酿和讨论,在现有临床研究证据的基础上,结合欧洲神经内分泌肿瘤学会、美国国立综合癌症网络、欧洲肿瘤内科学会的肿瘤诊治指南和世界卫生组织 (World Health Organization, WHO) 病理分类,制定了本共识,以期对国内临床同道有所帮助。
为了便于交流,本共识统一使用 2021 年 WHO 肺和胸腺 NENs 的病理分类,共分为 4 类:典型类癌 (typical carcinoid, TC) 、不典型类癌 (atypical carcinoid, AC) 、大细胞神经内分泌癌 (large cell neuroendocrine carcinoma, LCNEC) 、小细胞癌 (small cell carcinoma, SCC) 。共识内容涉及的 NENs 泛指上述 4 类肿瘤,神经内分泌瘤 (neuroendocrine tumors, NETs) 包括 TC 和 AC ,神经内分泌癌包括 LCNEC 和 SCC 。本共识不包括小细胞肺癌 (small cell lung cancer, SCLC) 的相关内容。
流行病学
L-NENs
中
TC
、
AC
和
LCNEC
占原发肺部肿瘤的比例约为
2%
、
0.2%
和
3%
。欧美国家
L-NENs
发病率为
0.2/10
万
~2/10
万,且发病率逐年上升,部分原因可能与医师对该疾病认识的提高以及病理和影像诊断水平的进步有关。
TC
和
AC
多见于不吸烟或少吸烟者,女性略多于男性,
50~60
岁多见,而
LCNEC
则多见于长期吸烟的老年男性患者,
TC
和
AC
患者的比例约
8~10
∶
1
。国内目前仅有
L-NENs
单中心的报道。
2016
年依荷芭丽
·
迟等总结了中国医学科学院北京协和医学院肿瘤医院
74
例
L-NENs
的临床特征及治疗。
2012
年上海胸科医院学者总结了
131
例肺神经内分泌瘤
(lung neuroendocrine tumors, L-NETs)
的临床病理特征,
TC
和
AC
所占比例分别为
80.9%
和
19.1%
。
胸腺神经内分泌肿瘤 (thymic neuroendocrine neoplasms, Th-NENs) 是一类非常罕见的疾病,欧美国家发病率约 0.02/10 万 ~0.18/10 万,在胸腺肿瘤中所占比例约 5% ,在所有 NENs 中比例不足 0.5% ,好发于 40~50 岁的男性。 Th-NETs 中 AC 较 TC 更常见,并且患者发病年龄稍大。
临床表现
L-NENs
临床表现包括肿瘤相关症状及分泌综合征。大多数
L-NETs
,尤其是
TC
,为中心型,
LCNEC
多为外周型。中心型肿瘤常伴有呼吸道症状,包括咳嗽、咯血、胸痛及呼吸困难。外周型
L-NENs
,特别是生长缓慢的无功能
L-NETs
,常由于其他原因进行的影像检查被偶然发现,无明显症状,部分患者的症状与肝、肺或骨转移灶有关。
约 1/3 的 Th-NENs 是查体时发现的无症状患者,多数患者出现症状主要是因为纵隔肿瘤的快速生长导致的咳嗽、胸痛、上腔静脉压迫综合征。 Th-NENs 诊断时的中位大小为 7~8 cm ,半数以上的患者在诊断时已为不可手术的局部晚期或出现远处转移,最常见的转移部位是肺、肝、骨、胸膜、心包。
1 .功能性 NENs :
L-NETs 可产生多种激素,其中一些激素可导致临床相关症状 ( 表 1) 。类癌综合征是由肿瘤分泌的 5- 羟色胺和生物活性胺导致,在 L-NETs 患者中发生率为 2%~5% ,特别是出现肝转移患者易出现类癌综合征,但较中肠 NETs 患者少见。类癌综合征最常见的临床表现是面颈部和上胸部皮肤潮红以及腹泻, L-NETs 患者类癌综合征症状可能不典型,潮红可能非常严重且持久,持续数小时到数日,还可伴有头痛、流泪、低血压、水肿等其他症状。约 1%~2% L-NETs 患者可出现异位促肾上腺皮质激素 (adrenocorticotropic hormone, ACTH) 分泌,约 40% 异位 ACTH 综合征是由 L-NETs 导致,是 ACTH 异位生成最常见的原因,患者可出现库欣综合征,主要表现为向心性肥胖、皮肤紫纹、高血压、糖代谢异常、低血钾、骨质疏松等。另外 L-NETs 也是垂体外分泌生长激素释放激素 (growth hormone-releasing hormone, GHRH) 的最常见部位,患者可出现肢端肥大症,但发生率极低。其他罕见的激素还有胰岛素,可导致患者反复低血糖发作;抗利尿激素分泌不当综合征在 L-NETs 患者中很少出现; Th-NETs 患者中可以出现异位 ACTH 综合征,类癌综合征十分罕见。

2 .多发性内分泌腺瘤病 1 型 (multiple endocrine neoplasia type 1, MEN1) :
MEN1 是一种常染色体显性遗传性疾病,患者易发生甲状旁腺肿瘤、垂体前叶肿瘤和胰腺神经内分泌肿瘤,较为少见的是 L-NETs 、 Th-NETs 、肾上腺肿瘤或皮下脂肪瘤。 MEN1 患者 L-NETs 与 Th-NETs 患病率估计分别为 2%~8% 和 3%~8% 。 Th-NETs 是 MEN1 患者前纵隔肿块的最常见病因, 25% 的 Th-NETs 与 MEN1 相关,并且通常为无功能性,男性多发,大量吸烟可能为危险因素之一。
生化指标
嗜铬粒蛋白
A(chromogranin A, CgA)
在
L-NENs
诊断、疾病进展和预后判断方面的临床价值有限。多项研究结果显示
CgA
的灵敏度差,缺乏预测价值,不易区分
L-NETs
与健康对照组或稳定期疾病与进展性疾病。新的生物标志物
NETest
是一种包括
51
个标记鉴定基因的循环转录组分析,可能具有更好的灵敏度,但其阳性预测价值和作为
L-NETs
预后标志物的作用仍不确定。
功能性 L-NETs 和 Th-NETs 患者可进行相应激素及其代谢产物的检测。类癌综合征患者测定 24 h 尿 5- 羟基吲哚乙酸 (5-hydroxyindoleacetic acid, 5-HIAA) ,部分不典型类癌综合征患者血液中 5- 羟色胺或尿中 5-HIAA 水平正常。异位 ACTH 综合征可以检测血清皮质醇及 ACTH 、 24 h 尿游离皮质醇 (urinary-free cortisol, UFC) ,并通过经典小剂量地塞米松抑制试验或过夜地塞米松抑制试验、大剂量地塞米松抑制试验等来协助定性及定位诊断。异位 GHRH 引起的肢端肥大症可检测血清生长激素、 GHRH 和胰岛素样生长因子 1 ,异位胰岛素分泌可检测血胰岛素、胰岛素原及 C 肽等。
影像学检查
1
.常规检查方法:
无论 L-NENs 还是 Th-NENs ,增强电子计算机断层扫描 (computed tomography, CT) 是原发灶影像学检查的金标准。对于有增强 CT 禁忌证的患者,可以行高分辨平扫 CT 。 L-NETs 的 CT 影像特征通常是非特异性的,可表现为单纯腔内或腔外生长,更常见腔内 - 腔外混合生长,增强 CT 扫描常表现为明显强化,有点状或离心性钙化。外周型 L-NETs 最常见的表现是圆形或卵圆形的肺结节,边缘光滑或呈分叶状。部分 LCNEC 可伴有毛刺和胸膜牵拉,增强 CT 表现为不均匀强化。中心型 L-NENs 可表现为 CT 上的间接梗阻征象,如肺不张、阻塞性肺炎等。 Th-NENs 的 CT 扫描通常表现为较大的分叶状、呈浸润性的前纵隔肿块,伴有不均匀强化及点状钙化,但没有具有诊断意义的表现。根据影像学检查, Th-NENs 难以与其他胸腺恶性肿瘤或非胸腺恶性肿瘤 ( 如淋巴瘤或转移瘤 ) 相鉴别。增强 MRI 是检查肝转移和脑转移病灶的最佳方法。
2 .放射性核素显像:
部分 L-NETs 和 Th-NETs 表达高水平的生长抑素受体 (somatostatin receptor, SSTR) ,因此可采用放射性核素标记的生长抑素类似物 (somatostatin analogues, SSA) 进行生长抑素受体显像 (somatostatin receptor imaging, SRI) 的全身成像。如有条件可采用镓 -68(gallium-68, 68 Ga) 标记的 SSA 正电子发射断层扫描 (positron emission tomography-computed tomography, PET-CT) ,诊断效率优于单光子发射计算机断层成像 (single-photon emission computed tomography, SPECT) 。 PET-CT 通常使用 68 Ga-DOTA-TOC( 酪氨酸奥曲肽 ) 、 68 Ga-DOTA-Tate( 奥曲肽 ) 或 68 Ga-DOTA-NOC(1-NaI3- 奥曲肽 ) 。也有早期研究显示, 18 F 标记 SSA 的 PET-CT 显像性能与 68 Ga 标记 SSA 的 PET-CT 相当。如果 PET-CT 不可用,可使用 SPECT-CT 。 SRI 还可以筛选有资格接受 SSA 及肽受体放射性核素治疗 (peptide receptor radionuclide therapy, PRRT) 的患者;氟脱氧葡萄糖 (fluorodeoxyglucose, FDG)-PET-CT 检测 L-NETs N1 或 N2 期病变的灵敏度较低 (33%~60%) ,可用于进展迅速的 AC 、神经内分泌癌以及 SRI 阴性患者。
其他检查
1
.支气管镜检查:
中心型 L-NENs 可通过支气管镜活检确诊。超声支气管镜检查 (endobronchial ultrasound, EBUS) 可以对转移的纵隔淋巴结进行活检,同时有助于在手术前明确 N2 期或 N3 期疾病。
2 .肺功能检查:
常用于术前风险评估,筛查是否有支气管狭窄和慢性阻塞性气道疾病。
3 .超声心动图:
在诊断和随访过程中,用于评估是否有类癌性心脏病,尤其是手术之前的风险评估。
4 .基因检测:
如果患者有 MEN1 家族史或存在其他 MEN1 特征,例如甲状旁腺功能亢进症等,则应进行 MEN1 基因胚系突变的筛查。
病理诊断
1
.病理分类:
根据 2021 年 WHO 的分类, L-NENs 与 Th-NENs 包括 TC 、 AC 、 LCNEC 和 SCC 4 种肿瘤类型,诊断和分类标准是在具有神经内分泌肿瘤形态前提下,经过免疫组织化学相关神经内分泌标志物染色证实,并结合肿瘤坏死及核分裂指数 ( 核分裂象数 /2 mm 2 ) 两项指标进行分类 ( 表 2) 。应用该分类标准时需注意以下 3 个问题: (1) 活检标本组织太少 ( 达不到 2 mm 2 ) 或组织挤压严重或坏死较明显时,难以通过精确的核分裂计数来准确分级。活检标本诊断类癌时,不建议明确区分 TC 和 AC ;活检标本中 LCNEC 和 SCC 可能受组织挤压或广泛坏死影响难以鉴别时,可诊断为高级别神经内分泌癌,非特指型 (not otherwise specified, NOS) 。 (2)Ki-67 指数在肺及胸腺 NENs 中虽然不作为分级指标,但在活检小标本中,对低中级别类癌与高级别神经内分泌癌的鉴别具有可靠价值。 Ki-67 指数在 TC 中 <5% , AC<30% ,而在高级别神经内分泌癌中 >30% ; (3) 根据 WHO 分类,少数具有类癌形态学特点,但核分裂指数 >10/2 mm 2 的 NEN 被归为 LCNEC ,建议诊断增加备注: LCNEC( 具有类癌形态的高级别神经内分泌癌 ) ,以便于临床个性化管理。

LCNEC 或 SCC 可以与任何比例的非神经内分泌癌成分混合 ( 命名为复合性大细胞神经内分泌癌或复合性 SCC) ,诊断时需注明混合癌的类型、占比和分化程度。
2 .免疫组织化学:
没有一种标志物可以单独有效判断神经内分泌分化,应采用一组抗体综合进行结果评价。推荐使用诊断 L-NENs 免疫组织化学标志物组合为突触素 (synaptophysin, Syn) 、 CgA 、 CD56 、 INSM1 、 TTF-1 、 Ki-67 ,其中前 4 种属于神经内分泌标志物。对于无条件做放射性核素显像的低中级别类癌,可加做 SSTR-2 和 MGMT 协助临床治疗;对于高级别神经内分泌癌,可加做 P53 和 RB1 协助临床治疗。
3 .病理报告要求:
2017 年中国肺神经内分泌肿瘤病理诊断共识建议,对于手术切除的标本,病理科医师的诊断报告应该详细提供分期所需要的重要参数,包括:标本的类型、肿瘤的类型、肿瘤的部位、肿瘤的大小和数目、浸润范围 ( 包括胸膜是否累及 ) 、肿瘤有无坏死、核分裂指数、 Ki-67 指数,神经内分泌标志物包括 CgA 、 Syn 、 CD56 以及其他必要的鉴别诊断标志物;切缘情况以及淋巴结转移情况等。细胞学标本及小标本诊断具体要求细节可参见 2017 年肺神经内分泌肿瘤病理诊断共识。
目前利用基因组学、转录组学、蛋白质组学和表观遗传学等对 L-NENs 及 Th-NENs 开展的研究提出了不同的分子分型,有可能更好地指导治疗。
但目前分子分型尚未常规应用于临床,还需要进一步的研究来评估其应用价值。
诊断流程
L-NENs
和
Th-NENs
诊断流程包括临床症状、影像学和病理学等检查以最终明确诊断
(
图
1)
。外周型肿瘤可以经胸穿刺活检;针对中心型肿瘤行纤维支气管镜检查,同时钳夹活检。纵隔淋巴结活检可以采用
EBUS
引导下经支气管针吸活检
(transbronchial needle aspiration, TBNA)
或纵隔镜下活检。
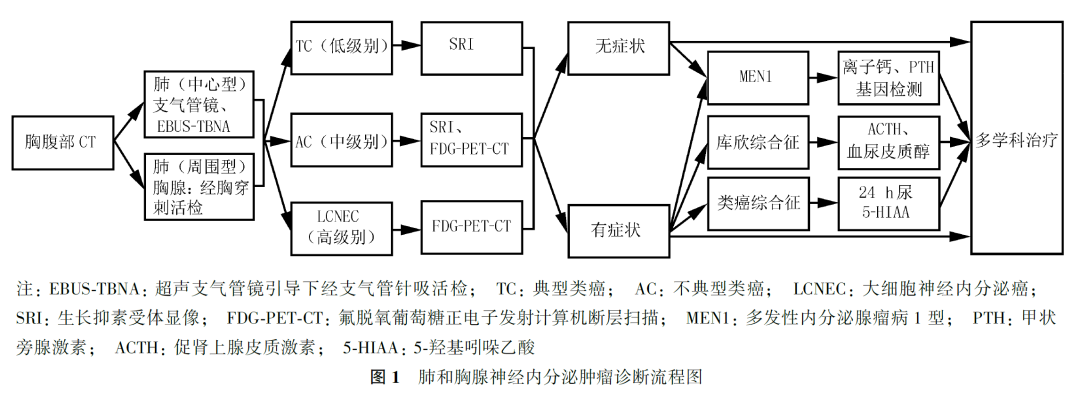
对于可疑 L-NENs 的局部可切除肿瘤,或伴有出血或激素分泌危象高风险的肿瘤,或先前活检失败的肿瘤,可在做好充分的医疗准备后进行手术,手术后病理检查明确诊断。
分期与预后
L-NENs
依据美国癌症联合委员会
(American Joint Committee on Cancer, AJCC)
第
8
版肺癌
TNM
分期系统进行分期。
80%
以上的
L-NETs
确诊时为Ⅰ期或Ⅱ期,Ⅳ期患者最常见的转移部位包括肝、骨和肺。在
L-NETs
中,总生存时间
(overall survival, OS)
主要与
WHO
病理分类和
pTNM
分期相关。Ⅰ、Ⅱ、Ⅲ或Ⅳ期
TC
或
AC
患者的
10
年疾病特异性生存率分别为
96%
、
85%
、
81%
、
59%
和
88%
、
75%
、
47%
、
18%
。影响手术切除后的
L-NETs
患者生存的主要因素为
WHO
病理分类和病理淋巴结分期
(pN)
。转移性
L-NETs
的预后可能与
WHO
病理分类、体力状态评分、血
CgA
水平、肿瘤负荷和
SRI
摄取以及肿瘤生长速率和功能综合征等多种因素有关。
所有分期的 LCNEC 的 5 年总生存率为 13%~57% ,手术切除后的 LCNEC 患者的 3 和 5 年生存率分别为 49%~54% 和 45% 。 LCNEC 的预后与 SCLC 相当,即使是病理分期为Ⅰ A 期的 LCNEC 患者,根治性切除后的生存也较非小细胞肺癌 (non-small cell lung cancer, NSCLC) 患者更差。
Th-NENs 按照胸腺肿瘤的 AJCC 第 8 版 TNM 分期系统或 Masaoka-Koga (MK) 分期系统进行分期。大多数 Th-NETs 在 TNM 分期为Ⅲ或Ⅳ期或 Masaoka-Koga 晚期确诊,最常见的转移部位包括胸膜、心包、骨、肺和肝。 Th-NETs 患者的预后较 L-NETs 差,回顾性研究显示, Th-NETs 患者 5 或 10 年生存率分别为 28%~72% 或 26%~60% , OS 与分期 ( 主要是肿瘤大小 ) 和手术切除完整性有关,手术后 5 年生存率为 50%~70% 。高级别的胸腺神经内分泌癌预后较 TC 、 AC 差,胸腺神经内分泌癌 5 年生存率为 0~30% 。
L-NENs 和 Th-NENs 的治疗
(一)手术治疗
1
.
L-NENs:
对于健康状况和肺储备可耐受手术切除的 L-NETs 患者,即使有 N2 淋巴结转移,首选外科完全性切除。手术方式取决于肿瘤大小、位置和术前活检病理,推荐行解剖性肺切除 [ 如肺段切除、肺叶切除、双叶切除、全肺切除、支气管和 ( 或 ) 血管袖状切除 ] 和系统性淋巴结清扫术。淋巴结清扫范围应至少包括 6 组淋巴结:其中 3 组来自肺内 ( 肺叶、叶间或肺段 ) 和肺门淋巴结, 3 组来自包括隆突下淋巴结在内的纵隔淋巴结。应根据病变情况 ( 大小、位置、周围脏器受侵程度等 ) 和外科医师的经验来选择合适的手术入路,包括开胸入路 ( 经侧开胸、经胸骨正中劈开等 ) 和微创入路 ( 经胸腔镜、机器人辅助等 ) 。
手术首选肺叶切除,对于无法接受肺叶切除患者,可以考虑亚肺叶切除,但楔形切除会增加肿瘤复发率。 27% 的 TC 和 47% 的 AC 可以出现淋巴结转移,推荐进行完全的淋巴结清扫,以准确的评估 N 分期。
侵犯叶支气管开口的中心型肿瘤,肺叶切除可能导致切缘过近或肿瘤残留,应行支气管袖状肺叶切除,若支气管袖状肺叶切除术后切缘仍不充分,则应考虑全肺切除。侵犯肺门血管的中心型肿瘤,需行血管成形术或全肺切除术。
对手术风险较高,无支气管腔外侵犯或转移的支气管内 TC 或 AC 可以通过支气管镜下切除,较手术切除可以保留更多肺组织,部分患者可获得治愈。支气管内切除肿瘤也可以在手术前解除或减轻阻塞性肺炎,改善肺功能。无法耐受手术或已出现转移的晚期患者出现支气管梗阻的情况下,也能够从支气管内切除中受益。
由于缺乏研究数据,目前建议 LCNEC 的手术治疗原则参照 NSCLC 。手术是明确诊断的重要方法,可手术患者 (TNM 分期为Ⅰ期、Ⅱ期、部分Ⅲ A 期 ) 应首选根治性切除。但由于局部侵犯或远处转移,大多数 LCNEC 无法手术切除。
2 . Th-NENs:
所有潜在可根治性切除的 Th-NENs 均应首选手术治疗,应完整切除胸腺肿瘤、胸腺及其周围脂肪,若肿瘤侵犯纵隔胸膜、肺、心包等周围脏器,也应一并彻底切除,胸腺肿瘤不应与胸腺分开切除,而应该整块切除胸腺肿瘤与胸腺。约 50% 的 Th-NENs 手术时发现有淋巴结转移,推荐进行淋巴结清扫,以准确分期,降低复发风险,但目前对于淋巴结清扫的范围尚无定论。此外,应仔细检查肿瘤有无侵犯胸膜腔,探查可能存在的壁层和脏层胸膜转移,如果术中发现转移灶,则应尽可能切除。
由于 Th-NENs 的预后较差,伴 MEN1 ,尤其是有侵袭性 Th-NEN 家族史的年轻男性患者应接受密切随访。
(二)术后辅助治疗
1
.
L-NENs:
大型回顾性研究显示, TC 和 AC 术后辅助治疗均无生存获益,因此, L-NETs 术后不推荐常规接受辅助治疗。在具有特别高复发风险 ( 如 AC N2 期 ) 的患者中可以考虑使用辅助治疗。辅助治疗方案可选择:替莫唑胺或达卡巴嗪为基础化疗方案,或 EP 方案 ( 顺铂联合依托泊苷 ) 或 EC 方案 ( 卡铂联合依托泊苷 ) ,可联合或不联合放疗。仅有回顾性研究及一项小型前瞻性研究显示, LCNEC 患者术后接受 SCLC 化疗方案,即 EP 或 EC 方案生存率更高。在日本开展的Ⅲ期研究 JCOG1205/1206 对比了 IP 方案 ( 伊立替康联合顺铂 ) 和 EP 方案辅助治疗完全切除的Ⅰ ~ Ⅲ A 期 SCLC(117 例 ) 与 LCNEC(104 例 ) 的疗效,结果显示, IP 与 EP 方案在总体人群及 LCNEC 亚组疗效均无显著差异。因此,目前仍推荐 EP 或 EC 方案用于 LCNEC 术后辅助化疗。
2 . Th-NENs :
尽管现有回顾性研究结果显示 Th-NENs 辅助治疗无获益。对于 AC ,可根据 Ki-67 指数、淋巴结是否转移等情况多学科讨论决定是否接受辅助放化疗;对于胸腺神经内分泌癌,建议术后 EP 或 EC 方案辅助化疗 ± 放疗。
(三)晚期肿瘤的治疗
晚期
L-NENs
和
Th-NENs
的治疗目标包括功能性
NETs
的症状控制和控制肿瘤生长,以改善患者生活质量和延长生存期。目前,单独针对
L-NENs
和
Th-NENs
的临床研究很少,制定治疗决策时通常依据预后因素而非疗效预测因子,最佳治疗顺序尚未确定。无症状和影像学进展缓慢的
TC
患者可考虑观察随访。
1 .功能性 NETs 的症状控制
类癌综合征是功能性 L-NETs 中最常见的功能综合征,但在 Th-NETs 中罕见。基于伴有类癌综合征的 GEP-NETs 研究数据和指南推荐,长效 SSA 推荐作为类癌综合征的一线治疗药物,围手术期治疗可采用短效 SSA 连续静脉输注进行,以避免类癌危象。在肿瘤缓慢进展的患者中, SSA 难治性类癌综合征的治疗选择包括:增加 SSA 剂量,干扰素 α(interferon-α , IFNα) , 5- 羟色胺合成抑制剂特罗司他乙酯,帕瑞肽,原发灶和 ( 或 ) 转移灶的手术或局部消融治疗。肿瘤显著进展的患者也可考虑接受抗肿瘤增殖的治疗方法,如 PRRT 、依维莫司或化疗。
异位 ACTH 分泌引起的库欣综合征是 Th-NETs 中最常见的功能综合征。治疗首选药物包括类固醇合成抑制剂,如美替拉酮和 ( 或 ) 酮康唑。难治性库欣综合征的治疗选择包括联合使用肾上腺抑制药物,包括米托坦、依托咪酯、米非司酮或 11-β- 羟化酶抑制剂 Osilodrostat, SSA 可能对少数患者有用。此外,肿瘤进展迅速的不可切除病例,可以选择双侧肾上腺切除术。
其他功能综合征,如异位 GHRH 分泌引起的肢端肥大症等均罕见,可采用 SSA 治疗。
2 . L-NETs 和 Th-NETs 的抗肿瘤增殖治疗
晚期 L-NETs 患者的全身抗肿瘤增殖治疗方法包括 SSA 、分子靶向药物 ( 包括依维莫司和索凡替尼 ) 、化疗、 PRRT 等 ( 表 3) 。迄今为止,尚无专门针对 L-NETs 的Ⅲ期随机对照临床研究结果,治疗方案推荐证据主要来自随机Ⅱ期或Ⅲ期研究亚组、Ⅱ期单臂研究或回顾性分析。晚期 Th-NETs 的研究数据非常有限,建议应用与 L-NETs 相同的治疗方法。

(1) 生长抑素类似物 (somatostatin analogs, SSAs) : 长效奥曲肽和兰瑞肽是临床最常用的两种 SSA 。安慰剂对照的Ⅲ期研究 SPINET(NCT02683941) 拟评价兰瑞肽 120 mg 治疗晚期 L-NETs 疗效,但因入组不足而停止。回顾性研究显示, SSA 治疗晚期 L-NETs 中位无进展生存时间 (median progression-free survival, mPFS) 分别为 17 和 11 个月。随机Ⅱ期 LUNA 研究纳入 1 年内进展的晚期 L-NETs 或 Th-NETs 患者,其中 41 例一线或进展后二线使用帕瑞肽 60 mg 每 4 周 1 次治疗, 9 个月无进展率 (progression-free rate, PFR) 为 39% ,与依维莫司单药组获得的 PFR 无显著差异。因此, SSA 可用于进展缓慢的 SSTR 阳性 L-NETs 与 Th-NETs 的一线治疗。
(2) 分子靶向药物治疗: ①依维莫司:依维莫司是哺乳动物雷帕霉素靶蛋白抑制剂。安慰剂对照的Ⅲ期研究 RADIANT-4 证实,在晚期进展性胃肠道或肺来源 (L-NETs 90 例,占 30%) 无功能 NETs 患者中,依维莫司可延缓肿瘤进展。Ⅲ期研究 RADIANT-2 纳入了病情进展的伴类癌综合征晚期的 NETs 患者,结果显示,依维莫司对 L-NETs(44 例 ) 具有疗效。仅入组晚期 L-NETs 和 Th-NETs 的随机Ⅱ期 LUNA 研究中,依维莫司单药、依维莫司联合帕瑞肽和帕瑞肽单药组均达到预先计划的统计学终点,即 9 个月 PFR >20%( 帕瑞肽组 39% ,依维莫司组 33% ;依维莫司加帕瑞肽组 58%) 。基于上述研究结果,依维莫司推荐用于疾病进展的晚期 L-NETs 与 Th-NETs 的治疗。②:抗血管生成药物:索凡替尼是靶向血管内皮细胞生长因子受体 1 、 2 和 3 ,成纤维细胞生长因子受体 1 和集落刺激因子 1 受体的小分子多激酶抑制剂。Ⅲ期研究 SANET-ep 中包括 23 例 (11%)L-NETs 及 25 例 (12%)Th-NETs ,与安慰剂对比,索凡替尼使 PFS 延长 5.4 个月 ( 研究者评估 PFS 为 9.2 和 3.8 个月 ) ,索凡替尼组的客观缓解率 (objective response rate, ORR) 也显著高于安慰剂组 ( 分别为 10% 和 0) 。基于 SANET-ep 研究结果,推荐索凡替尼用于疾病进展的晚期 L-NETs 与 Th-NETs 治疗。
(3) 化学治疗: 纳入晚期 L-NETs 患者的化疗相关随机对照临床研究主要为链脲霉素为基础方案, 3 项研究中入组的 L-NETs 患者占 8%~12% ,链脲霉素联合氟尿嘧啶方案的 ORR 为 16%~22% , mPFS 为 5~7 个月。但链脲霉素在我国使用存在可及性问题。
数项回顾性研究及一项前瞻性Ⅱ期研究 ATLANT 结果显示,达卡巴嗪或替莫唑胺为基础的化疗方案治疗晚期 L-NETs 或 Th-NETs ORR 为 10%~30% , mPFS 为 5~13 个月。另外,回顾性研究结果显示, EP 或 EC 方案治疗 L-NETs 和 Th-NETs ORR 为 8%~23% , PFS 为 7~8 个月。奥沙利铂为基础的化疗方案,包括 GEMOX 方案 ( 奥沙利铂联合吉西他滨 ) 或 CAPOX 方案 ( 奥沙利铂联合卡培他滨 ) 或 FOLFOX 方案 ( 奥沙利铂联合氟尿嘧啶,亚叶酸钙 )ORR 可达 20% , PFS 为 8~15 个月。尽管上述化疗方案可以作为治疗选择,但目前缺少大样本前瞻性随机对照研究结果支持的最佳方案。
(4)PRRT : 随机对照Ⅲ期研究 NETTER-01 研究结果证实了 177 Lu-DOTATATE PRRT 在中肠来源晚期 NETs 的疗效。前瞻性Ⅱ期研究及数项回顾性研究结果显示 90 Y-DOTATOC 或 177 Lu-DOTATATE PRRT 治疗转移性 L-NETs ORR 为 13%~30% , PFS 为 18~27 个月。 PRRT 治疗尚未在我国获批,肿瘤病灶 SRI 显示阳性摄取的患者在 SSA 、分子靶向药物或化疗治疗进展后可考虑接受 PRRT 治疗。
(5)IFNα 和免疫治疗: 回顾性研究显示 IFNα 治疗晚期 L-NETs 可以使 14% 的患者获得疾病稳定,但 IFNα 的不良反应限制其在临床实践中的应用。免疫检查点抑制剂 (immune checkpoint inhibitor, ICI) 治疗晚期 L-NETs 的研究较少,Ⅱ期研究中程序性死亡受体 1(programmed cell death 1, PD-1) 单抗 Spartalizumab(400 mg 每 4 周 1 次 ) 治疗晚期 L-NETs(28 例 ) 和 Th-NETs(2 例 ) ,获得部分缓解 (partial response, PR) 患者 16.7% 。帕博利珠单抗治疗实体瘤的 IB 期 KEYNOTE 028 研究包括 9 例 L-NETs ,仅 1 例 PR ;Ⅱ期研究 KEYNOTE 158 中包括 14 例 L-NETs ,无获得缓解的病例。小样本非随机对照Ⅱ期研究中 PD-1 或程序性死亡受体配体 1 单抗联合 CTLA-4 单抗治疗晚期 L-NETs 的疗效结果不一致, ORR 为 0~33% 。因此目前不推荐在临床研究外使用 ICI 治疗晚期 L-NETs 或 Th-NETs 。
(6) 局部治疗: 在有可能危及生命的局部晚期疾病或难治性类癌综合征病例中,可考虑原发性肿瘤的姑息性手术或射频消融 (radiofrequency ablation, RFA) 或冷冻消融或支气管内治疗。
以治愈为目的的肝转移灶切除术主要限于肝脏肿瘤负荷有限且不存在肝外肿瘤转移,或存在可治疗的肝外肿瘤转移的患者。两叶转移可考虑二期切除或减瘤联合 RFA ,减瘤手术联合其他局部治疗以达到 70%~90% 的减瘤。局部治疗方法包括热消融技术如 RFA 和微波消融或冷冻治疗,单纯经肝动脉栓塞、经肝动脉化疗栓塞或放射栓塞,也可考虑用于难治性伴肝转移的功能性肿瘤。 L-NETs 或 Th-NETs 患者由于肝外转移常见而不适合肝移植。
不适合手术的早期 L-NETs 或 Th-NETs 患者可使用立体定向外照射放疗 (stereotactic body radiotherapy, SBRT) 。放化疗可能对 AC 更有效,放化疗是否优于单纯根治性放疗尚未确定,但肿瘤缓解率低于局限期 SCLC 患者。外照射治疗转移病灶的数据有限,有回顾性研究显示,全脑放射治疗 (whole brain radiotherapy, WBRT) 或 SBRT 治疗 L-NETs 脑转移瘤均有效。
3 .晚期肺 LCNEC 和胸腺神经内分泌癌治疗
(1) 一线治疗: 由于疗效的异质性,肺 LCNEC 的标准治疗存在争议, EP 是首选方案,但在部分研究中, EP 方案疗效与 SCLC 类似,有的研究中疗效较差。我国的回顾性研究结果显示,晚期肺 LCNEC 一线治疗使用 SCLC 方案疗效优于 NSCLC 方案。有学者提出的不同分子分型可能解释肺 LCNEC 对治疗反应的异质性,尽管目前尚无前瞻性研究结果支持根据基因改变来选择治疗方案,如有可能,肺 LCNEC 可进行二代测序,以指导治疗方案的制定。伊立替康联合顺铂也是可选择的一线方案。
(2) 二线治疗: 目前,无公认的二线及以上治疗方案。针对肺外神经内分泌癌有小样本回顾性研究提示,替莫唑胺单药或联合卡培他滨,或达卡巴嗪联合卡培他滨及顺铂的 ORR 可达 0~33% , mPFS 达到 2.4~6 个月。氟尿嘧啶或卡培他滨联合奥沙利铂或伊立替康等方案,也可以作为二线治疗的选择。对于一线化疗方案治疗缓解后停药超过 6 个月出现疾病复发进展的患者,也可考虑重新采用原方案治疗。另外,肺 LCNEC 中可能存在表皮生长因子受体或 BRAF 等基因的突变,有报告使用相应分子靶向药物治疗有效。
肺 LCNEC 中的突变负荷非常高,且转录组学研究显示,部分患者可能会从免疫治疗中获益。
有研究显示,纳武利尤单抗 (9 例 ) 或帕博利珠单抗 (1 例 ) 治疗 10 例含铂方案化疗后进展的晚期肺 LCNEC 患者, 6 例 PR , mPFS 为 57 周。 125 例晚期肺 LCNEC 患者的真实世界回顾性研究中,使用 ICI 的患者的中位 OS 显著优于未用 ICI 患者,接受 ICI 单药治疗的患者 ( n = 36) 的中位 OS 为 11.0 个月。
目前, ICI 治疗肺 LCNEC 的唯一前瞻性数据来自 DART SWOG 1609 研究 (NCT02834013) 的 NENs 队列。这项 " 篮子研究 " 评估了纳武利尤单抗联合伊匹木单抗在罕见肿瘤患者中的疗效, 32 例非胰腺 NEN 患者中, 18 例为神经内分泌癌, ORR 为 44% ,其中 3 例为肺 LCNEC , 2 例 (66%)PR ,而 NETs 患者中无一例缓解。
晚期胸腺神经内分泌癌的研究数据非常有限,建议应用与肺 LCNEC 相同的治疗方法。
随访
L-NENs
与
Th-NENs
术后复发可能为局部复发或远处转移。肝、骨和肺是
L-NENs
最常见的转移器官,但也可能出现皮肤、肾上腺、甲状腺、卵巢、胸膜和腹膜等少见部位转移。胸膜和骨转移是
Th-NENs
最常见的转移部位,其次为肝脏。
术后患者随访建议选择适当的影像学检查方法 ( 低剂量胸部 CT 和腹部 MRI) ,以减少辐射暴露。在晚期肿瘤患者中,根据病理分类、肿瘤生长速率、肿瘤负荷和功能综合征的控制情况,建议每 2~6 个月进行 1 次影像学检查。随访建议见表 4 。

参考文献略。












 苏公网安备32059002004080号
苏公网安备32059002004080号


