原发免疫性血小板减少症(ITP)是一种获得性自身免疫性出血性疾病,以无明确诱因的孤立性外周血血小板计数(PLT)减少为主要特点,国外报道的成人ITP年发病率为(2~10)/10万1。尽管发病率较低,但在人口基数较大的中国,ITP患者群体仍然十分庞大。在我国,ITP的一线治疗方案主要为糖皮质激素、静脉注射免疫球蛋白(IVIg)等,这些治疗方法虽然短期反应率较高,但具有长期治疗不良反应大且易复发等局限性。此外,二线治疗如促血小板生成药物、利妥昔单抗等,尽管改善了部分患者的疾病状态,但仍有患者难以达到早期缓解,进展为难治性ITP2。此类患者往往对现有治疗反应不佳,常面临严重的出血风险,生活质量严重下降,死亡率增加3,情况不容乐观,亟需新型疗法改善疾病治疗困境。
令人欣喜的是,近年来ITP领域的基础研究飞速发展,促血小板生成素受体激动剂(TPO-RA)类药物不断取得新的突破,为这一挑战带来了转机。海曲泊帕是我国自主研发的新一代小分子、口服、非肽类TPO-RA,通过改构升级,在增强亲脂性、提高药效的同时,降低了肝脏毒性4。多项研究表明,海曲泊帕治疗难治性ITP可快速提升PLT计数,且可以持续维持血小板应答5。此外,对其他TPO-RA药物无反应的患者,转换为海曲泊帕治疗后仍有很大机会获得缓解6,为其他TPO-RA耐药或不耐受的ITP患者提供了一种新的治疗选择。由此可见,海曲泊帕不仅拓宽了难治性ITP的治疗路径,也为这部分患者带来了实质性的获益。
困境难行,策寻新径:难治性ITP在疾病重围中期待治疗创新
在《成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)》(以下简称2020版中国指南)1中,TPO-RA是指南推荐的二线治疗的首选药物,临床实践中TPO-RA也被广泛应用于二线治疗。然而,尽管大多数患者通过常规治疗能够获得缓解,但仍存在部分患者即难治性ITP患者,对常规治疗无应答,成为ITP管理的一大挑战。
与大多数ITP患者不同,难治性患者的状况更为严峻。此类患者对各种治疗方法的反应不佳,病情易恶化,因药物使用剂量过大或疗程过长而引起的毒性反应增大,生活质量明显下降,出血和感染性疾病的发病率和死亡率也相对更高。一项来自法国图卢兹大学临床研究中心的观察性研究聚焦于TPO-RA(罗普司亭和艾曲泊帕)治疗失败后的难治性ITP患者,结果显示7,中位随访30.3个月,所有患者均经历了出血事件(包括1例颅内出血),24.1%的患者经历感染,12.8%的患者发生血栓。此外,随访期间门诊就诊与再次住院的频率较高,且累计住院时间长达31天。由此可见,难治性ITP患者面临着沉重的疾病负担,尤其是频繁的出血、感染风险、血栓形成及持续的医疗干预使其身心俱疲。因此,临床迫切需要寻找新的治疗策略,引领难治性ITP患者走出疾病的泥潭。
破局而出,迎接光明:海曲泊帕为难治性ITP患者照亮治疗新路径
海曲泊帕是新一代小分子、非肽类TPO-RA,可与TPO-R的跨膜区相结合,从而激活TPO-R依赖的STAT、PI3K和ERK信号转导通路,刺激巨核细胞增殖和分化,促进血小板生成8,9。与此同时,在结构方面,海曲泊帕也在艾曲泊帕的基础上进行了改构升级,达到了增效减毒的效果4。
针对既往接受ITP治疗或脾切除术后反应不佳或复发的成人ITP患者,海曲泊帕的III期临床研究结果显示5,治疗8周后,海曲泊帕组达到治疗反应的患者比例明显高于安慰剂组(海曲泊帕2.5 mg vs. 海曲泊帕5 mg vs. 安慰剂:58.9% vs. 64.3% vs. 5.9%,P<0.0001)。此外,海曲泊帕组的患者病情缓解比例更高、治疗反应维持的时间更长、在24周内有可持续的血小板应答,同时降低了出血事件和抢救治疗的需求,而其不良事件的发生率与安慰剂相似,安全性可控,患者总体耐受性好。这一结果确证了海曲泊帕在难治性ITP治疗上的临床价值。
除此之外,在第28届欧洲血液协会年会(EHA)上公布的海曲泊帕治疗ITP的真实世界研究结果也进一步验证了其疗效10,所有入组患者均有糖皮质激素治疗史。治疗1个月时,34.5%的患者达到完全反应,总有效率高达79.3%。在这些对治疗有应答的患者中,86.9%的患者的疗效得以维持,其中34.5%的患者持续用药超过6个月,平均持续应答时间为65天。对于重型ITP患者,海曲泊帕同样显示出良好的疗效,43.8%的患者达完全反应,总有效率为75%。
综合上述研究,海曲泊帕在治疗ITP,特别是难治性ITP方面,展现了高效的提升PLT计数能力,降低了患者的出血风险,并为患者带来持续获益。目前,海曲泊帕已在中国获批用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性ITP成年患者,以提高PLT计数并减少或防止出血8。
疗效确切,脱颖而出:海曲泊帕为其他TPO-RA耐药患者重启胜利篇章
值得注意的是,对于那些对其他TPO-RA药物无效的患者,海曲泊帕也表现出了确切的疗效。目前临床上常见的TPO-RA主要是肽类和非肽类两种,两者的结合位点有所不同。肽类TPO-RA主要与TPO受体的胞外段结合,竞争内源性TPO受体结合位点;而非肽类TPO-RA通常与TPO受体的跨膜结构域相互作用,且不与内源性TPO分子竞争结合位点,与内源性TPO具有累加效应11。基于此,医学界积极探索TPO-RA间的转换策略,且取得了可喜的结果。2020版中国指南也推荐对于一种促血小板生成药物无效或不耐受患者,更换其他促血小板生成药物或采用序贯疗法可能使患者获益1。
海曲泊帕作为非肽类TPO-RA的代表药物之一,通过对结构进行修饰来提高效力、降低毒性12。临床前试验数据证明,海曲泊帕能刺激TPO受体阳性的32D-MPL细胞的增殖,抑制其凋亡,且刺激增殖的效果强于艾曲泊帕13。临床III期研究的后续分析也有力地支持了海曲泊帕在转换治疗中的价值14。数据显示,患者在转用海曲泊帕治疗前,中位基线PLT计数为69×109/L,1/3的患者在经艾曲泊帕治疗后未达到持续缓解。然而,转用海曲泊帕后,大部分患者(88.9%)达血小板应答(PLT≥50×109/L),并且在既往PLT<30×109/L的患者中,66.7%的患者达到缓解;在既往30×109/L<PLT<50×109/L的患者中,88.9%的患者达到缓解。此外,患者中位最大持续缓解持续时间为78天,中位总缓解持续时间为104天。
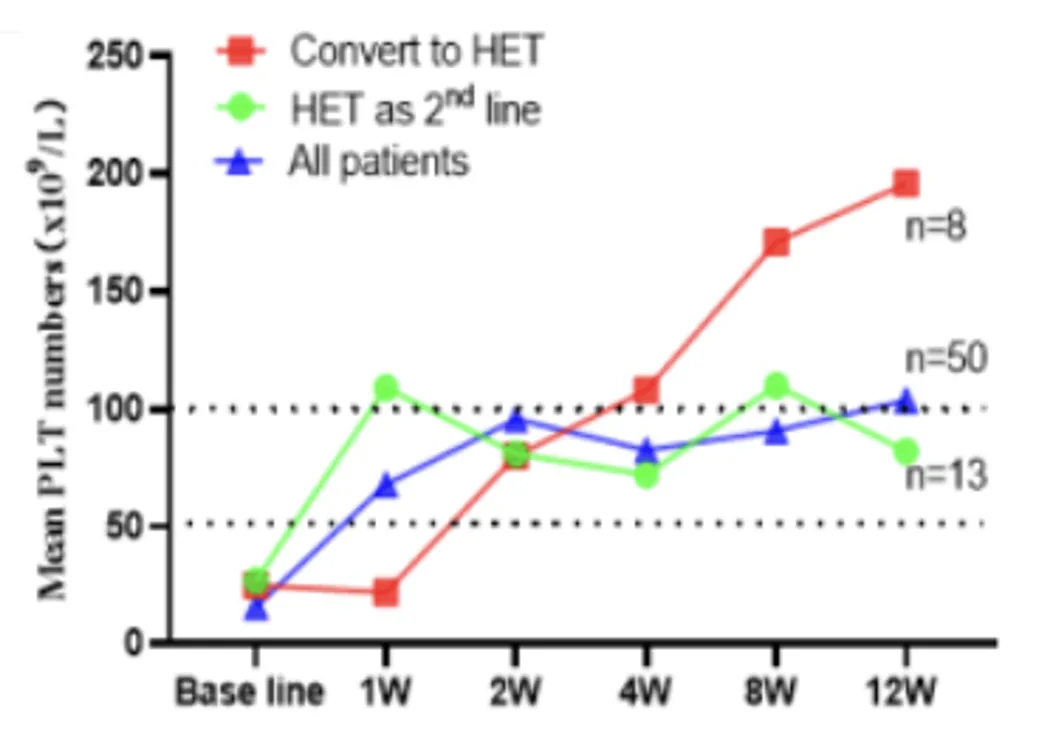
值得注意的是,一项针对复发/难治性(R/R)ITP的真实世界研究也进一步验证了从其他TPO-RA转用海曲泊帕治疗的有效性6。该研究纳入治疗线数多、病程长且PLT计数低,治疗难度较大的慢性ITP病例。在从艾曲泊帕转换至海曲泊帕的8例患者中,高达88%的患者获得了临床缓解。转换前患者的中位PLT计数为25×109/L,转换后第4、8、12周中位PLT计数分别为208×109/L、171×109/L、196×109/L(图1)。这充分说明,即便对艾曲泊帕治疗无反应的患者,仍然能通过海曲泊帕治疗达到临床获益,这彰显了海曲泊帕在TPO-RA转换治疗策略中的重要地位。
总结
难治性ITP的治疗与管理至今仍是临床实践中的一个复杂难题,优化该领域的临床策略因而成为研究的前沿焦点。海曲泊帕作为我国自主研发的创新成果,是一种新型口服、小分子、非肽类TPO-RA,其疗效及安全性已通过广泛的循证医学研究得到验证,尤其在难治性ITP治疗方面展示出巨大潜力。该药针对难治性ITP患者,能够迅速提升PLT计数,有效降低出血风险,为患者带来持续获益。尤为值得一提的是,即使既往对其他TPO-RA类药物反应不佳的患者,转换至海曲泊帕治疗后,仍可获得缓解。鉴于海曲泊帕确切的疗效与可靠的安全性,相信在未来的临床实践中,该药将为更多饱受难治性ITP困扰的患者开启新的希望之门,带来更为深远的临床获益与生命质量的提升。
1. 中华医学会血液学分会血栓与止血学组. 成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)[J/OL]. 中华血液学杂志, 2020, 41(08): 617-623.
2. 梁子杨,张国扬,娜仁朵兰,等.免疫性血小板减少症治疗新进展[J].血栓与止血学,2023,29(02):89-96.
3. Miltiadous O, Hou M, Bussel JB. Identifying and treating refractory ITP: difficulty in diagnosis and role of combination treatment. Blood. 2020 Feb 13;135(7):472-490.
4. Zheng L, Liang MZ, Zeng XL, et al. Safety, pharmacokinetics and pharmacodynamics of hetrombopag olamine, a novel TPO-R agonist, in healthy individuals. Basic Clin Pharmacol Toxicol, 2017, 121(5): 414-422.
5. Mei H, Liu X, Li Y, Zhou H, et al. A multicenter, randomized phase III trial of hetrombopag: a novel thrombopoietin receptor agonist for the treatment of immune thrombocytopenia. J Hematol Oncol. 2021 Feb 25;14(1):37.
6. EHA Library. Feng Y. 06/08/2023; 387699; PB2606.
7. Moulis G, Rueter M, Duvivier A, et al. Difficult-to-treat primary immune thrombocytopenia in adults: Prevalence and burden. Results from the CARMEN-France registry. Br J Haematol. 2024 Apr;204(4):1476-1482.
8. 中国临床肿瘤学会(CSCO)抗肿瘤药物治疗安全管理专家委员会. 海曲泊帕临床应用指导原则[J]. 白血病·淋巴瘤,2022,31(10):577-582.
9. Peng G, He G, Chang H, et al. A multicenter phase II study on the efficacy and safety of hetrombopag in patients with severe aplastic anemia refractory to immunosuppressive therapy. Ther Adv Hematol. 2022 Mar 30;13:20406207221085197.
10. EHA Library. Zhou H. 06/08/2023; 387714; PB2621.
11. 中华医学会血液学分会血栓与止血学组,侯明,胡豫,王琳,彭军.促血小板生成药物临床应用管理中国专家共识(2023年版)[J].中华血液学杂志,2023,44(7):535-542.
12. Syed YY. Hetrombopag: First Approval. Drugs. 2021 Sep;81(13):1581-1585.
13. Xie C, Zhao H, Bao X, et al. Pharmacological characterization of hetrombopag, a novel orally active human thrombopoietin receptor agonist. J Cell Mol Med. 2018 Nov;22(11):5367-5377.
14. Yu Hu, et al. Switching from Eltrombopag to Hetrombopag in Patients with Primary Immune Thrombocytopenia (ITP): Post-Hoc Analysis of a Multicenter, Randomized Phase III Trial. Blood (2022) 140 (Supplement 1): 5543–5545.
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


