作为肿瘤治疗领域的国际盛会,2024年世界肺癌大会(WCLC)和欧洲肿瘤内科学会(ESMO)年会已分别于美国圣迭戈和西班牙巴塞罗那盛大召开。在今年的WCLC和ESMO年会上,众多前沿研究的发布和更新,为广大肺癌患者的长期生存提供了新的希望。基于此,【肿瘤资讯】特邀同济大学附属上海市肺科医院任胜祥教授深入解读肺癌领域前沿进展,分享对肺癌诊疗未来发展的见解。
同济大学附属上海市肺科医院肿瘤科行政主任
IASLC 教育委员会委员中国医促会胸部肿瘤分会秘书长
中国抗癌协会肿瘤药物临床研究专委会青委会副主委
上海市抗癌协会肺癌分子靶向免疫治疗委员会副主委
中国老年病协会肿瘤专业委员会常务委员
上海市抗癌协会肿瘤呼吸内镜学专业委员会常务委员
CSCO 非小细胞肺癌委员会常务委员
CSCO 青年委员会常务委员
CSCO 免疫专家委员会委员
EGFR阳性晚期NSCLC:重磅药物为一线治疗注入新鲜血液
在本届大会上,众多创新性的研究进展为肺癌治疗领域注入了新的活力,特别是对携带EGFR突变的晚期非小细胞肺癌(NSCLC)的传统一线治疗方案带来了重大影响。随着抗肿瘤药物和治疗方法的快速进步,将这些新药物和治疗模式纳入一线治疗策略变得至关重要,这不仅为未来的临床治疗提供了清晰的指引,也有望改善该类患者的预后。
任胜祥教授指出,在今年的WCLC大会上,针对EGFR突变NSCLC一线治疗的经典人群的研究,还是有很多可圈可点的地方。EGFR突变的一线治疗,已经从既往的单药治疗逐渐向联合治疗进行过渡。大会中展示的多项研究一致证实了包括EGFR/间质-上皮细胞转化因子(MET)双特异性抗体Amivantamab联合第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)Lazertinib或奥希替尼联合化疗的联合方案在治疗EGFR阳性晚期NSCLC患者时,作为一线治疗方案的显著疗效,为临床治疗开辟了新的道路。
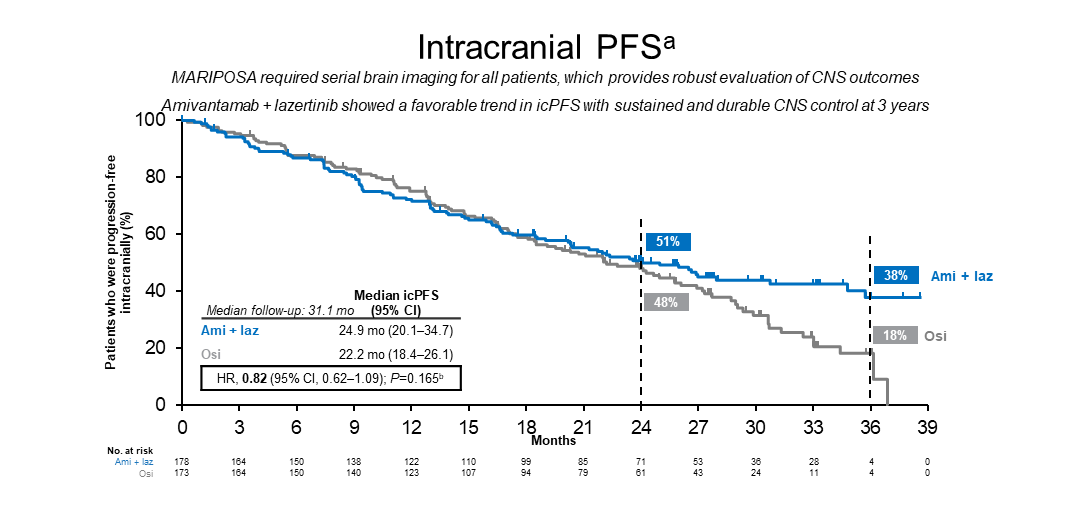
MARIPOSA[1]研究以及FLAURA2[2]在今年的大会上都有相应的数据更新。MARIPOSA[1]研究报道了更长随访时间的总生存期(OS)数据更新:随着更长时间的随访(中位随访31.1个月),一线Amivantamab+Lazertinib方案(Ami-Laz)较奥希替尼单药(Osi)观察到更显著的OS获益(图1),中位OS NE vs 37.3个月 (HR, 0.77; 95% CI, 0.61-0.96; nominal P=0.019)。OS曲线早期分离,而且随着时间推移越来越宽。Ami-Laz联合治疗较Osi也显示出对中枢神经系统(CNS)更持久的颅内进展控制疗效(图2):3年颅内无进展生存期(PFS)率为Osi组2倍多(38% vs 18%); 3年颅内持续缓解时间(DOR)率51% (vs 0%)。基于良好的疗效,美国食品药品监督管理局(FDA)于今年8月19日批准了Amivantamab+Lazertinib用于具有EGFR外显子19缺失或外显子21 L858R替代突变的局部晚期或转移性NSCLC患者的一线治疗[3]。目前,该方案已被《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2024》增加在“Ⅳ期EGFR敏感突变NSCLC一线治疗”的文字描述中[4]。近期公布的《美国国家综合癌症网络(NCCN)非小细胞肺癌临床实践指南(2024 v9)》[5]也已将其列为针对此类患者优选推荐的一线标准治疗方案。
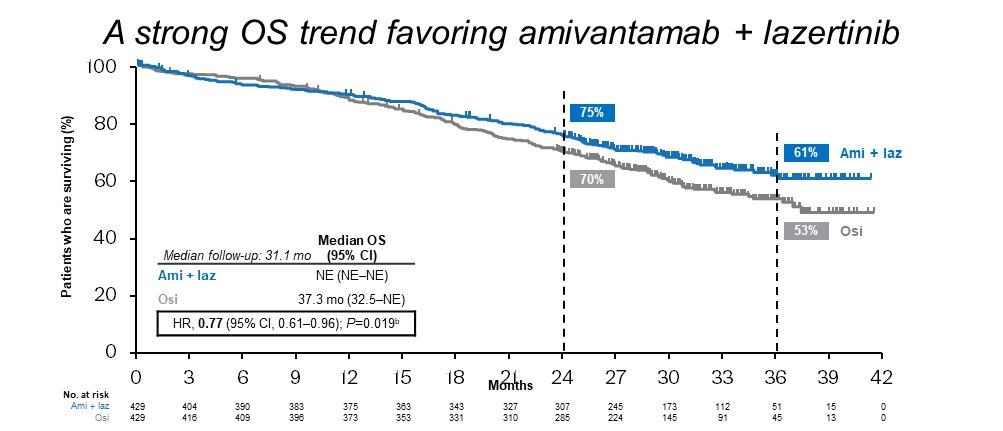
图1 Ami-Laz联合治疗较Osi观察到更显著的OS获益
临床医生在考虑治疗方案时,除了关注药物的疗效外,还必须重视治疗的安全性和便利性。在实践中,静脉注射Amivantamab时,患者可能会经历一些不良反应,尤其是输液反应(IRRs)。IRR主要发生在首次治疗时且通过预防给药可有效管理,但可能会影响医患的治疗体验。任胜祥教授介绍到,“在今年WCLC大会上我也关注到两项临床研究III期PALOMA-3研究[6]和II期SKIPPirr研究[7],前者着重于探索Amivantamab采用皮下注射和静脉输注疗效和安全性的比较,后者着眼于降低与静脉输注Amivantamab相关的IRRs的预防策略。”其中SKIPPirr研究的预防给药模式(在标准预防性处理基础上,在给药前两天每日两次口服地塞米松8mg,给药当日服用一次)与现有标准管理方案相比,降低了近3倍 IRR发生率(从67.4%降至22.5%)(图3)。
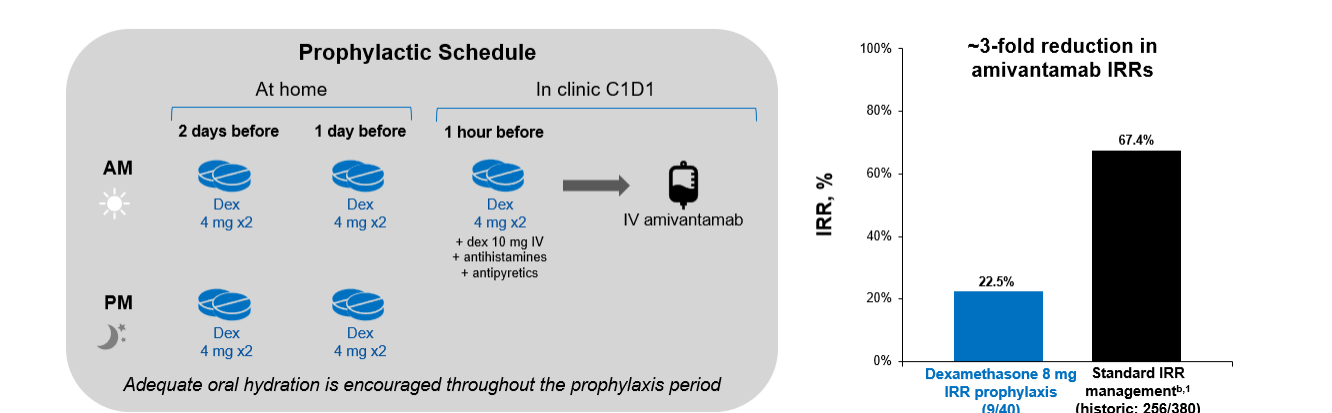
图3 SKIPPirr模式与现有标准管理方案相比降低了近3倍 IRR发生率
PALOMA-3研究在今年ASCO中公布的数据[8]提示:Amivantamab皮下剂型对比静脉剂型在显著减少了患者5倍的IRR发生率(13% vs 66%)的同时,甚至观察到了OS的延长。本次大会进一步公布了PALOMA-3研究中皮下给药的便利性相关数据[6],第一次注射Patient Time in Chair的时间约24分钟(vs 静脉输注方式的6.5小时),仅14%的患者报告有注射位置疼痛,分别仅5%的患者发现注射位置红肿或肿胀。这些研究的结果有望提升临床实践中患者和医疗保健专业人士的治疗体验和信心。
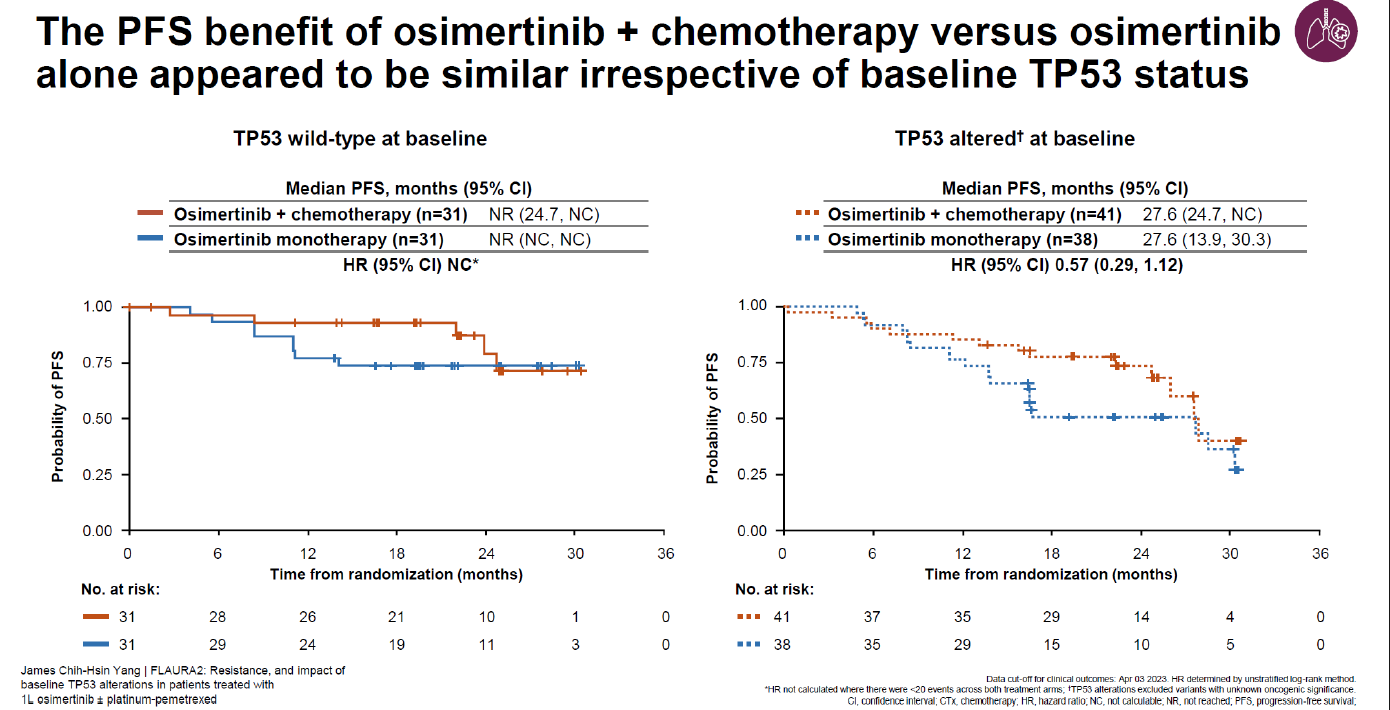
除此之外,FLAURA2[2]研究也进行了亚组分析的报告。分析共纳入181例患者(奥希替尼联合化疗组76例,奥希替尼单药组105例),结果显示,两组患者耐药机制相似,最常见的获得性耐药突变是C797S突变(在单药组中较为突出)和MET扩增,同时两组间基线与疾病进展时的肿瘤突变负荷未见显著变化。无论基线 TP53 是否改变,奥希替尼联合化疗较TKI单药治疗均有获益。在TP53共突变人群中,奥希替尼联合化疗vs奥希替尼单药mPFS数值相同均为 27.6个月HR, 0.57 (0.29,1.12)(图4)。
攻坚EGFR阳性NSCLC靶向治疗耐药性难题:联合发声聚焦抗癌新药
经过EGFR-TKIs一线治疗的EGFR突变晚期NSCLC患者,不可避免地会发展出对治疗药物的耐药性。寻找有效的后续治疗方案已成为当前研究的热点和挑战。任胜祥教授特别指出,在今年的世界肺癌大会上,有包括抗体偶联药物(ADC)的一些新数据的发布,其反映了在EGFR-TKI耐药人群中的最新研究结果。这些数据不仅为面临耐药挑战的患者带来了新的治疗希望,也为临床医生在制定治疗策略时提供了更多的选择。
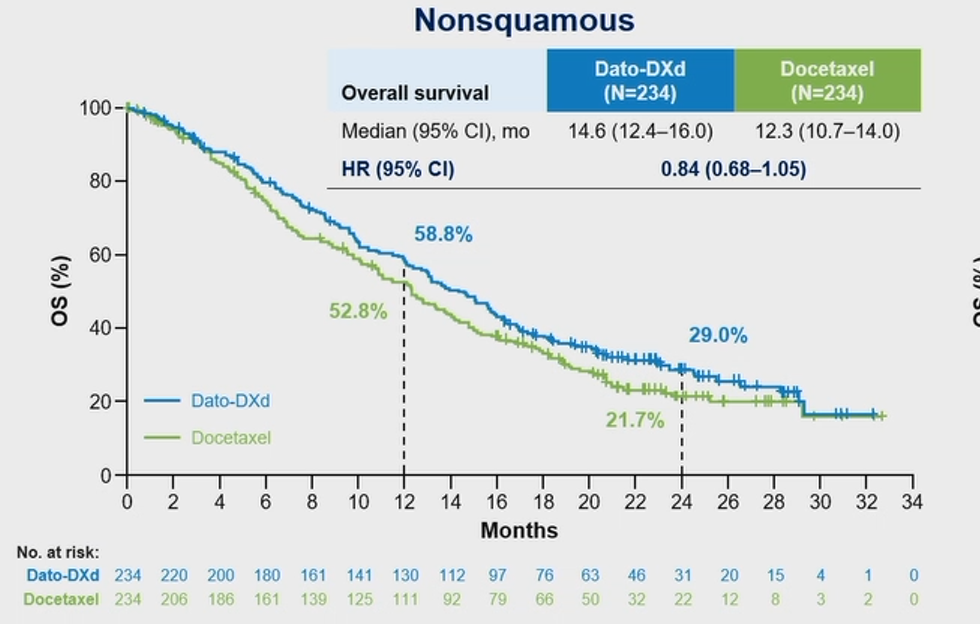
TROPION-Lung01[9]这项临床研究,是TROP-2的ADC药物Datopotamab deruxtecan(Dato-DXd)与多西他赛在经治的NSCLC患者中对照治疗的临床研究。结果显示(图5),在非鳞状亚组中,Dato-DXd 组的中位 OS 在数值上更佳:Dato-DXd 组为 14.6 个月(95% CI,12.4-16.0),多西他赛组为 12.3 个月(95% CI,10.7-14.0)(HR 0.84;95% CI,0.68-1.05)。更重要的是,对于携带EGFR突变的亚组人群,采用Dato-DXd治疗后,其客观缓解率(ORR)和PFS均优于野生型EGFR的患者。值得注意的是,本次大会也报道了该研究中通过定量连续评分法(QCS)计算的 TROP-2 归一化膜比值(NMR)预测 Dato-DXd 疗效的探索性分析结果。研究中采集到的患者组织样本,可为每个样本中的肿瘤细胞生成NMR。如果大多数(≥75%)肿瘤细胞的比值低于预定值(≤0.56),则患者的肿瘤被视为 TROP-2 QCS-NMR阳性,这表明细胞质中TROP-2 的比例相对更高。经分析发现,TROP-2 QCS-NMR阳性在非鳞NSCLC患者的检出率高于鳞癌患者,分别66%和44%。对于TROP-2 QCS-NMR阳性的肿瘤患者,与多西他赛相比,Dato-DXd可将疾病进展或死亡风险降低43%(中位PFS 为 6.9个月 vs 4.1个月;[HR] 0.57;95% [CI] 0.41-0.79)。基于该数据 TROP-2 QCS-NMR 有望成为 Dato-DXd 疗效预测的生物标志物。正是基于TROPION-Lung01的结果,目前国内外正在进行多项针对EGFR-TKI耐药后的ADC治疗的临床研究,包括针对HER3的ADC、针对EGFR HER2的ADC,以及双特异性抗体偶联药物(BsAb-ADC)等一系列ADC药物的研发。这些研究旨在进一步探索和验证ADC药物在耐药肺癌患者中的疗效和安全性。
任胜祥教授强调在癌症治疗中,一旦患者对一线治疗药物产生耐药性,我们采取的另一治疗策略是明确耐药的分子机制。根据不同的耐药机制,选择后续的个性化药物治疗方案。尽管在这一领域过去的进展有限,今年的WCLC大会上还是涌现了一些可能对未来临床实践和研究产生影响的新数据。MARIPOSA[10]临床研究的模式,即Amivantamab+Lazertinib联合治疗模式,已经显示出相较于单纯的EGFR-TKI单药治疗明显的有效性优势。但必须关注的是:一线治疗不同模式的治疗,带来患者获得性耐药的差异可能进一步影响患者的长期预后。我们期待这一数据在2024 ESMO年会中公布以指导临床在一线治疗中的选择。
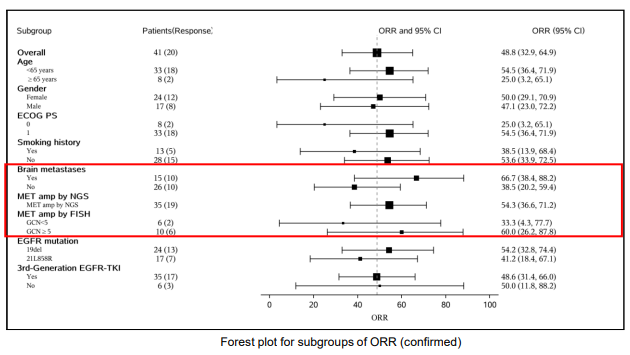
除了MARIPOSA临床研究即将展示的结果外,在今年的WCLC大会上,任胜祥教授还留意到周彩存教授团队公布了NCT06343064[11]采用MET抑制剂伯瑞替尼联合尚未在国内市场上市的第三代EGFR-TKI PLB1004进行的临床研究结果。该研究同样显示(图6),在既往接受第三代EGFR-TKI治疗的患者中,如果患者存在MET基因扩增,采用MET抑制剂联合第三代EGFR-TKI的治疗方案,整体患者的ORR为48.8%,亚组分析显示,经NGS检测伴MET扩增患者的ORR为54.3%。这些研究结果,包括对EGFR-TKI耐药机制的分析,再次强调了在EGFR突变的NSCLC患者中,EGFR突变和MET基因扩增都是重要的治疗靶点,双重抑制策略可能实现非常理想的抗肿瘤治疗效果。
EGFR ex20ins突变:新药优异的临床获益为患者带来曙光
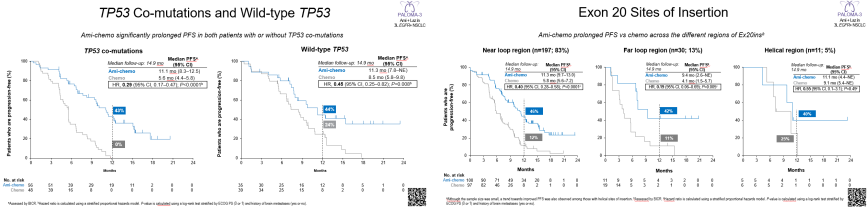
在携带EGFR突变的NSCLC患者中,除了常见的敏感突变外,EGFR基因的第20外显子插入突变也是近年来研究的焦点。今年3月1日,FDA批准Amivantamab联合卡铂与培美曲塞用于EGFR ex20ins突变阳性局部晚期或转移性NSCLC患者的一线治疗,成为该领域首个获批的一线靶向疗法[12]。在二线治疗中,国内也已批准了舒沃替尼的使用。对于一线Amivantamab联合化疗治疗的适应人群,今年的WCLC大会上PAPILLON[13]展示的数据表明(图7)Amivantamab+卡铂+培美曲塞(ACP)方案较化疗在所有伴高危因素的患者中均体现了疗效优势:基线ctDNA阳性 (HR, 0.38; P<0.0001),治疗6周后ctDNA阳性 (HR, 0.55; P=0.098),TP53共突变 (HR, 0.29; P<0.001)。同时我们观察到:ACP方案在携带不同插入位置Ex20ins突变患者中PFS获益一致。基于在中国的可及性,《CSCO NSCLC指南2024》中仍将ACP方案其列为该类患者一线治疗的Ⅲ级推荐[4],在《美国国家综合癌症网络(NCCN)非小细胞肺癌临床实践指南(2024 v9)》已将其列为针对此类患者优选推荐的一线标准治疗方案[14]。与此同时,国际上有多款针对EGFR第20外显子插入突变的EGFR-TKI药物正在进行III期临床研究。我们期待这些研究能够尽快公布一线治疗的数据,以期为一线治疗提供更多的选择。
总结
作为世界上具有重要影响力的癌症学术会议,每一届的WCLC大会和ESMO年会都会公布众多重磅研究结果,并为癌症患者的诊疗策略带来新思路和新选择。今年的WCLC大会和ESMO年会也在NSCLC领域公布了多项高质量的研究,相信随着对肺癌领域的研究不断深入,未来一定会有更精准、高效和权威的诊疗策略,未来NSCLC患者也将获得更多的临床获益。
1..Shirish Gadgeel,Amivantamab Plus Lazertinib vs Osimertinib in First-line EGFR-mutant Advanced NSCLC: Longer Follow-up of the MARIPOSA Study.2024 WCLC,OA02.03.
2.James CH Yang,FLAURA2: Resistance, and Impact of Baseline TP53 Alterations in Patients Treated With 1L Osimertinib ± Platinum-Pemetrexed.2024 WCLC,MA12.03.
3. FDA approves lazertinib with amivantamab-vmjw for non-small lung cancer. FDA. August 19, 2024, Accessed August 20, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lazertinib-amivantamab-vmjw-non-small-lung-cancer
4. IⅤ期驱动基因阳性非小细胞肺癌的治疗,中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2024, Accessed April, 2024.
5. Updates in Version 6.2024 of the NCCN Guidelines for Non-Small Cell Lung Cancer from Version 5.2024, NCCN Guidelines Version 9.2024- Non-Small Cell Lung Cancer.
6. M. Alexander, Subcutaneous vs Intravenous Amivantamab: Patient Satisfaction and Resource Utilization Results from the PALOMA-3 Study.2024 WCLC, OA09.05.
7. Preventing Infusion-Related Reactions with Intravenous Amivantamab: Primary Results from SKIPPirr, a Phase 2 Study. 2024 WCLC, MA12.08.
8. Natasha B. Leighl et al., Subcutaneous versus Intravenous Amivantamab, both in Combination with Lazertinib, in Refractory EGFR-mutated NSCLC: Primary Results from the Phase 3 PALOMA-3 Study. JCO 0, JCO.24.01001
DOI:10.1200/JCO.24.01001
9. J. Sands, Datopotamab Deruxtecan Vs Docetaxel in Patients with Non-Small Cell Lung Cancer: Final Overall Survival from TROPION-Lung01. 2024 WCLC, OA08.03.
10. Benjamin Besse , Mechanisms of acquired resistance to first-line amivantamab plus Lazertinib versus osimertinib in patients with EGFR-mutant advanced non-small cell lung cancer: An early analysis from the phase III MARIPOSA study. 2024 ESMO, LBA55.
11. 周彩存、周斐、李玮,Vebreltinib Plus PLB1004 In EGFR-Mutated, NSCLC with MET Amplification or MET Overexpression Following EGFR-TKI.2024 WCLC,MA12.11.
12. FDA approves amivantamab-vmjw for EGFR exon 20 insertion-mutated non-small cell lung cancer indications. March 1, 2024, Accessed March 1, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-amivantamab-vmjw-egfr-exon-20-insertion-mutated-non-small-cell-lung-cancer-indications.
13. Jonathan Goldman,PAPILLON:TP53 Co-mutations, Sites of Insertion, and ctDNA Clearance Among Patients with EGFR Ex20ins-Mutated Advanced NSCLC.2024 WCLC,MA12.06.
14. Updates in Version 1.2024 of the NCCN Guidelines for Non-Small Cell Lung Cancer from Version 5.2023,NCCN Guidelines Version 9.2024- Non-Small Cell Lung Cancer.
CRC Code : EM-166127
Approval date: 2024-09-18
排版编辑:肿瘤资讯-Zika
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅ “本资料中涉及的AE/SS/PQC已按照公司的要求上报。”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


