本文介绍了保乳手术的历史与发展,并深入探讨了乳腺癌手术领域的两个关键热点话题——手术切缘的适宜宽度以及在特定条件下保乳手术后豁免放疗的可能性,旨在为临床实践提供指导和参考。
保乳手术的历史与发展1
乳腺癌保乳手术(BCS)的发展始于20世纪70年代,匹兹堡大学 Fisher教授借鉴希腊医学界 Galen的古老观点,提出了乳腺癌是一种全身性疾病的观点,认为其治疗的失败缘于远处转移,盲目扩大手术范围并不能显著改善患者预后。

缩小手术范围、BCS的可行性探索
1976-1984年,NSABP B-06试验纳入2163例肿瘤≤ 4 cm的乳腺癌患者,随机分为BCS+腋窝淋巴结清扫+术后放疗/不放疗组与乳腺癌改良根治术组,5年随访结果显示无论是否放疗(RT),BCS组无病生存、无远处转移生存、总生存率均不劣于乳腺癌改良根治术组。随后,该研究 8年、20年的随访数据进一步证实了BCS的长期安全性。但 NSABP B-06研究同时也发现未接受RT的BCS患者局部复发率明显增高。
BCS+RT的价值
1977年,Milan研究的初步结果证实BCS+RT与乳房切除术的总生存率差异无统计学意义,且BCS可减少术后并发症、改善患者生活质量,这一结果同样得到了更长时间随访数据的支持。随后,1986-1996年进行的欧洲癌症研究与治疗组织(EORTC)10853研究显示与乳腺导管原位癌 (DCIS)单独局部切除相比,局部切除+RT降低了患者的同侧乳腺浸润性和非浸润性复发的总数。1988年开始进行的 NSABP B-17研究也证实了BCS+RT治疗DCIS的临床价值。
关键议题:BCS后豁免RT?
2024年8月7日,The Lancet Oncology期刊发表了苏格兰14个医疗中心患者BCS后RT的30年随访结果2。该随机对照Ⅲ期试验,纳入了年龄<70岁、早期乳腺癌(肿瘤≤4 cm ,T1/T2和N0/N1)女性。术后患者被随机分配(1:1)到局部或局部区域RT组和无RT组。研究发现,RT组的局部控制(以同侧乳腺肿瘤复发为衡量标准)明显优于无RT组(16% vs 36%)。然而,这种效果仅在随访的前10年内明显,而在随后的20年中无进一步获益。值得关注的是,两组间的OS无显著差异。
因此,并不是所有患者都适合术后RT,如何识别可能从豁免RT中受益的患者特征是研究的关键。
哪些患者适合豁免RT?
BCS豁免RT是否可用于中、低级别DCIS?
美国东部肿瘤协作组(ECOG)1997-2002年进行了ECOG-ACRIN E5194研究,结果显示低危DCIS在保乳术后 5年的同侧乳房复发率在可接受范围,而高级别DCIS仅行局部切除是不可行的,提出对DCIS进行遗传学检测来指导手术方式的选择。
年龄、病理信息、辅助检查指导RT?
E4112研究3分析了MRI对DCIS患者手术治疗及基于12基因DCIS评分(DS)对广泛局部切除(WLE)后RT使用的影响。5年随访结果支持低DS评分(< 39)的DCIS患者术后可考虑豁免RT,仅在中/高DS评分患者中联合RT。
2023年2月,NEJM报道了PRIMEⅡ研究4的10年研究结局。该研究表明,对于年龄 ≥65岁、组织学分级1或2级、ER高表达、淋巴结阴性乳腺癌女性患者,接受保乳治疗后,接受为期5年辅助内分泌治疗,可以安全地豁免RT。
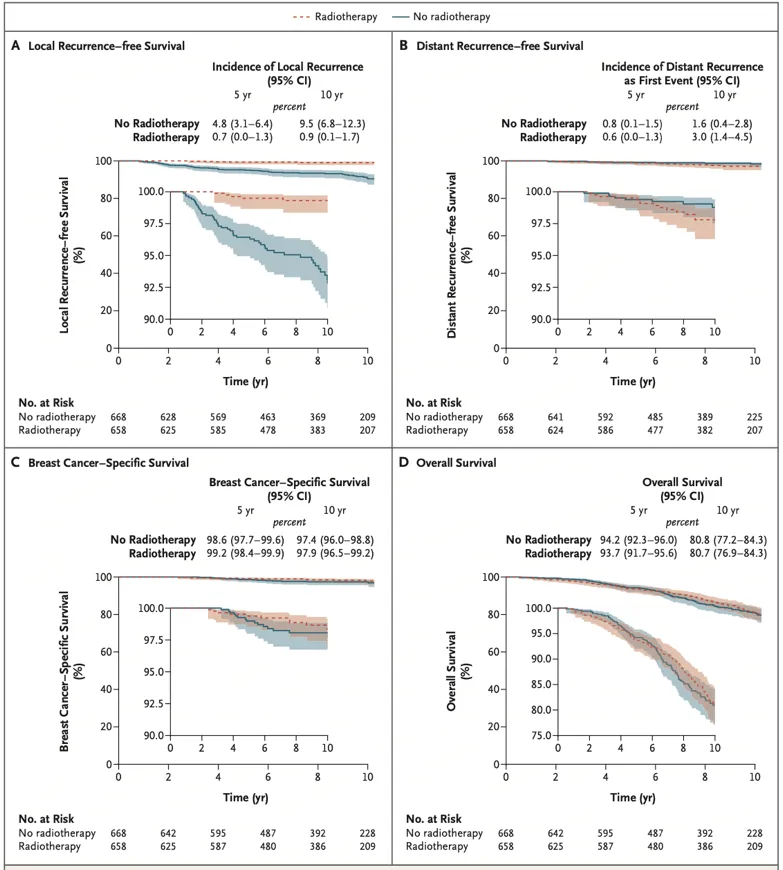
2023年8月,NEJM发表了LUMINA研究5的成果。该研究探讨了在BCS后5年内仅接受辅助内分泌治疗的luminal A型乳腺癌患者,是否可以安全地豁免RT。研究结果证实,年龄≥55岁、肿瘤分期为T1N0M0、组织学分级为1或2级,并且为luminal A型的乳腺癌患者,在保乳手术后接受5年的内分泌治疗,其5年局部复发率极低。这类患者适合采用豁免RT的治疗策略。
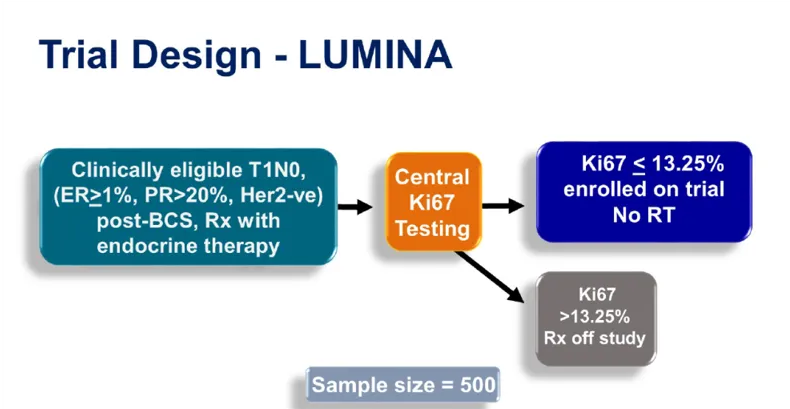
IDEA研究6旨在探索50-69岁绝经后患者是否可以豁免RT。研究纳入50-69岁绝经后 pT1N0 单灶浸润性乳腺癌患者,BCS后边缘≥2 mm,肿瘤为ER+、PR+ 和HER2-,Oncotype DX 21复发风险评分(RS)≤18。如果患者同意接受至少5年的内分泌治疗和研究监测,则有资格豁免RT。结果显示,50-59岁和60-69岁患者在整个随访期间的同侧乳房事件 (IBE)粗发生率分别为3.3%和3.6%;总体复发粗发生率分别为5.0%和3.6%。
该多中心试验结果表明,采用基因组检测结合临床生物学特征来选择治疗方法,使绝经后I期乳腺癌患者(包括年龄<60岁者)达到了非常低的5年复发率。与之前的前瞻性试验相比,如PRIME II研究中最小年龄为65岁,CALGB 9343研究中最小年龄为70岁,LUMINA研究中位年龄为67岁,IDEA研究纳入的患者人群年龄更小。
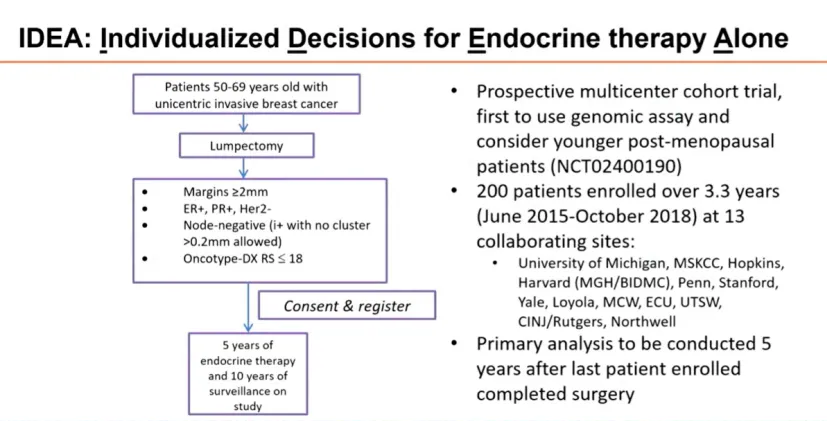
表1 相关研究设计汇总
2023年12月,PROSPECT研究7在The Lancet上发表。研究指出,在经过严格筛选的早期非三阴性小肿瘤乳腺癌患者中,术前MRI在11%的病例中检出了隐匿性恶性肿瘤。对于那些没有隐匿性恶性肿瘤且病理学表现良好的患者,豁免RT后的5年同侧浸润性复发率(IIRR)仅为1.0%。这些发现支持了MRI与病理学检测相结合可能有助于识别那些真正局限性的肿瘤。研究表明,对于MRI显示单一病灶且病理结果良好的患者,或可安全豁免RT。
基因指导RT决策
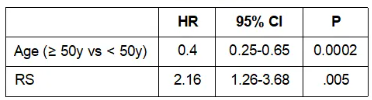
Mamounas团队的分析8发现,在他莫昔芬治疗患者中,局部区域复发(LRR)与21 基因RS和患者年龄相关。
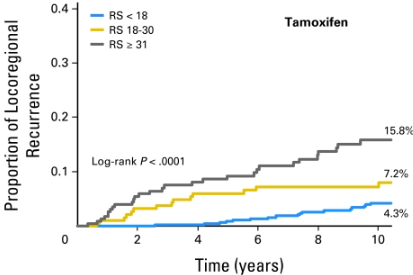
图4 他莫昔芬治疗患者的LRR比例8
表2 按照年龄和RS分组的比较结果8
2023年3月,JCO期刊发表一项基于三个随机对照试验的验证研究9,旨在确定复发风险低的基因谱,使这部分患者在BSC后可免除RT。该研究训练了一个名为“Profile for the Omission of Local Adjuvant Radiation (POLAR) ”的16基因标签,以预测乳腺癌LRR。将SweBCG91-RT 训练数据集中评分的第25百分位值,预设为评分高/低的临界值。
表3 POLAR 中最终确定的16 个基因

POLAR基因谱的意义:
预后:POLAR分数高的患者RT后LRR显著低于不RT患者。
预测:POLAR分值可预测RT的获益。POLAR分数高的患者可以从RT中获益,POLAR分数低的患者不能从RT中获益,因此这部分患者有可能在BCS后豁免RT。
POLAR是对局控有预后作用,又对RT获益有预测作用的基因谱,后续需要前瞻性临床研究去验证。
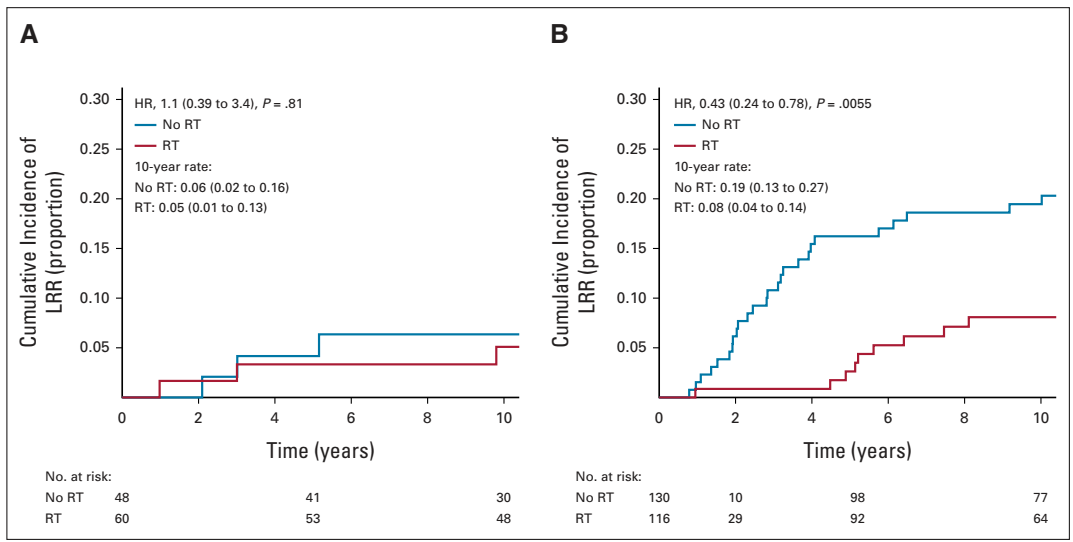
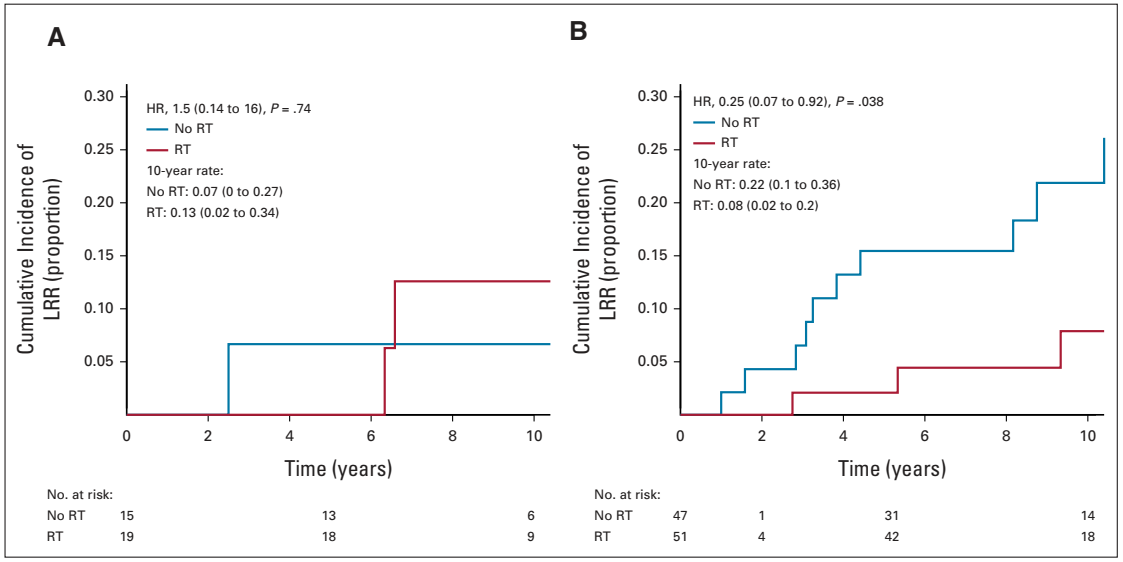
2024年6月,JCO发表了一项回顾性研究10分析结果。该研究分析了1994-2003年确诊单纯DCIS并且进行BCS±术后RT的1226例患者数据。该研究结果表明,与仅仅根据临床病理因素相比,临床病理因素+12基因RS或21基因RS可更准确地预测BCS后10年局部复发和浸润癌局部复发风险。21基因RS与12基因RS相比,虽然成本较高,但是并未改善对10年浸润癌局部复发风险的预测,因此12基因检测可为医患讨论增添宝贵的信息。
这些研究的进展表明,对于特定类型的乳腺癌患者,可以豁免RT,尤其是那些病理特征良好、肿瘤较小、激素受体阳性、淋巴结阴性的患者。这些发现正持续在临床研究中得到深入探讨和验证。
关键议题:保乳切缘的宽度?
在乳腺癌治疗领域,实现切缘安全(即阴性切缘)与保持乳房美观外形之间的平衡,对许多乳腺癌患者而言是一个重要挑战。
既往研究显示,无差别地扩大手术范围未能显著降低局部复发的风险。2014年,美国外科肿瘤学会(SSO)和美国放射肿瘤学会(ASTRO)综合了大量的回顾性研究数据,提出了新的阴性切缘标准:对于浸润性乳腺癌,定义“切缘无肿瘤着色”(No ink on tumor)即为达到阴性切缘的标准11。
随后,2016年SSO、ASTRO联合美国临床肿瘤学会(ASCO)将≥ 2 mm切缘定义为导管内癌的阴性切缘,并指出更大的切缘并不能降低复发率12。这两项阴性切缘的标准被欧洲肿瘤内科学会( ESMO)13、美国国立综合癌症网络(NCCN)14等乳腺癌指南采用。
至此,绝大多数国内外指南也均从局部复发风险考量,遵循“无墨为上”,但现行的安全切缘标准是否能让患者得到最佳获益?
2022年,英国曼彻斯特大学Nigel J Bundred教授领衔的研究团队,在BMJ期刊上发表关于保乳手术切缘距离的重磅研究成果15。该研究纳入了112140例接受保乳手术的I-III期乳腺癌患者,平均年龄中位数为56.1岁,随访时间至少60个月。研究旨在确定切缘受累与远处复发的相关性,并揭示最大限度减少早期乳腺浸润癌远处/局部复发所需的安全切缘。
与切缘阴性的患者相比:
切缘0.1-2mm:患者远处复发风险增加38%(P<0.001),局部复发风险增加109%(P<0.001);
切缘0.1-1mm:患者两种风险分别增加31%(P=0.08)和60%(P=0.007);
切缘1.1-2.0mm:患者两种风险分别增加40%(P=0.03)和81%(P=0.07)。
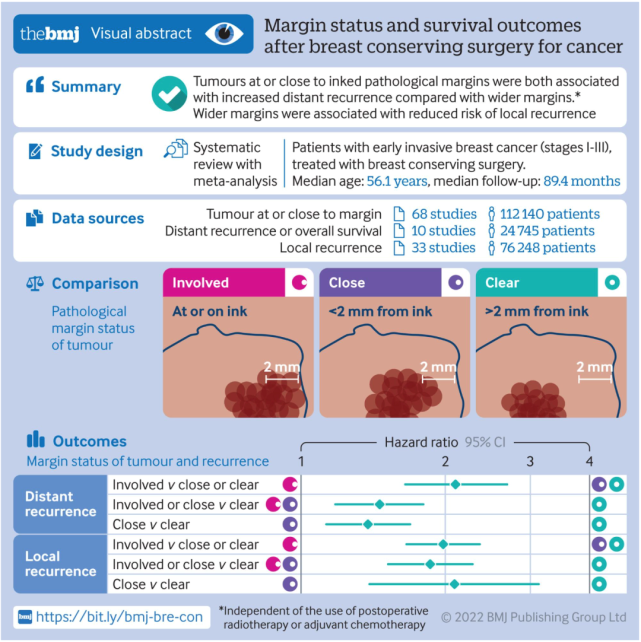
该项研究的数据15显示,较近切缘(虽然切缘染色处未见肿瘤细胞但<2mm)存在更高的局部和远处转移风险。因此,外科医师应努力保证墨染切缘无肿瘤宽度至少达到1mm,以最大限度地减少患者的复发风险。
因此,对于浸润性乳腺癌,盲目追求墨汁染色缘无肿瘤可能是不恰当的,且在实际临床工作中的可操作性也较差。中国早期乳腺癌保乳手术临床实践指南(2022版)16也指出,浸润性癌和DCIS阴性切缘标准12-14在实际临床工作中并非完全适合我国国情,不做常规推荐,专家组认为术中冰冻切片病理学评估切缘在我国具有广泛的临床应用基础,更加符合中国的临床实践。
保乳手术适应症及关键问题
中国早期乳腺癌保乳手术临床实践指南(2022版)16关于保乳手术的适应症、禁忌症和关键问题:
基本定义
肿瘤根治性手术应以治愈肿瘤为目的。保乳手术作为乳腺癌根治性手术方式之一已经获得广泛认同。
保乳手术是乳腺癌根治性手术的治疗方式之一(证据等级:Ⅰ类; 推荐强度:A级)。
适应证
符合以下所有条件:
(1)具有保乳意愿(证据等级:Ⅰ类; 推荐强度:A 级)
(2)临床Ⅰ期、Ⅱ期,≤T2(证据等级:Ⅰ类; 推荐强度:A级)
(3)术后可保留良好乳房外形(证据等级:Ⅰ类; 推荐强度:A级)
禁忌证
符合以下任意一项条件:
(1)不能接受全乳放疗(证据等级:Ⅰ类; 推荐强度:A级)
(2)无法达到切缘阴性(证据等级:Ⅰ类;推荐强度:A级)
(3)弥漫性分布的恶性钙化灶(证据等级:Ⅰ类;推荐强度:A级)
(4)炎性乳腺癌(证据等级:Ⅰ类;推荐强度:A级)
(5)拒绝接受保乳手术(证据等级:Ⅰ类; 推荐强度: A级)
外科临床问题
(1)保乳手术联合肿瘤整复技术可以避免畸形 ,改善术后外观(证据等级:Ⅱ类;推荐强度:A 级)
(2)保乳手术残腔推荐放置惰性金属夹(如钛夹)作为放疗瘤床加量照射的定位标记(证据等级:Ⅰ类;推荐强度:A级)
病理评价问题
(1)保乳手术必须对切缘进行评估(证据等级:Ⅰ类;推荐强度:A级)
(2)术中冰冻切片病理学切缘评估(证据等级:Ⅰ类;推荐强度:A级)
(3)术后石蜡病理学切缘评估(证据等级:Ⅰ类;推荐强度:A级)
(4)切缘评估方法:①肿瘤切缘法(垂直切除法)(证据等级:Ⅰ类;推荐强度:A 级)。②肿瘤切缘法(水平切除法)(证据等级:Ⅱ类;推荐强度:A级)。③腔周切缘评估法(证据等级:Ⅱ类;推荐强度:A级)
放疗问题
保乳术后需要接受全乳放疗(证据等级:Ⅰ类;推荐强度:A 级)。Ⅰ期、激素受体阳性及切缘阴性的65岁以上病人可考虑免除术后全乳放疗(CALGB9343)。
1. 李开富,康骅. 乳腺癌外科治疗的历史演变 [J]. 中国医刊, 2024, 59 (05): 465-471.
2. Williams LJ, Kunkler IH, Taylor KJ, et al. Postoperative radiotherapy in women with early operable breast cancer (Scottish Breast Conservation Trial): 30-year update of a randomised, controlled, phase 3 trial. Lancet Oncol. Published online August 7, 2024. doi:10.1016/S1470-2045(24)00347-4.
3. Seema Khan, MD. Magnetic Resonance Imaging and a 12-Gene Expression Assay to Optimize Local Therapy for Ductal Carcinoma In Situ: 5-year clinical outcomes of E4112. 2023 SABCS abstract GS03-01.
4. Kunkler IH, Williams LJ, Jack WJL, et al. Breast-Conserving Surgery with or without Irradiation in Early Breast Cancer. N Engl J Med. 2023 Feb 16;388(7):585-594. doi:10.1056/NEJMoa2207586.
5. Whelan, J.T. et al. (2023) Omitting Radiotherapy after Breast-Conserving Surgery in Luminal A Breast Cancer. The New England Journal of Medicine. doi: 10.1056/NEJMoa2302344.
6. Reshma Jagsi,Kent Griffith, Eleanor Harris, et al. Five-year outcomes of the IDEA trial of endocrine therapy without radiotherapy after breast-conserving surgery for postmenopausal patients aged 50-69 with genomically-selected favorable Stage I breast cancer. 2023 SABCS abstract GS02-08. https://doi.org/10.1158/1538-7445.SABCS23-GS02-08.
7. Mann GB, Skandarajah AR, Zdenkowski N, et al. Postoperative radiotherapy omission in selected patients with early breast cancer following preoperative breast MRI (PROSPECT): primary results of a prospective two-arm study. Lancet. 2023 Dec 5:S0140-6736(23)02476-5. doi: 10.1016/S0140-6736(23)02476-5.
8. Mamounas EP, Tang G, Fisher B, et al. Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative, estrogen receptor-positive breast cancer: results from NSABP B-14 and NSABP B-20. J Clin Oncol. 2010;28(10):1677-1683. doi:10.1200/JCO.2009.23.7610.
9. Sjöström M, Fyles A, Liu FF, et al. Development and Validation of a Genomic Profile for the Omission of Local Adjuvant Radiation in Breast Cancer [published correction appears in J Clin Oncol. 2023 Aug 1;41(22):3877. doi: 10.1200/JCO.23.00870] [published correction appears in J Clin Oncol. 2024 Mar 1;42(7):862. doi: 10.1200/JCO.24.00028]. J Clin Oncol. 2023;41(8):1533-1540. doi:10.1200/JCO.22.00655
10. Hahn E, Sutradhar R, Paszat L, et al. Molecular Expression Assays Improve the Prediction of Local and Invasive Local Recurrence After Breast-Conserving Surgery for Ductal Carcinoma In Situ. J Clin Oncol. Published online June 28, 2024. doi:10.1200/JCO.23.02276.
11. Moran MS, Schnitt SJ, Giuliano AE, et al. Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. J Clin Oncol. 2014;32(14):1507-1515. doi:10.1200/JCO.2013.53.3935.
12. MORROW M, VAN ZEE K J, SOLIN L J, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in ductal carcinoma in situ[J]. Pract Radiat Oncol, 2016, 6(5): 287-295.
13. LOIBL S, ANDRÉ F, BACHELOT T, et al. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up[J]. Ann Oncol, 2024, 35(2): 159-182.
14. NCCN. The NCCN breast cancer clinical practice guidelines in oncology (version 5.2023)[EB/OL]. Fort Washington: NCCN, 2023.
15. Bundred JR, Michael S, Stuart B, et al. Margin status and survival outcomes after breast cancer conservation surgery: prospectively registered systematic review and meta-analysis. BMJ. 2022;378:e070346. Published 2022 Sep 21. doi:10.1136/bmj-2022-070346
16. 宋尔卫,陈凯,刘荫华,等. 中国早期乳腺癌保乳手术临床实践指南(2022版) [J]. 中国实用外科杂志, 2022, 42 (02): 132-136.DOI:10.19538/j.cjps.issn1005-2208.2022.02.03.
排版编辑:肿瘤资讯-Jina












 苏公网安备32059002004080号
苏公网安备32059002004080号


