—— 写在《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》发表后
近日,《中国癌症杂志》发表了复旦大学附属肿瘤医院张剑教授所撰写的“关于乳腺癌患者绝经状态判断两个关键问题的临床思考”一文,文章立足临床实践,深入剖析了乳腺癌绝经状态判断中所面临的两大难点,以期为读者答疑解惑,带来临床启迪。具体内容见下:
内分泌治疗在激素受体阳性乳腺癌中扮演着至关重要的角色,并与患者的绝经状态密切相关[1-2]。该文旨在深入探讨乳腺癌患者绝经状态判断中的两个关键问题并给出个人临床思考。第一,针对绝经前患者添加卵巢功能抑制(OFS)药物治疗后,雌二醇(E2)数值仍超标可能存在“真性”超标和“假性”超标两种情况。研究显示氟维司群、阿贝西利、依西美坦、他莫昔芬等内分泌治疗药物可能干扰E2测定结果,需要警惕检测性“假性”超标的可能性。第二,在判断OFS治疗下患者是否已进入生理性绝经状态时,需考虑化疗对绝经状态的影响、围绝经期激素表现的复杂性等因素。建议根据患者年龄及内分泌治疗方案,考虑转换治疗并定期监测血清雌二醇(E2 ) 、卵泡刺激素(FSH)水平,针对疑难情况可综合抗缪勒管激素(AMH) 、抑制素B(INHB)、雄激素等指标进行评估。
负责复旦大学附属肿瘤医院Ⅰ期临床研究
同时担任复旦大学附属肿瘤医院福建医院临床研究中心主任/肿瘤内科常务副主任
现任中国医药教育协会肿瘤药物临床研究专业委员会主任委员
中国老年保健协会肿瘤防治与临床研究专业委员会主任委员
长江学术带乳腺联盟主任委员
上海市抗癌协会肿瘤药物临床研究专业委员会候任主任委员
中国抗癌协会乳腺癌专业委员会常委
中国抗癌协会乳腺癌专业委员会青委会副召集人
中国临床肿瘤学会乳腺癌专家委员会委员
中国抗癌协会肿瘤临床研究管理学专业委员会委员
上海“医苑新星”杰青人才获得者,曾担任国家药品监督管理局药品审评中心临床兼职审评员
获2023十大医学先锋专家、2023“人民好医生”杰出贡献奖
以第一作者、共同第一作者或通信作者在The Lancet Oncology、Annals of Oncology、Nature Communications、Clinical Cancer Research、Journal of Hematology & Oncology等SCI收录期刊上发表论文80篇
问题1:哪些情况可能导致绝经前患者使用OFS药物后E2数值仍然超标?您认为应如何处理这一问题?
张剑教授:目前,国内外权威指南均强调应通过多种标准评估患者使用OFS药物后的绝经状态,其中E2水平是重要的评估指标,在临床研究中,也会以E2水平作为标准评估患者的绝经状态[3-11]。然而,在临床实践中,一些绝经前患者可能在使用OFS药物后,仍然E2数值超标,其中涉及两个关键问题:如何设置绝经状态的E2阈值?如何确定E2超标为“真性超标”?对于第一个问题的答案,由于不同的临床研究设置了不同的阈值,因此E2水平的标准在临床实践中也尚未达成统一,结合个人临床经验,笔者认为可以将30pg/ml作为合适的阈值。
表1. 不同临床研究中对绝经的定义

确定了合适的E2标准后,第二个问题则是对E2超标状态的评估。“假性超标”是指由于受到常见的乳腺癌治疗药物或检测方法等因素的干扰,而得到了混淆的E2“超标”的评估结果;“真性超标”则是不受到混杂因素干扰的情况下实实在在的E2增高或波动。
在临床实践中,很多原因可能导致E2的“假性超标”,包括常用药物CDK4/6抑制剂阿贝西利、氟维司群、依西美坦、他莫昔芬等。以阿贝西利为例,在OFS联合内分泌治疗的基础上,CDK4/6抑制剂可进一步降低激素受体阳性早期乳腺癌患者的复发风险。然而自阿贝西利在国内开展研究及上市以来,我发现了数十例E2超预期升高的案例,这些病例在经过质谱法复核后,E2恢复到了绝经后范围,提示这部分患者可能为E2的假性超标。2023年Kessler等人[12]报告了使用 Abbott Alinity 化学发光微粒免疫测定 (CMIA) 测得阿贝西利治疗的手术去势乳腺癌患者E2水平升高,但使用液相色谱-质谱 (LC-MS/MS) 测得的E2水平较低。该研究随后纳入22例接受OFS联合阿贝西利治疗的绝经前早期乳腺癌患者,比较CMIA与LC-MS/MS的E2测量差异以及随后的治疗方案变化。结果显示,高达91%的患者的E2水平使用CMIA测定出现假阳性,错误地提示卵巢功能抑制不足。这也再次作证了多种检测方法复核的重要性。
表2. 临床检测E2可用的部分分析方法

而导致“真性超标”的可能原因包括E2水平的周期性波动,或由于用药导致的E2水平一过性增高等[13-16],不过,这类一过性增高可能并不会对患者的生存造成影响。近期发表的一项国内真实世界研究回顾性分析了1个月或3个月剂型GnRHa联合雌激素受体调节剂(SERM)类药物或芳香化酶抑制剂(AI)类药物治疗早期绝经前HR+乳腺癌患者的有效性和安全性[17],研究结果显示,无论患者的年龄组别或选择联合SERM或AI,使用3月剂型GnRHa的OFS功能均非劣效于1月剂型,3月剂型GnRHa的使用很好地抑制了患者的E2水平,24个月内E2的抑制率>90%。在随访期间,该研究的950名患者中有60名(6.3%)至少经历过一次不完全的卵巢功能抑制(iOFS,E2 > 30 pg/mL),且完全OFS患者和不完全OFS患者的无病生存期和总生存期没有显著差异。这一结果提示,偶尔发生的卵巢去势逃逸,即雌激素水平超标可能并不会影响患者的预后。
因此,需要谨慎看待单次E2检测结果,通过不同检测手段复核以排除假性超标,也需要避免OFS首次给药产生的E2一过性增高对治疗决策产生误导。此外一些患者个体因素(如体重指数高)、用药因素也可能导致E2升高,但目前尚无数据显示由这些因素导致的E2升高可能对患者的预后产生负面影响。
笔者观点:需谨慎解释E2单次检测的结果,以避免对治疗决策产生误导。
问题2:在OFS药物使用中,应如何判断患者已经进入生理性绝经状态?
张剑教授:判断生理性绝经的“动力”是对已经达到生理性绝经的患者,避免不必要的OFS治疗。绝经前乳腺癌患者使用化疗可能导致卵巢功能损伤甚至衰竭,导致月经周期不规律、闭经,然而这种闭经是暂时的,并不意味着患者此后都不再需要OFS治疗。ASTRRA研究中年龄<45岁的患者中,81.4%在化疗结束后1年内恢复了卵巢功能,95.1%的患者在化疗结束2年后恢复了卵巢功能[18]。此外,对于围绝经期的患者,在接受OFS治疗中也难以评估是否达到生理性绝经。
因此,国内外权威指南并不推荐轻率地停止OFS治疗,或等待患者卵巢功能明确后再启动OFS治疗,以防止延误了OFS应用时机,导致疾病的进展。《共识》中推荐:GnRHa的用药需要根据HR+乳腺癌患者化疗前的卵巢功能进行决策,不推荐化疗前未绝经的中高危患者在化疗后长期等待确认卵巢功能后再使用OFS。
结合临床指南与实践经验,推荐将中国女性进入围绝经期的平均年龄(46岁)作为阈值。对于开始OFS药物治疗时<45岁的患者,不推荐在OFS治疗中判断生理性绝经。而对于年龄>45岁且正在使用OFS药物,具有治疗方案调整需求的患者,可以考虑评估患者是否已经进入生理绝经状态。
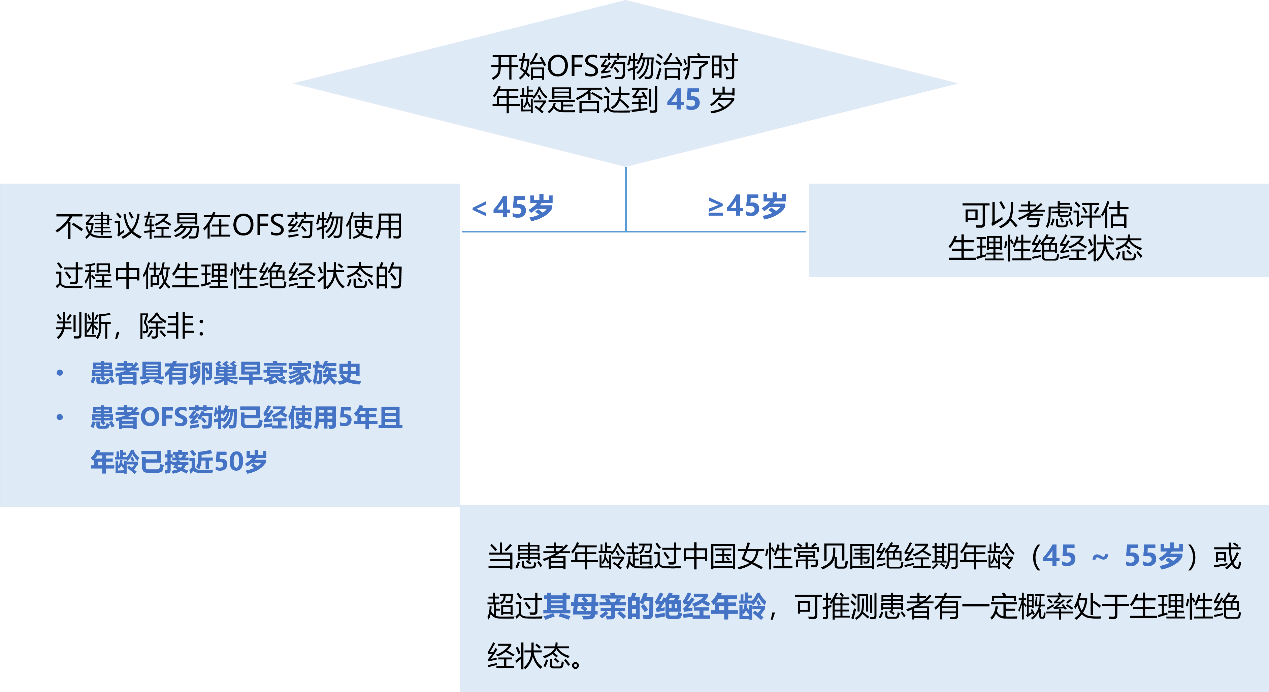
图1. 患者生理性绝经评估路径
当然,除了年龄之外,还有多种因素可能影响生理性绝经的评估,例如患者具有卵巢早衰家族史;或尽管开始OFS治疗时仍<45岁,但使用OFS已经达到5年或以上并接近50岁;或患者已经超过母亲的绝经年龄,也同样提示患者有更高的已达到生理性绝经的可能。
此外,OFS药物治疗的停止并不仅仅考虑患者的生理学绝经状态,如果患者在治疗中出现了难以耐受的不良反应或难以负担治疗费用,也可以考虑在对患者进行全面评估,与患者充分沟通后停用OFS(仍可继续单独使用SERM类药物),并对患者保持定期监测。当然,也可以选择耐受性好的GnRHa,以帮助患者可以更长时间的接受OFS治疗。3月剂型亮丙瑞林在其10年长期生存随访数据中[19.20],显示了为患者带来的有效生存获益,10年OS率达到了96.9%,同时安全性良好,可保障患者的长期治疗依从性。总之,生理性绝经的评估需要考虑包括患者年龄在内的多种因素的影响,基于患者的个体化状态评估是否可以暂停OFS治疗。
笔者观点:对于开始OFS药物治疗时年龄小于45岁的女性,我们不建议轻易在OFS药物使用过程中做生理性绝经状态的判断,除非患者具有卵巢早衰家族史,或患者OFS药物已经使用5年且年龄已接近50岁。
中国女性开始进入围绝经期的平均年龄为46岁,约90%的女性在45 ~ 55岁之间绝经,当患者年龄超过该范围或超过其母亲的绝经年龄,可推测患者有一定概率处于生理性绝经状态。
围绝经期患者的绝经判断需考量合适的时机和患者的个体需求。对于>45岁且正在使用OFS药物的患者,完成2 ~ 3年甚至5年的内分泌治疗且有调整方案需求时,是判断患者是否已进入生理绝经状态较为理想的时机。同时,也需要充分考虑患者需求,如患者在接受OFS药物治疗时出现了难以耐受的不良反应(如注射部位皮肤疼痛或出血)或经济负担较大。
[1] 中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)
[2] 乳腺癌绝经状态判断的2个相关问题——我的临床思考
[3] NCCN Guidelines®Breast Cancer 2024 V2.
[4] Bellet M, Gray K P, Francis P A, et al. Twelve-Month Estrogen Levels in Premenopausal Women With Hormone Receptor-Positive Breast Cancer Receiving Adjuvant Triptorelin Plus Exemestane or Tamoxifen in the Suppression of Ovarian Function Trial (SOFT): The SOFT-EST Substudy[J]. J Clin Oncol, 2016, 34(14): 1584-93.
[5] Smith I E, Dowsett M, Yap Y S, et al. Adjuvant aromatase inhibitors for early breast cancer after chemotherapy-induced amenorrhoea: caution and suggested guidelines[J]. J Clin Oncol, 2006, 24(16): 2444-7.
[6] Im S A, Lu Y S, Bardia A, et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer[J]. N Engl J Med, 2019, 381(4): 307-316.
[7] Faqehi A M M, Cobice D F, Naredo G, et al. Derivatization of estrogens enhances specificity and sensitivity of analysis of human plasma and serum by liquid chromatography tandem mass spectrometry[J]. Talanta, 2016, 151: 148-156.
[8] Schmid P, Untch M, Kossé V, et al. Leuprorelin acetate every-3-months depot versus cyclophosphamide, methotrexate, and fluorouracil as adjuvant treatment in premenopausal patients with node-positive breast cancer: the TABLE study[J]. J Clin Oncol, 2007, 25(18): 2509-15.
[9] Masuda N, Iwata H, Rai Y, et al. Monthly versus 3-monthly goserelin acetate treatment in pre-menopausal patients with estrogen receptor-positive early breast cancer[J]. Breast Cancer Res Treat, 2011, 126(2): 443-51.
[10] 陈祎霏, 严颖, 姜晗昉, et al. 促性腺激素释放激素激动剂对绝经前激素受体阳性乳腺癌患者去势效果分析——真实世界研究[J]. 军事医学, 2021, 45(05): 373-379.
[11] 孙冰, 孟祥颖, 宋三泰, et al. 乳腺癌患者血清雌二醇、卵泡刺激素及黄体生成素检测结果分析:西门子吖啶酯化学发光法检测报告[J]. 中华乳腺病杂志(电子版), 2012, 6(03): 244-252.
[12] Mattick L J, Bea J W, Singh L, et al. Serum Follicle-Stimulating Hormone and 5-Year Change in Adiposity in Healthy Postmenopausal Women[J]. J Clin Endocrinol Metab, 2022, 107(8): e3455-e3462.
[13] Blumenfeld Z. How to preserve fertility in young women exposed to chemotherapy? The role of GnRH agonist cotreatment in addition to cryopreservation of embrya, oocytes, or ovaries. Oncologist. 2007 Sep;12(9):1044-54.
[14] Mccann K E, Goldfarb S B, Traina T A, et al. Selection of appropriate biomarkers to monitor effectiveness of ovarian function suppression in pre-menopausal patients with ER+ breast cancer[J]. NPJ Breast Cancer, 2024, 10(1): 8
[15] Kim M K, Shin H-C. Risk Factors for Tamoxifen-Induced Ovarian Hyperstimulation in Breast Cancer Patients[J]. Clinical Breast Cancer, 2020, 20(5): 408-412.
[16] 中国临床肿瘤学会乳腺癌专家委员会 中, 中华医学会外科学分会乳腺外科学组. 中国年轻乳腺癌诊疗专家共识(2022)[J]. 中华医学杂志, 2023, 103(06): 387-403.
[17] Lin J, Ouyang Y, Li Y. Different dosage forms of GnRHa with endocrine therapy in premenopausal hormone Receptor-Positive breast cancer. J Natl Cancer Inst. 2024 Jun 4:djae115.
[18] NOH W C, LEE J W, NAM S J, et al. Role of adding ovarian function suppression to tamoxifen in young women with hormone-sensitive breast cancer who remain premenopausal or resume menstruation after chemotherapy: the ASTRRA study[J]. J Clin Oncol, 2018, 36(15_suppl): 502.
[19] Kurebayashi, J., et al., A follow-up study of a randomized controlled study evaluating safety and efficacy of leuprorelin acetate every-3-month depot for 2 versus 3 or more years with tamoxifen for 5 years as adjuvant treatment in premenopausal patients with endocrine-responsive breast cancer. Breast Cancer, 2021. 28(3): p. 684-697.
[20] Ma L, Yang B, Wu J. Revisiting ovarian function suppression with GnRH agonists for premenopausal women with breast cancer: Who should use and the impact on survival outcomes[J]. Cancer Treatment Reviews, 2024, 129: 102770.
[21] 范蕾, Y.Y.-C., 杜 芬, 中国绝经前激素受体阳性乳腺癌辅助内分泌治疗最小成本分析. 中国药物经济学, 2020. 15(4): p. 5-10.
审批编号:VV-MEDMAT-118835
审批日期:2025 年 3 月
仅供医疗卫生专业人士为了解资讯使用。

排版编辑:肿瘤资讯-momo











 苏公网安备32059002004080号
苏公网安备32059002004080号


