在众多淋巴瘤亚型中,ALK阳性大B细胞淋巴瘤(ALK+ LBCL)是一个十分凶险的变种,多发于青壮年男性,预后极差,中位生存期仅1.8年。随着分子生物学技术的进步,人们发现ALK基因重排可能是导致ALK+ LBCL发生的关键。ALK重排可形成多种融合基因,其中最常见的是CLTC::ALK。去年5月份,Frontiers in Oncology首次报道了携带TFG::ALK融合基因的ALK+ LBCL病例,为揭开ALK+ LBCL的神秘面纱提供了新的线索。

病例介绍: 青年男性,以鼻腔肿物起病
病例是一名23岁男性。7个月前无明显诱因出现鼻塞,近期伴有全身症状如乏力、盗汗、腹痛、恶心等。查体可见右侧颈部淋巴结肿大。PET-CT显示,左侧鼻咽部有一2.3cm肿块,双侧颈部及咽后淋巴结肿大。脑部MRI未见异常,鼻内镜下可见鼻咽部一易出血肿物。
活检镜下可见大片大细胞浸润。这些肿瘤细胞核圆或卵圆,染色质疏松,核仁明显,胞质中等量,嗜酸性。可见凋亡及坏死。免疫组化示,肿瘤细胞呈ALK(+)、Oct2(+)、c-MYC(+)、BOB1(+)、CD45RB(+)、CD79a(弱+)、CD10(弱+)、Bcl-6(部分+)、CD138(+)、MUM-1(+)、IgG(+)、TP53(30-40%+)。κ、λ轻链原位杂交提示κ限制性表达。Ki-67约70-80%。多个上皮、黑色素、神经内分泌、间叶、胚细胞标志物阴性。EBER原位杂交阴性。诊断考虑ALK阳性大B细胞淋巴瘤,分期骨髓活检未见受累。
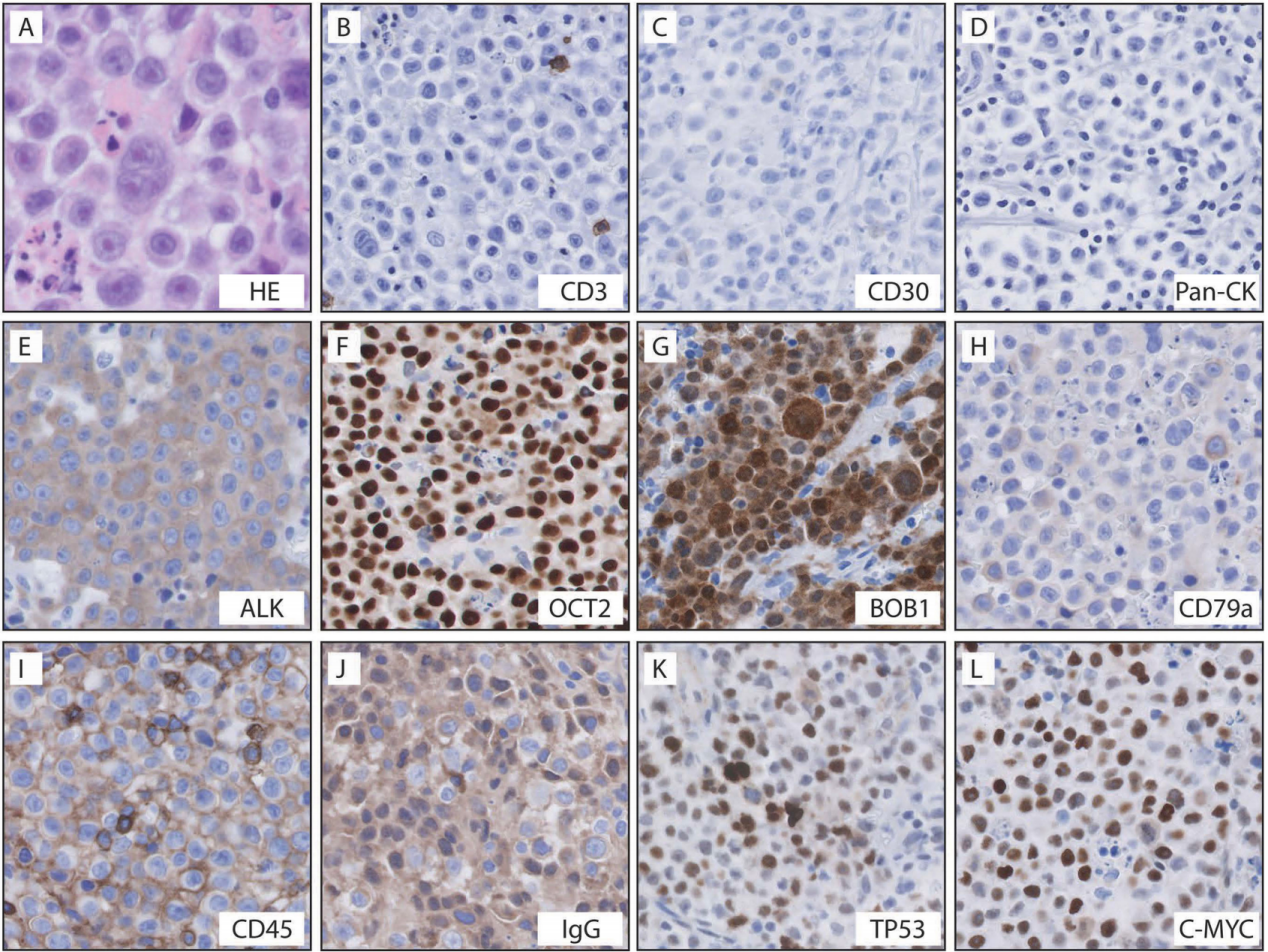
图1:镜下活检(A)和免疫组化(B-L)
为进一步了解患者的遗传学特征,送检组织进行了530个基因的靶向二代测序。结果在FOXO1、MYB、PRKCA等位点检出深度拷贝数缺失。最令人惊讶的是,发现了一个TFG第1-4号外显子与ALK第20-29号外显子相融合的新基因重排,即TFG::ALK。测序未发现其他典型的淋巴瘤相关基因突变。这提示TFG::ALK融合可能是本例ALK+ LBCL的关键驱动事件。
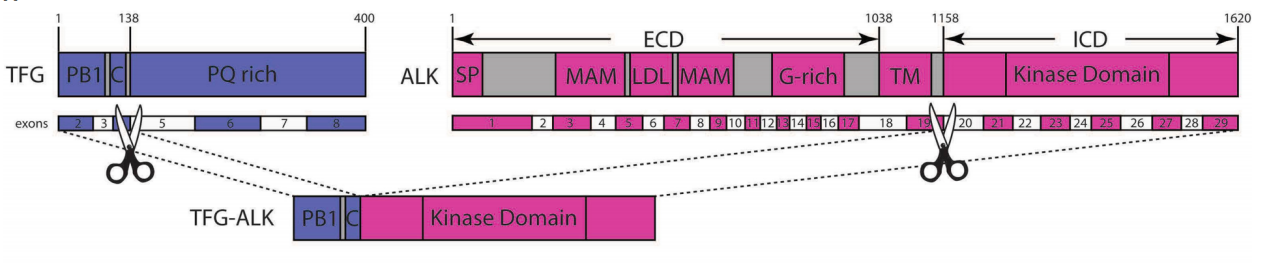
图2:靶向二代测序发现了TFG::ALK融合基因
诊疗经过: 新辅助化疗,ALK抑制剂尝试
一经确诊,患者立即接受了标准的EPOCH(依托泊苷、泼尼松、长春新碱、环磷酰胺、表柔比星)方案化疗,同时辅以PD-1抗体帕博利珠单抗免疫治疗。然而,6个月后患者PET-CT复查,病灶缩小不明显,提示对化疗反应欠佳。医疗团队面临艰难抉择,能否找到一种新的治疗手段来控制患者的病情呢?
文献复习发现,TFG::ALK这一特殊融合基因其实并非首次发现。在既往报道的各类TFG::ALK融合阳性肿瘤中,ALK抑制剂都显示出良好疗效。那么,ALK抑制剂能否用于TFG::ALK融合的ALK+ LBCL患者呢?
理论上,ALK融合基因可导致ALK激酶持续活化,发挥致癌作用。而ALK抑制剂正是通过抑制ALK激酶活性而发挥抗肿瘤作用的。因此,研究者推测,携带TFG::ALK融合的ALK+ LBCL患者很可能从ALK抑制剂治疗中获益。
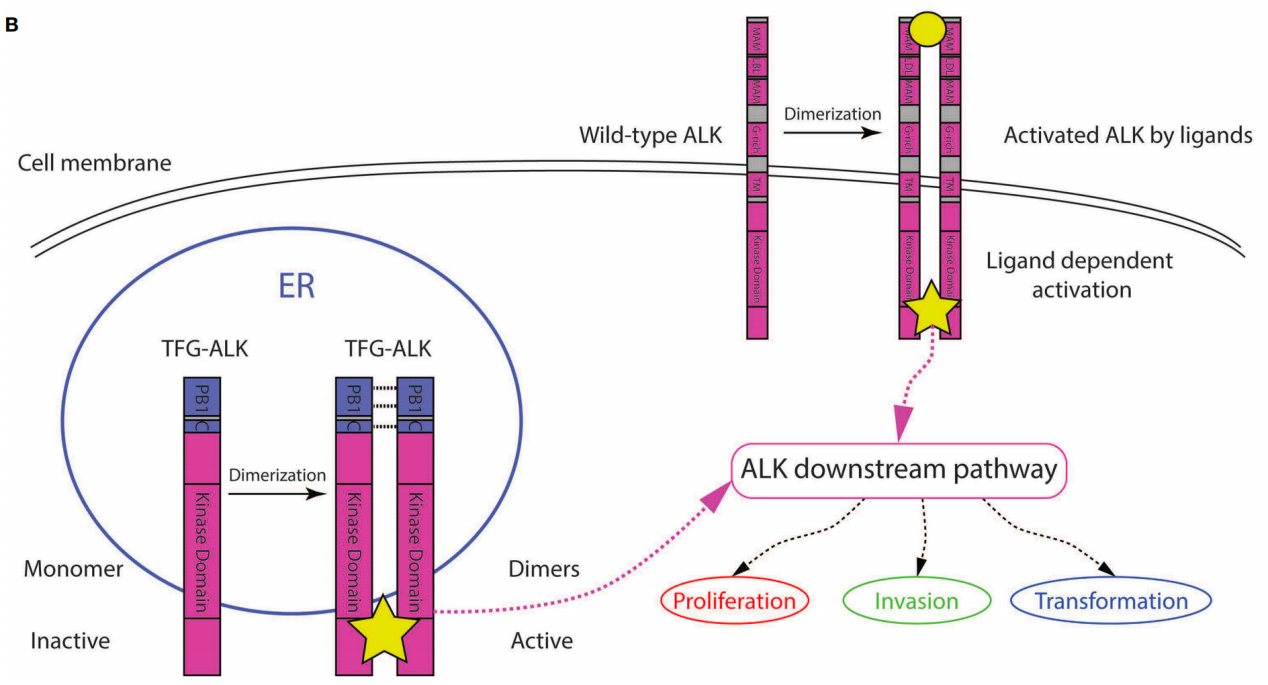
图3:TFG::ALK融合基因使得ALK通路的下游上调,ALK抑制剂或许有用
事实上,目前临床上ALK抑制剂应用于ALK+ LBCL已有尝试。其中研究最多的药物是克唑替尼,据报道其可使患者淋巴结暂时缩小、LDH水平下降,但随后往往出现快速进展。Soumerai等研究者在ALK+ LBCL小鼠模型中评估了新一代ALK抑制剂阿雷替尼和劳拉替尼的疗效,发现其可通过上调旁路信号通路而克服克唑替尼耐药。这为ALK+ LBCL的二线治疗提供了新的选择。
受此启发,本例患者的主治医生决定为其开具克唑替尼,以期通过靶向ALK通路而控制病情。可惜的是,随访显示患者对克唑替尼反应欠佳,疗效有限。是否应换用更高效的新一代ALK抑制剂?能否联合其他靶向药物?如何权衡获益和风险?所有这些问题都有待在未来的临床实践中进一步探索。
寻根溯源:TFG::ALK融合意义几何?
本文报道了一例罕见的携带TFG::ALK融合的ALK+ LBCL,这是该融合在ALK+ LBCL中的首次报道。通过对该病例的深入分析,可以获得一些有价值的启示。
首先,该病例再次提示我们,ALK融合基因在ALK+ LBCL发病中起关键驱动作用。研究显示,ALK融合可导致ALK激酶结构域持续活化,进而影响下游多条致癌通路。而靶向NGS检测显示,除TFG::ALK融合外,该病例基因组的其他区域很“安静”,提示其很可能是导致该淋巴瘤发生的关键分子事件。这启示我们,在ALK+ LBCL的诊断中,检测ALK融合基因的存在至关重要。
其次,本病例揭示了ALK+ LBCL发生的新机制。目前,ALK+ LBCL中最常见的融合基因是CLTC::ALK,但其发病机制尚不清楚。而此前从未在ALK+ LBCL中报道过的TFG::ALK融合,其意义更加扑朔迷离。文献显示,TFG蛋白通过其N端的结构域形成多聚体,参与内质网与高尔基体间的蛋白运输。推测TFG与ALK融合后,这些结构域可能介导ALK融合蛋白的寡聚化,从而激活ALK激酶。这一机制已在NIH3T3等细胞系的体外实验中得到证实。因此,阐明TFG::ALK融合的结构和功能,有助于从新的角度理解ALK+ LBCL的发病机制。
再次,TFG::ALK融合在多种肿瘤中的存在,提示其可能参与一种特殊的致瘤机制。目前,已有报道发现该融合基因存在于間变性大细胞淋巴瘤(ALCL)、炎性肌纤维母细胞瘤(IMT)、浆细胞瘤、肺腺癌等多种肿瘤中。令人费解的是,这些起源各异的细胞在获得同一融合基因后,却向着不同的方向分化。这启示我们,TFG::ALK融合可能是发生在肿瘤早期的“瓶颈”事件,而肿瘤的最终表型则取决于其他基因组改变和微环境因素。这一假说尚有待更多的基础和临床研究来验证。
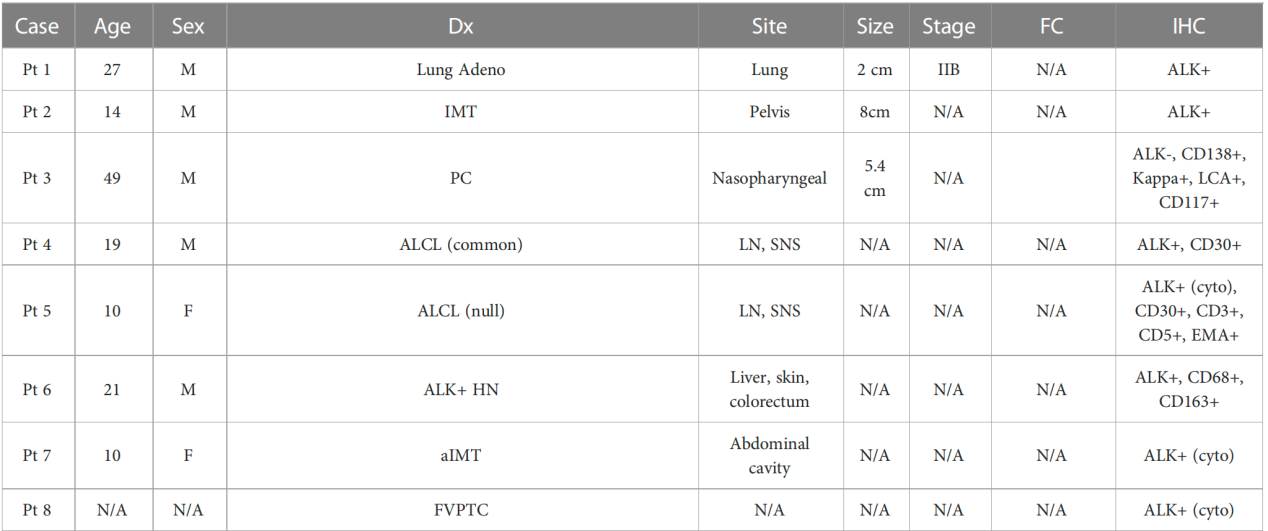
图4:既往报道的TFG::ALK融合在多种肿瘤中的存在
最后,本例表明ALK抑制剂在ALK+ LBCL中的疗效有限。既往研究显示,携带ALK融合的肿瘤细胞,普遍对ALK抑制剂高度敏感。然而,本例患者的临床经验却挑战了这一认知:标准化疗疗效欠佳,后续克唑替尼治疗收效甚微。这提示,ALK抑制剂在ALK+ LBCL中的疗效不容乐观,可能受到肿瘤异质性、旁路激活等因素的影响。如何优选和联用ALK抑制剂,评估和克服耐药,将是今后ALK+ LBCL治疗所面临的重大挑战。
小结:砥砺前行,破译ALK+ LBCL之谜
该病例首次在ALK+ LBCL中发现了TFG::ALK融合基因。尽管融合基因频繁出现于ALK+ LBCL,但TFG却是一个从未被发现的新成员。这一发现不仅扩展了我们对ALK+ LBCL分子生物学认识,也启发我们从蛋白转运、多聚化等新视角审视其发病机制。
有意思的是,伴TFG::ALK融合的肿瘤谱系涵盖了上皮、间叶、血液等多个来源。这一方面反映了ALK信号通路失调的普遍致瘤性,另一方面也暗示了宿主背景和其他分子事件在肿瘤演进中的重要作用。深入比较这些肿瘤的共性与特性,将有助于我们理解肿瘤异质性的根源。
遗憾的是,本病例ALK抑制剂治疗的疗效不尽如人意。这启示我们关注ALK+ LBCL对ALK抑制剂的原发性和继发性耐药问题。未来应着力于开发更强效、更专一的ALK抑制剂,优化给药方案,发掘耐药机制和逆转策略。
一位27岁男性,左膝关节持续疼痛1年余,3个月前车祸后加重,查体见左膝关节压痛、肿胀明显,左膝关节X线未见明显异常,MRI提示左股骨远端骨干至骺端区域浸润性肿块累及周围软组织,骨活检病理诊断为弥漫大B细胞淋巴瘤。该患者最可能的诊断是:
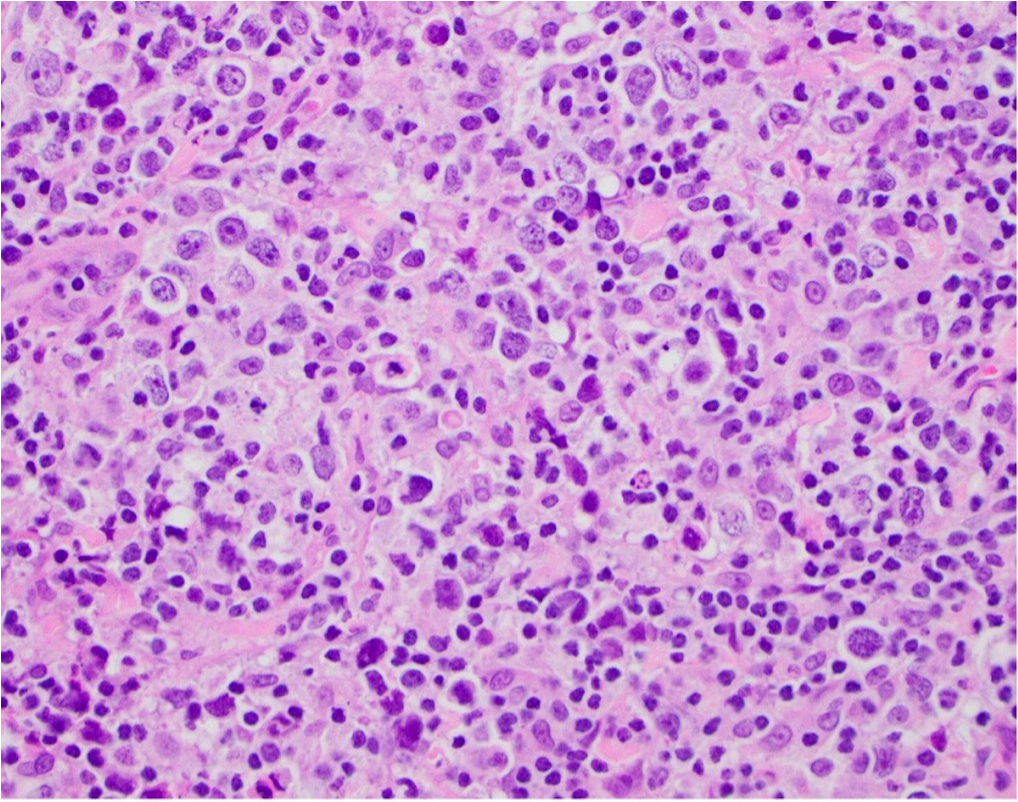
图:病理活检发现大量不典型的淋巴细胞弥漫性浸润
最可能的诊断是:
A.软组织肉瘤继发骨转移
B.骨肉瘤
C.骨的恶性纤维组织细胞瘤
D.原发性骨淋巴瘤
上一期《寻根溯源丨跨越15年的抗癌历程:当乳腺癌遇上白血病和肾癌》的答案为C
Xiao A, Shahmarvand N, Nagy A, et al. TFG::ALK fusion in ALK positive large B-cell lymphoma: a case report and review of literature. Front Oncol. 2023;13:1174606. Published 2023 May 25. doi:10.3389/fonc.2023.1174606
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


