整理:肿瘤资讯
来源:肿瘤资讯
以下内容仅供中国大陆地区执业的医学药学专业人士阅读参考,如您非前述专业人士,请离开本页面
病例整理: 河北医科大学第四医院 贾 楠 教授
河北医科大学第四医院 郭洪海 教授
病例点评:河北医科大学第四医院 李 勇 教授
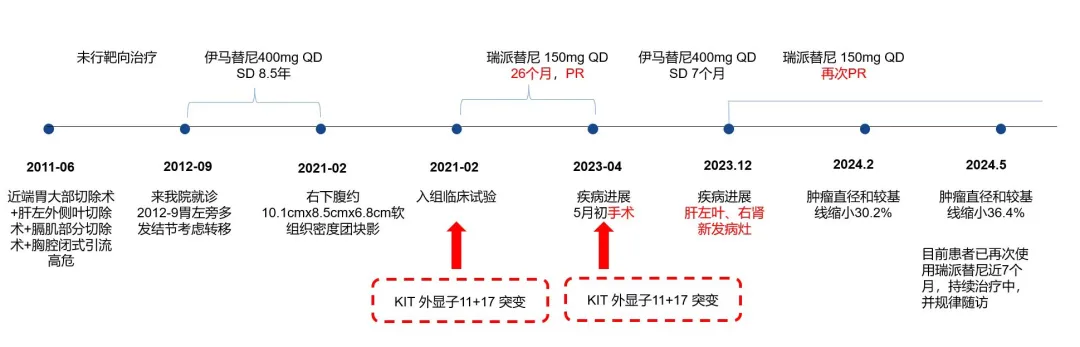
晚期GIST患者在靶向治疗后,特定情况下可行手术切除,特别是能完整切除的情况下,可能为患者带来生存获益。完整切除达到无疾病状态(NED),后续靶向药物如何选择,也是临床讨论的热点。本文介绍一例胃GIST患者,既往术后复发使用伊马替尼治疗8.5年后进展,基因检测示KIT外显子11+17突变。瑞派替尼二线治疗取得PR,治疗26个月后肿瘤增大,实施了手术完整切除,达NED,术后组织检测显示基因型仍为KIT外显子11+17突变,术后使用伊马替尼治疗,疗效有限,肿瘤快速进展,后结合基因型选择再次使用瑞派替尼,治疗2个月后,肿瘤长径和较基线缩小30.2%,疗效PR,目前已再次使用瑞派替尼治疗近7个月。对于复发转移性GIST,结合患者当前基因型进行精准个体化治疗,可能为患者带来更大获益,本病例也为胃肠间质瘤临床治疗带来思考和借鉴。



病例点评
李勇教授
治疗小结
病例简介
基本情况
男,51岁,2011年6月21日因乏力伴黑便半月余在外院住院治疗;贫血外貌,实验室检查发现血红蛋白(HGB)62g/L,未见其他明显异常。CT 检查显示左上腹肿物。
治疗经过
手术治疗,术后病理确诊为胃间质瘤
2011年6月28日,外院行近端胃大部切除术+肝左外侧叶切除术+膈肌部分切除术+胸腔闭式引流。术中探查情况:胃底巨大肿物,侵及肝左外侧叶及左侧膈肌。
术后病理:胃间质瘤,大小12cm×12 cm×9cm,梭形细胞密集排列,核分裂多见(104个/50HPF),侵犯肝外侧叶;危险度分级为高危。未进行基因检测;术后曾用增强免疫制剂治疗,未行靶向药物治疗。
术后复发,接受一线伊马替尼治疗
2012年9月(术后15个月)到我院间质瘤门诊就诊,复查CT显示残胃左旁多发结节,考虑间质瘤种植转移,开始伊马替尼400mg QD治疗;治疗期间未行相关基因检测;
2017年9月(治疗5年)复查CT显示残胃左旁原转移病灶已消失,其他部位未发现新病灶,疗效CR,继续伊马替尼400mg QD治疗;
2019年5月7日CT未显示病灶,继续伊马替尼400mg QD 治疗;2019年8月转回当地仍按原方案治疗。
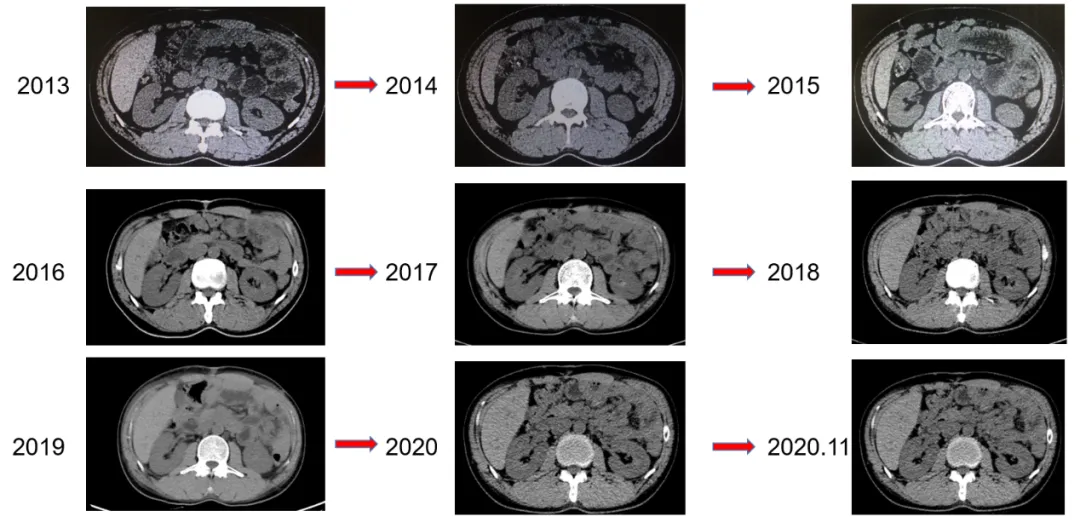
一线伊马替尼治疗期间的CT
因在当地查CT异常,2021年2月25日(伊马替尼治疗8.5年)到我院间质瘤门诊, CT、MRI(2021.2.25)显示:胃间质瘤术后改变,右下腹肿物,考虑转移,肿瘤大小10.1cm×8.5cm。
穿刺活检病理报告:胃肠间质瘤。免疫组化:CD34(+)、CD117(+)、DOG-1(+)、Des(-)、Act(-)、S100(-)、Vim(+)、 Ki67(阳性细胞数15%)、SDHB(+)。基因检测:KIT 11外显子c.1652_1663del12(p.P551_V555>L)突变; 17外显子c.2446G>C(D816H)突变。

CT、MRI(2021.2.25)
二线瑞派替尼治疗
2021年2月28日,患者开始口服瑞派替尼150mg QD治疗。
2021年5月12日,瑞派替尼治疗2个多月,肿物长径从10.1cm 缩小至6.7cm,约缩小34%,疗效PR。患者无明显药物相关不良反应,耐受性好。之后肿瘤持续缩小成囊性。
2023年1月31日,瑞派替尼治疗23个月,肿瘤长径为3.2cm,较基线缩小68.3%。
2023年4月27日,瑞派替尼治疗26个月后,肿物变大,肿瘤长径为4.6cm。
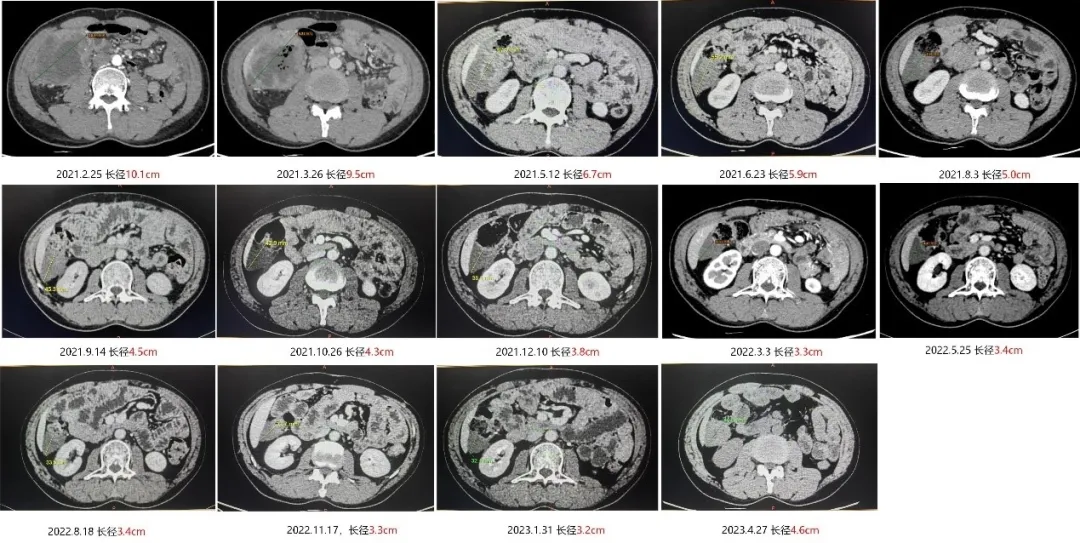
二线瑞派替尼治疗前后的CT变化
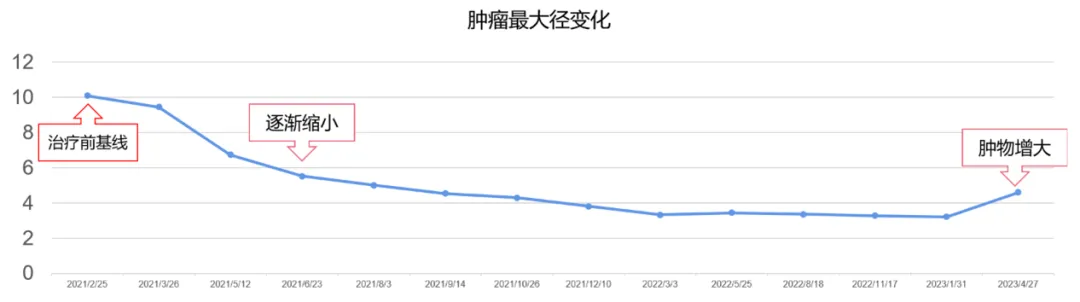
瑞派替尼治疗前后肿瘤长径的变化
第二次手术治疗
考虑到患者疾病局限性进展,手术切除可能为患者带来进一步获益,结合患者意愿,术前停药一周。2023年5月8日,行右半结肠切除+黏连松解术,术中探查:肿瘤位于升结肠中部,距回盲部约3cm,约6.5*6*6cm大小。
术后病理:胃肠间质瘤(核分裂象32个/5mm 2)。CD117(+)、CD34(+)、DOG-1(+)、 S100(-)、DES(弱+)、Ki67(阳性细胞数40%)、SDHB(散在+)。基因检测:KIT 11外显子c.1652_1663del12(p.P551_V555>L)突变; 17外显子c.2446G>C(D816H)突变。
术后伊马替尼治疗
考虑到完整切除,患者当前为无疾病状态(NED),术后治疗的可能方案为瑞派替尼、舒尼替尼、伊马替尼等。经与患者充分沟通,结合患者经济原因和患者意愿,术后选择伊马替尼400mg QD治疗。
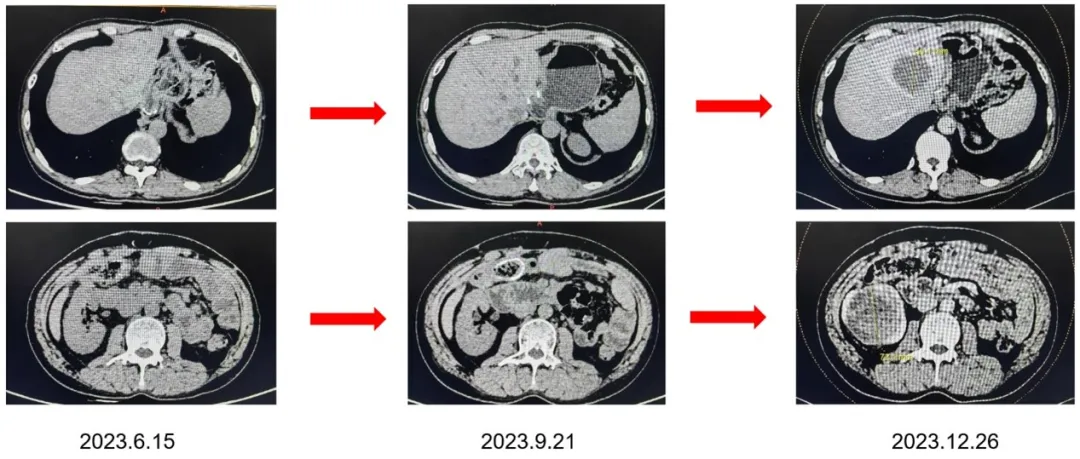
2023年6月15日及2023年9月21日全腹CT均显示胃肠间质瘤术后改变、结肠术后改变;
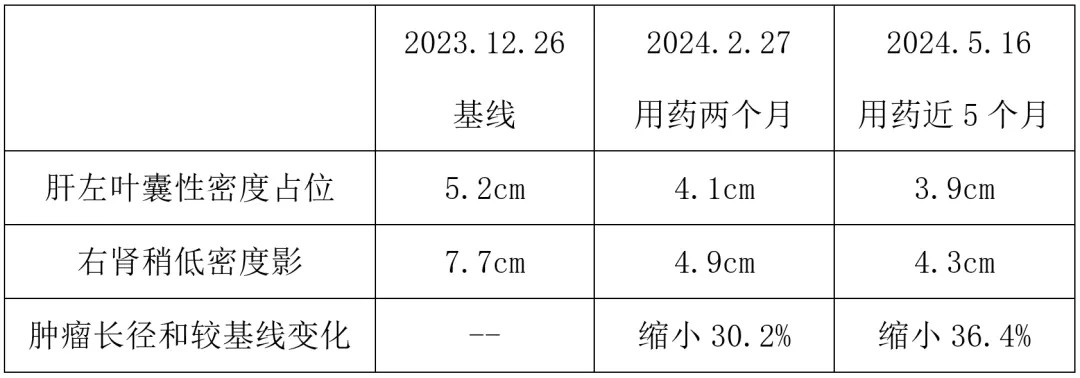
2023年12月26日 全腹CT显示,肝左叶稍低密度影占位伴远端胆管扩增,较2023年9月21日为新发,考虑转移,长径约5.2cm,平扫CT值约42HU;右肾稍低密度影,较2023年9月21日为新发,考虑转移,长径约7.7cm,平扫CT值约28HU。
再次使用瑞派替尼治疗
考虑到患者术后组织检测结果仍为KIT 外显子11缺失+KIT外显子17 D816H突变,舒尼替尼很可能无法获益。瑞戈非尼和瑞派替尼相比,后者ORR和安全性更优,且既往患者使用瑞派替尼疗效及安全性均较理想,综上并结合患者意愿,2023年1月1日再次使用瑞派替尼 150mg QD治疗;
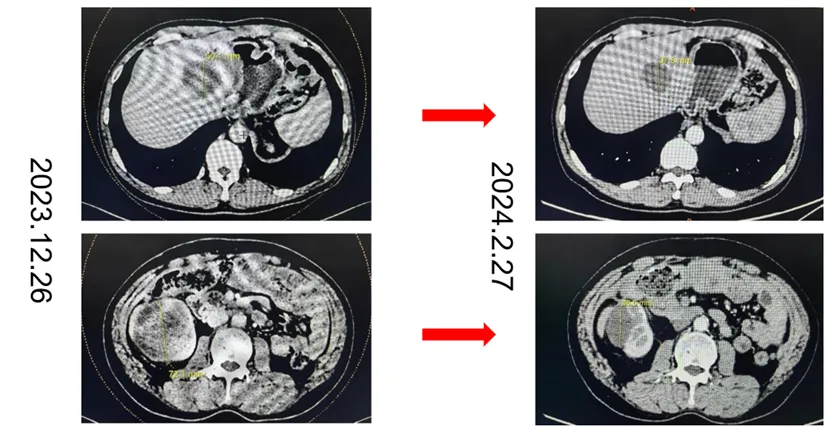
2024年2月27日 CT示转移灶明显缩小,肝左叶囊性密度占位,长径约4.1cm,平扫CT值约24HU(长径减少约21%,CT值减少约43%);右肾稍低密度影,长径约4.9cm,平扫CT值约25HU (长径减少约36%,CT值减少约11%) 。肿瘤长径和缩小30.2%,疗效PR。
2024年5月16日 CT示肝左叶囊性密度占位,长径约3.9cm,右肾稍低密度影,长径约4.3cm,较基线肿瘤长径和缩小36.4%,目前继续药物治疗中。
患者再次使用瑞派替尼后肿瘤长径变化
专家点评
李勇教授:
国内外指南均推荐对晚期GIST患者在特定情况下可行手术切除,特别是能完整切除的情况下,可能为患者带来生存获益。既往在伊马替尼、舒尼替尼治疗有反应或局限性进展的患者中,手术切除为患者带来了生存获益1-4。瑞派替尼是新型的开关控制抑制剂,可广泛抑制KIT/PDGFRA各种原发和继发突变类型,ORR高且安全性较好,可能为晚期GIST患者创造手术机会5-7。目前有报道晚期GIST瑞派替尼联合手术有明显获益,R0/R1切除率达85%,且无显著并发症发生8。本例患者经瑞派替尼治疗两个月后,疗效PR,且肿瘤长径持续缩小至较基线缩小68.3%。因患者入组临床试验,希望可以获得最长的试验药物治疗时间,至用药26个月后,肿瘤较前有增大,综合评估后,进行手术并完整切除,达到无疾病状态(NED)。
复发转移性GIST患者靶向治疗后再次手术,术后NED时,后续靶向药物如何选择,也是临床讨论的热点。既往有观点认为,即使是复发转移性GIST靶向治疗后再次手术,只要是完整切除,后续治疗仍属于术后辅助治疗范畴,伊马替尼仍是术后辅助治疗的最佳选择。也有观点认为,即使是完整切除,但患者已属于晚期GIST的治疗,更应该及时换药或者精准治疗。从本病例情况可以看出,患者手术时已是二线治疗局限性进展,虽然晚期GIST经过靶向药物的治疗后也会呈现较大的时空异质性,但患者手术样本的基因检测结果显示,仍为KIT 11+17突变,判断此突变仍是当前肿瘤的优势基因型,而伊马替尼对于此基因型是耐药的,舒尼替尼也不敏感,若换用瑞戈非尼,疗效未知,结合既往瑞派替尼的治疗疗效和安全性均较理想,可能NED后,瑞派替尼治疗是较优选择。不过,最终结合患者经济原因和患者意愿,术后选择重新使用伊马替尼400mg QD治疗。从患者的治疗情况可以看到,在3个月的无瘤状态后,肿瘤迅速生长,可能伊马替尼治疗的疗效有限。最终结合患者基因型选择再次使用瑞派替尼,治疗2个月后,肿瘤长径和较基线缩小30.2%,疗效PR,目前已再次使用瑞派替尼近7个月,肿瘤持续PR中。因此,对于复发转移性GIST,结合患者当前基因型进行精准个体化治疗,可能为患者带来更大的获益,本病例也为胃肠间质瘤治疗带来思考和借鉴。
参考文献:
1. Fairweather M, Balachandran VP, Li GZ et al. Cytoreductive Surgery for Metastatic Gastrointestinal Stromal Tumors Treated With Tyrosine Kinase Inhibitors: A 2-institutional Analysis. Ann Surg 2018; 268 (2): 296-302.
2. Cho H, Ryu MH, Lee Y et al. Role of Resection Following Focal Progression with Standard Doses of Imatinib in Patients with Advanced Gastrointestinal Stromal Tumors: Results of Propensity Score Analyses. Oncologist 2019; 24 (12): e1443-e1449.
3. Cai Z, Yin Y, Shen C et al. Role of surgical resection for patients with recurrent or metastatic gastrointestinal stromal tumors: A systematic review and meta-analysis. Int J Surg 2018; 56: 108-114.
4. Yeh CN, Wang SY, Tsai CY et al. Surgical management of patients with progressing metastatic gastrointestinal stromal tumors receiving sunitinib treatment: A prospective cohort study. Int J Surg 2017; 39: 30-36.
5. Smith BD, Kaufman MD, Lu WP et al. Ripretinib (DCC-2618) Is a Switch Control Kinase Inhibitor of a Broad Spectrum of Oncogenic and Drug-Resistant KIT and PDGFRA Variants. Cancer Cell 2019; 35 (5): 738-751.e739.
6. Bauer S, Jones RL, Blay JY et al. Ripretinib Versus Sunitinib in Patients With Advanced Gastrointestinal Stromal Tumor After Treatment With Imatinib (INTRIGUE): A Randomized, Open-Label, Phase III Trial. J Clin Oncol 2022; 40 (34): 3918-3928.
7. Li J, Zhang J, Zhang Y et al. Efficacy and safety of ripretinib vs sunitinib in patients with advanced gastrointestinal stromal tumor previously treated with imatinib: A phase 2 multicenter, randomized, open-label study in China. Journal of Clinical Oncology 2023; 41 (4_suppl): 803-803.
8. Guan Z, Yang S, Sun K et al. Cytoreductive surgery for metastatic gastrointestinal stromal tumors treated with ripretinib: A single-center experience. Clinical Surgical Oncology 2023.
责任编辑:肿瘤资讯-Marie
排版编辑:肿瘤资讯-CYX
版权声明
本文专供医学专业人士参考,未经著作人许可,不可出版发行。同时,欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。











 苏公网安备32059002004080号
苏公网安备32059002004080号


