2024年ASCO会议已经圆满落下帷幕,结直肠癌领域迎来众多研究进展,其中CodeBreak300研究首次公布了OS结果,今年上半年也有多项KRAS G12C抑制剂±抗EGFR单抗的研究全文登上国际顶刊,KRAS G12C突变转移性结直肠癌的治疗进展再次引发广泛关注。【爱肠学院】特邀厦门大学附属第一医院李佳艺教授对KRAS G12C抑制剂治疗结直肠癌相关研究进行梳理与解读。
专家介绍
CSCO免疫治疗专家委员会 委员
中国老年医学学会肿瘤学分会 委员
中国研究型医院学会肿瘤专业委员会 常务委员
中国女医师协会临床肿瘤专委会 委员
北京癌症防治中心食管癌专委会青委 副主委
中华医学会肠内肠外营养分会NUSOC协作组 委员
福建省抗癌协会康复专业委员会 委员
福建省抗癌协会肿瘤营养与支持治疗专业委员会 委员
福建省科普作家协会肿瘤科普专委会 委员
厦门市医师协会肿瘤医师分会 消化肿瘤MDT学组 组长
KRAS G12C突变型转移性结直肠癌概要
流行病学
在结直肠癌中超过50%的患者会出现KRAS突变[1,2],其中KRAS G12热点错义突变占全部KRAS突变超60%,包括G12D(40%)、G12V(35%)、G12C(11%)等[3]。而在结直肠癌中KRAS G12C突变占比约为4%,与非G12C 突变相比,这类患者预后相对较差,一线和二线KRAS G12C突变肿瘤患者的中位OS分别是16.1个月和9.7个月,而非G12C KRAS突变肿瘤患者的中位OS一线和二线分别是18.3个月和11.4个月[4,5]。之前由于在成药上的困难,一直没有对应的靶向药物可以选择,随着科学的进步,目前已经成功开发多种KRAS G12C抑制剂,并在多个临床研究中探索了该类药物的疗效和安全性。
检测方法
KRAS突变作为转移性结直肠癌患者必做的基因检测项目,目前检测技术相对成熟,不同的检测方法对检测样本的要求有所不同。KRAS G12C突变属于点突变,在KRAS G12C抑制剂用于肠癌的相关研究中大部分采用的是NGS或者是实验室经过验证的分子检测方法。2021版《结直肠癌分子标志物临床检测中国专家共识》[6]中提到RAS点突变可以采用的检测方法包括:Sanger测序法、PCR和NGS。AMRS-PCR具有简便快捷、高度特异性、检测周期段短的优点,适用于组织或细胞学样本,是目前应用最普遍的方法;对于AMRS-PCR检测到混管阳性时,可进行单管单位点ARMS或Sanger测序进一步明确KRAS G12C状态[7]。NGS具有高灵敏度和高特异性的优势,可以对组织或血液样本的多个基因同时进行测序及定量检测,覆盖更多已知和未知的变异,但存在检测成本高、复杂度高以及检测周期较长的问题。随着未来KRAS G12C抑制剂在国内的上市,相信还会有新的检测方法出现,不同的检测方法各有特点,KRAS G12C突变检测需要结合患者样本类型、经济条件以及对检测周期的要求等来选择合适的检测方法。
2024 ASCO CodeBreak300研究更新
CodeBreak300是全球首个证明KRAS G12C抑制剂联合抗EGFR单抗可使化疗难治性KRAS G12C突变mCRC患者PFS显著获益的III期临床研究(图1),研究的重磅结果发表在著名肿瘤期刊《New England Journal of Medicine》[8]上。

图1: ITT人群的PFS
该研究纳入的是既往未接受过KRAS G12C抑制剂治疗的KRAS G12C突变化疗难治性mCRC患者,以1:1:1随机分配到三组,分别是Sotorasib 960mg每日+帕尼单抗组、Sotorasib 240mg每日+帕尼单抗组、研究者选择组(曲氟尿苷/替匹嘧啶或瑞戈非尼),研究的主要终点是BICR确定的PFS,次要终点包括OS和ORR(图2)。
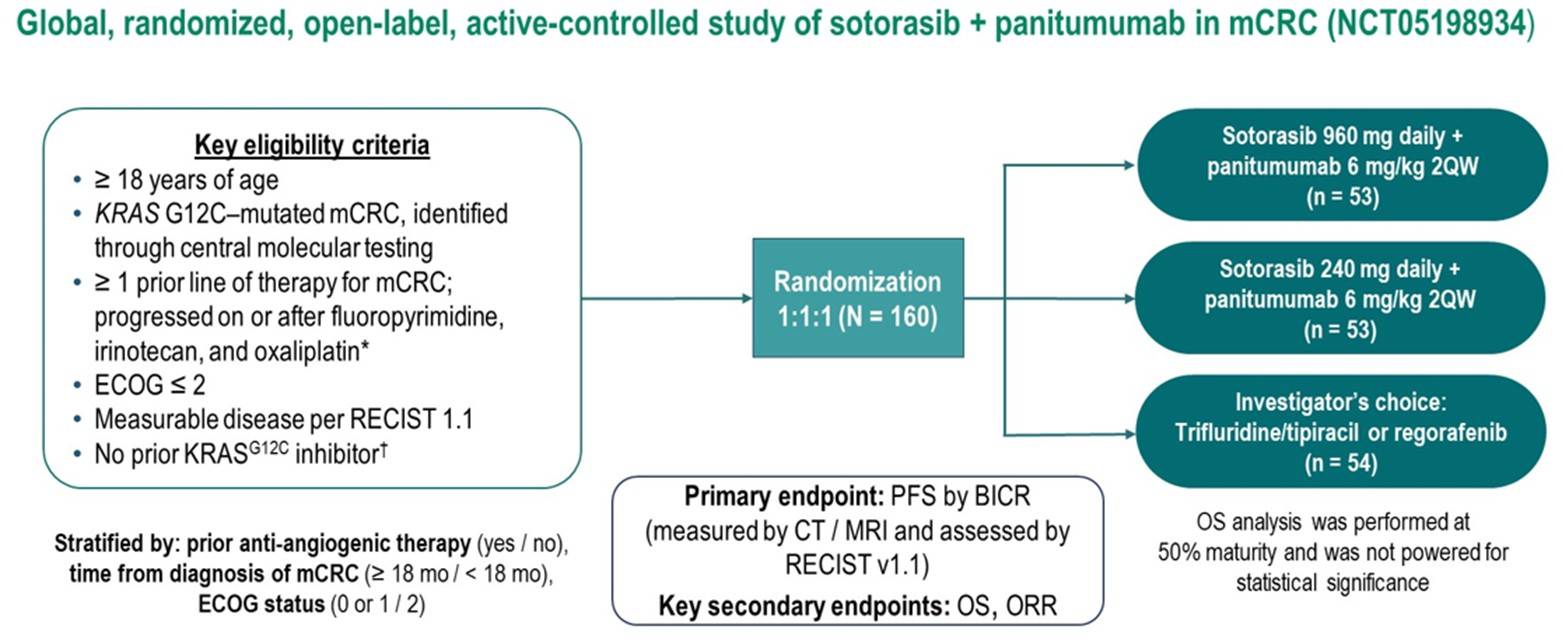
图2:CodeBreak300研究设计
本次ASCO会议主要对OS结果进行更新[9]。中位随访13.6个月之后,Sotorasib 960 mg+帕尼单抗组的中位OS尚未达到,Sotorasib 240 mg+帕尼单抗组的中位OS为11.9个月;与研究者选择的方案相比,Sotorasib(240mg和960 mg)+帕尼单抗组均显示出OS的提升趋势,Sotorasib 960 mg+帕尼单抗组的死亡风险降低30%(图3)。此外,Sotorasib 960mg+帕尼单抗组的中位DOR达到10.1个月。

图3: ITT人群最终OS
从三组患者后续接受的抗肿瘤治疗方案(图4)中观察到,研究者选择组有31%的患者后续接受了含KRAS G12C抑制剂的治疗方案。
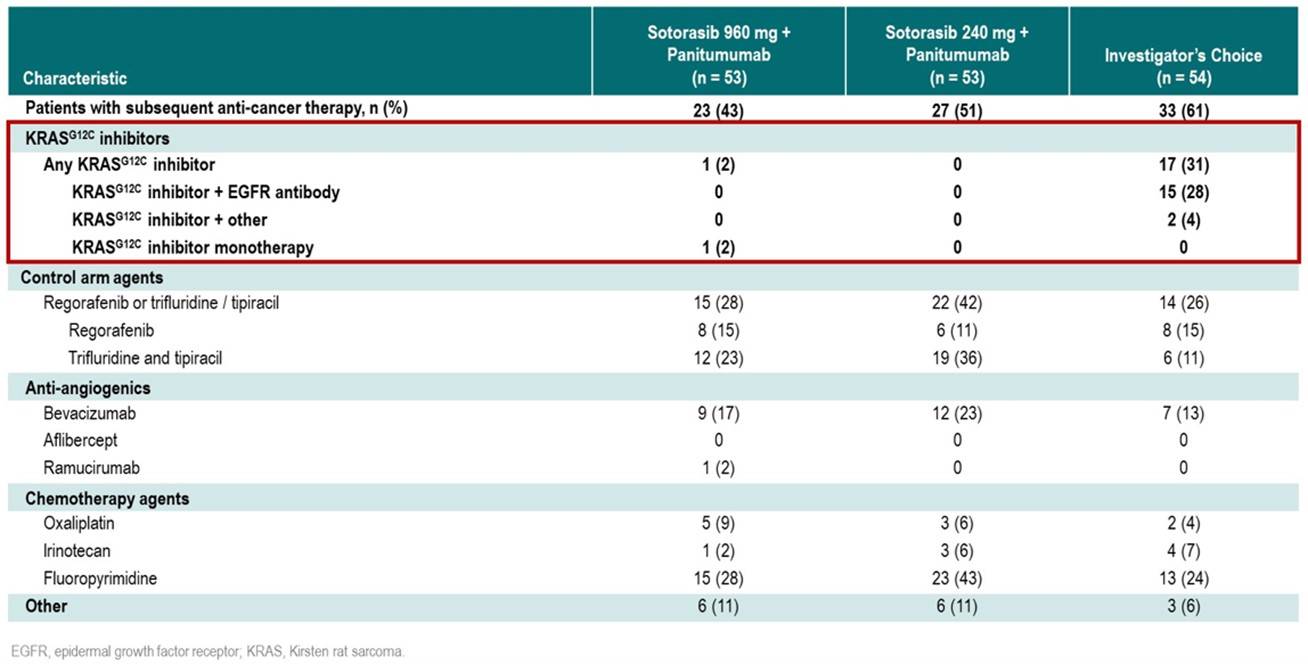
图4:后续抗肿瘤治疗
相比研究者选择组,Sotorasib 960mg+帕尼单抗组的mCRC患者的OS有改善的趋势, 中位OS尚未达到且因为DOR长Kaplan-Meier曲线呈现稳定的平台期;研究者选择组31%的患者后续接受了含KRAS G12C抑制剂的治疗方案,这可能一定程度上延长了该组患者的总生存。Sotorasib 960mg+帕尼单抗组在主要终点PFS上具有显著优势,基于这些结果支持使用Sotorasib 960mg+帕尼单抗作为化疗难治性KRAS G12C突变型mCRC患者的一种新的SOC治疗。
回顾:KRAS G12C抑制剂治疗结直肠癌研究梳理及解读
KRAS G12C抑制剂单药数据
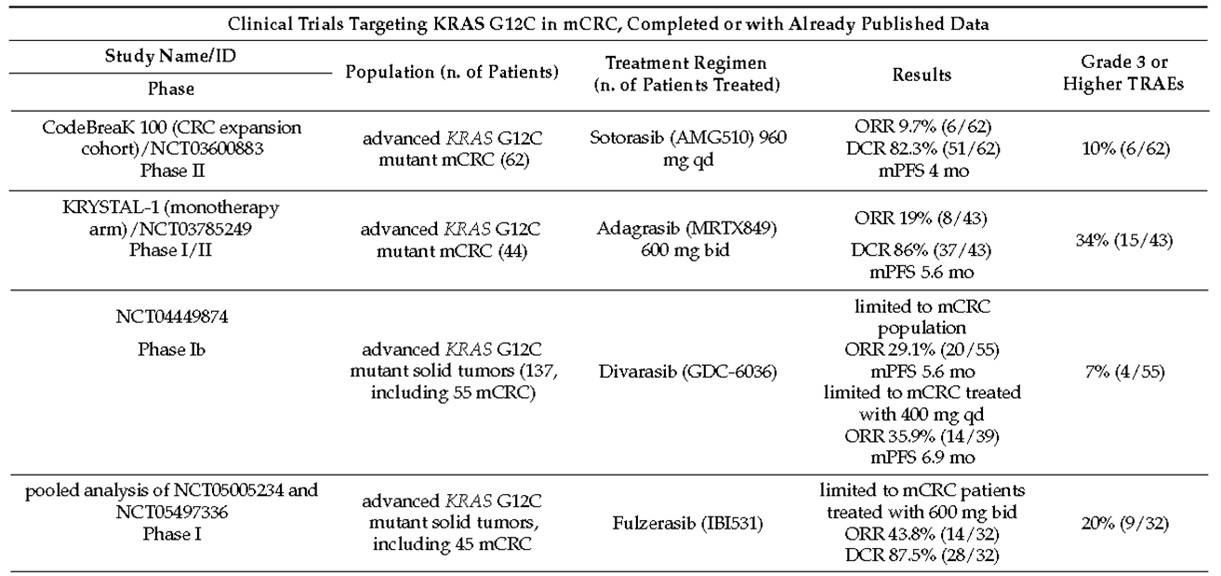
在过去几年,多种KRAS G12C抑制剂相继被成功开发,并进入临床研究阶段,在转移性结直肠癌领域探索的KRAS G12C抑制剂包括索托拉西布(Sotorasib)、阿达格拉西布(Adagrasib)、地瓦拉西布(Divarasib)、IBI351以及D-1553等,这些靶向药物开展了从单药到联合抗EGFR单抗治疗KRAS G12C突变mCRC的一系列研究,表1汇总了目前已发表的KRAS G12C抑制剂单药的疗效和安全性数据[10],总体而言,单药在经治的KRAS G12C突变mCRC患者中显示出良好的缩瘤作用和疾病控制,且安全性良好,然而与NSCLC中的疗效相比,在晚期肠癌中的临床获益有限。Sotorasib 单药治疗在 mCRC中ORR为9.7%,mPFS为4个月,而在NSCLC中,Sotorasib单药治疗实现了41%的ORR和6.3个月的mPFS[11]。同样,使用Divarasib后,NSCLC和CRC之间的疗效数据也存在较大差异,NSCLC患者的ORR更高,达到53.4%,mPFS为13.1个月,mCRC中ORR为35.9%,mPFS为6.9个月[12]。如何优化临床策略,让KRAS G12C突变mCRC患者实现最大程度的获益还需要从基础研究中探寻。
表1:KRAS G12C抑制剂单药在KRAS G12C突变mCRC中的疗效及安全性数据(已发表数据)
Amodio[13]等人发现CRC细胞系表现出更高水平RTK活化,NSCLC细胞系未检测到基础RTK活化,而RTK活化会进一步激活 EGFR 的反应性,在这种并发机制的环境下,单独抑制KRAS G12C不能抑制细胞生长和增殖。因此,在体外结直肠癌患者模型中研究了KRAS G12C抑制剂和抗EGFR单抗的协同组合,结果显示肿瘤显著消退甚至完全缓解。
KRAS G12C抑制剂联合抗EGFR单抗数据
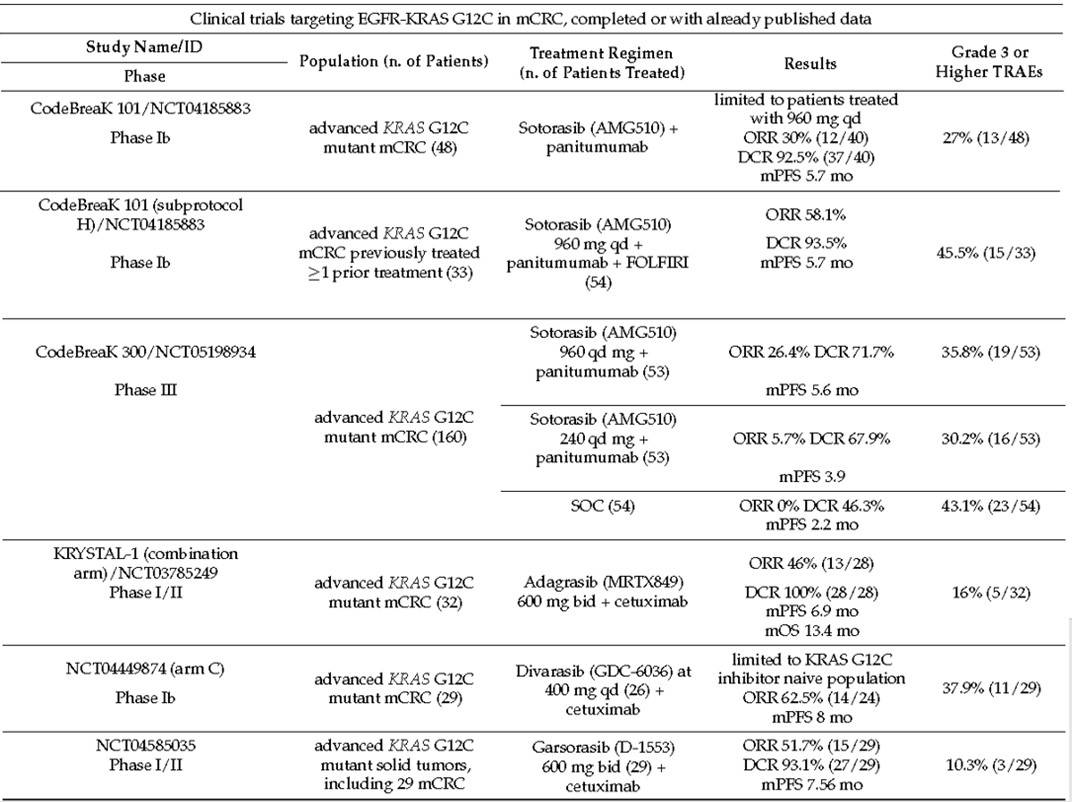
在研究CodeBreaK 101、CodeBreaK 300、KRYSTAL-1等研究中均已证实KRAS G12C抑制剂联合抗EGFR单抗具有协同作用,表2中罗列了既往已发表的联合治疗研究数据[10]。在I期KRYSTAL-1研究中,与Adagrasib单药治疗相比,接受Adagrasib联合西妥昔单抗治疗的患者ORR从19%提升到46%,ctDNA的探索性分析显示,联合治疗组在两个周期后KRAS G12C突变等位基因的清除率高于单药治疗组(88% vs. 55%)。
今年6月,合并分析KRYSTAL-1研究I期和II期扩展队列联合治疗组患者的最新数据发表在《Cancer Discovery》[14]上,该研究共纳入94例患者,中位随访时间为11.9个月,ORR为34%(95% CI:25%,45%),疾病控制率(DCR)为85.1% (95% CI, 76.3,91.6),中位DOR为5.8个月(95% CI:4.2,7.6),31%的应答患者DOR至少为6个月,mPFS为6.9个月(95% CI, 5.7,7.4),mOS为15.9个月(95% CI, 11.8,18.8)。基于该研究,2024年6月21日,FDA加速批准了Adagrasib联合西妥昔单抗用于既往接受过基于氟尿嘧啶、奥沙利铂和伊立替康的治疗的KRAS G12C突变局部晚期或转移性结直肠癌成人患者,是FDA获批的首个针对KRAS G12C结直肠癌患者的适应症。此外评估 Adagrasib联合西妥昔单抗对比单用化疗二线治疗KRAS G12C突变mCRC的III期研究KRYSTAL-10正在进行中,期待该研究的结果。
Divarasib联合西妥昔单抗在先前未接受过KRAS G12C抑制剂治疗的患者中,ORR高达62.5%,mPFS为8个月,并且5例之前接受过KRAS G12C抑制剂治疗的患者中有3例接受该联合方案治疗后达到了PR。中山大学肿瘤防治中心徐瑞华院长牵头在中国人群中开展的D-1553联合西妥昔单抗的研究中ORR也达到了51.7%。
表2:KRAS G12C抑制剂联合抗EGFR单抗在KRAS G12C突变mCRC中的疗效及安全性数据(已发表数据)
展望:KRAS G12C抑制剂正在开展的相关研究
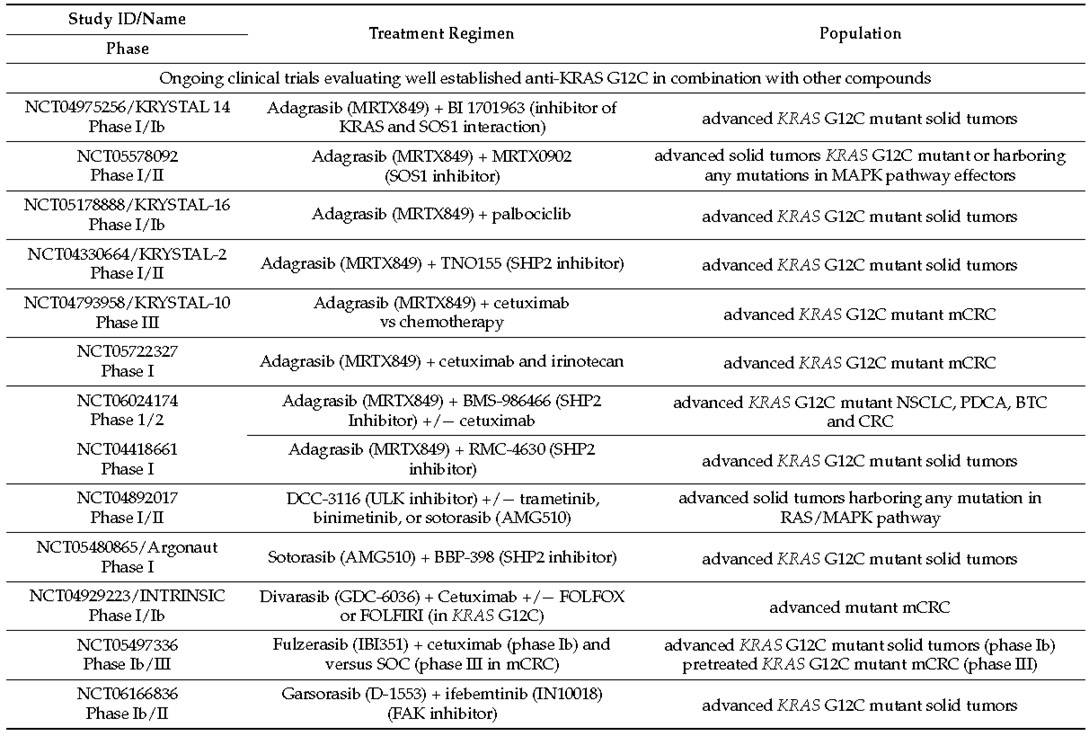
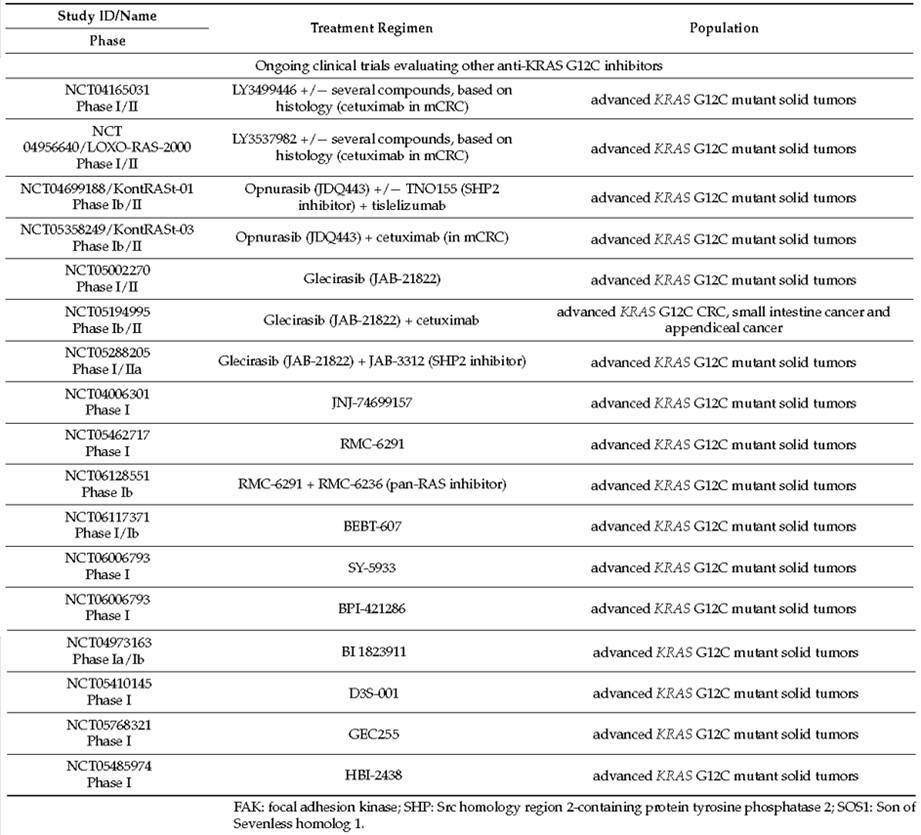
关于KRAS G12C突变mCRC临床治疗策略的优化,除了上述KRAS G12C抑制剂联合抗EGFR单抗的模式以外,Ryan等人[15]通过对KRAS G12C抑制剂适应性耐药的进一步探索发现可能有其它潜在的联合策略,他们发现 MAPK通路的反弹是适应性耐药的主要机制,通过显著诱导GTP结合野生型HRAS和KRAS导致MAPK通路以不依赖KRAS G12C的方式激活,基于此无法通过增加KRAS G12C抑制剂的剂量来克服它。相反,涉及上游和下游抑制的策略,特别是使用SHP2或MEK抑制剂,可在体外对MAPK信号产生强烈而持续的抑制,这项研究提出了一种可能性,即KRAS G12C抑制剂与MAPK通路上的其他抑制剂的联合。此外Hillig等人[16]研究显示同时抑制SOS1和KRAS在KRAS G12C突变癌细胞的临床前模型中具有协同作用。基于基础研究结果的支撑,目前有多项KRAS G12C抑制剂联合MAPK通路上不同的靶向药物(抗SHP2、抗SOS1或泛RAS抑制剂等)相关研究正在开展(表3)[10]。
从目前的临床数据来看,KRAS G12C抑制剂联合抗EGFR单抗治疗KRAS G12C突变mCRC患者的疗效良好且安全性可控,考虑到国内暂无KRAS G12C抑制剂上市,存在药物不可及的因素,推荐KRAS G12突变mCRC患者积极参加国内正在开展的KRAS G12C抑制剂联合抗EGFR单抗的III期临床研究。
表3:正在开展的KRAS G12C抑制剂联合其它药物的临床研究
1. Muzny DM, et al. Comprehensive molecular characterization of human colon and rectal cancer. Nature. 2012 Jul 18;487(7407):330-7.
2. Cervantes A, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023 Jan;34(1):10-32.
3. Zhu G, et al. Role of oncogenic KRAS in the prognosis, diagnosis and treatment of colorectal cancer. Mol Cancer. 2021 Nov 6;20(1):143.
4. Fakih M, et al. Real-World Study of Characteristics and Treatment Outcomes Among Patients with KRAS p.G12C-Mutated or Other KRAS Mutated Metastatic Colorectal Cancer. Oncologist 2022,27, 663-674.
5. Van de Haar J, et al. Codon-specific KRAS mutations predict survival benefit of trifluridine/tipiracil in metastatic colorectal cancer. Nat Med. 2023 Mar;29(3):605-614.
6. 袁瑛,张苏展.结直肠癌分子标志物临床检测中国专家共识[J].中华胃肠外科杂志, 2021(003):024.
7. 2024年《CSCO结直肠癌诊疗指南》.
8. Fakih MG, et al. Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. N Engl J Med. 2023 Dec 7;389(23):2125-2139.
9. Marwan Fakih, et al. Overall survival (OS) of phase 3 CodeBreaK 300 study of sotorasib plus panitumumab (soto+pani) versus investigator’s choice of therapy for KRAS G12C-mutated metastatic colorectal cancer (mCRC). 2024 ASCO, Abs LBA3510.
10. Ros J, et al. Targeting KRAS G12C Mutation in Colorectal Cancer, A Review: New Arrows in the Quiver. Int J Mol Sci. 2024 Mar 14;25(6):3304.
11. Dy GK, et al. Long-Term Outcomes and Molecular Correlates of Sotorasib Efficacy in Patients With Pretreated KRAS G12C-Mutated Non-Small-Cell Lung Cancer: 2-Year Analysis of CodeBreaK 100. J Clin Oncol. 2023 Jun 20;41(18):3311-3317.
12. Sacher A, et al. Single-Agent Divarasib (GDC-6036) in Solid Tumors with a KRAS G12C Mutation. N Engl J Med. 2023 Aug 24;389(8):710-721.
13. Amodio V, et al. EGFR Blockade Reverts Resistance to KRASG12C Inhibition in Colorectal Cancer. Cancer Discov. 2020 Aug;10(8):1129-1139.
14. Yaeger R, et al. Efficacy and Safety of Adagrasib plus Cetuximab in Patients with KRASG12C-Mutated Metastatic Colorectal Cancer. Cancer Discov. 2024 Jun 3;14(6):982-993.
15. Ryan MB, et al. KRASG12C-independent feedback activation of wild-type RAS constrains KRASG12C inhibitor efficacy. Cell Rep. 2022 Jun 21;39(12):110993.
16. Hillig RC, et al. Discovery of potent SOS1 inhibitors that block RAS activation via disruption of the RAS-SOS1 interaction. Proc Natl Acad Sci U S A. 2019 Feb 12;116(7):2551-2560.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


