单位:上海交通大学医学院附属瑞金医院
2024年6月13日~6月16日,第29届欧洲血液病协会(EHA)年会将于“欧洲之门”西班牙马德里盛大召开。作为最重要的血液学会议之一,本次EHA年会共有近3000项研究的最新结果公布。摘要一经公布,【肿瘤资讯】第一时间邀请到上海交通大学医学院附属瑞金医院阎骅教授,就多发性骨髓瘤(MM)领域BCMA CAR-T治疗话题的重要进展进行了筛选与点评,内容如下。
国际医疗部副主任
全科医学科执行主任
主攻血液肿瘤机制和临床研究,作为主要负责人搭建骨髓瘤研究平台
先后赴美国M.D.Anderson
Cancer Center、麻省总医院做访问学者
省部级课题8项(第一负责人),科技部863计划1项(副组长),在Blood, Leukemia, Hematologica等国际重要核心期刊发表20余篇SCI文章
中国老年医学学会理事会常务理事
中国抗癌协会临床肿瘤学协作专业委员会(CSCO)执行委员会委员
中国抗癌协会血液肿瘤委员会委员
中华医学会血液学分会浆细胞学组委员
中国女医师协会血液专委会委员
上海女医师协会医学科普专委会副主任委员
亚洲骨髓瘤网(AMN)委员
中国卫健委高层次人才计划评审专家

Abstract S193:含有CD28跨膜结构域的BCMA CAR-T显示出更强的抗肿瘤作用
标题:ARI0002H, AN ACADEMIC CAR-T AGAINST BCMA IN MULTIPLE
MYELOMA, PRESENTS A MORE POTENT ANTITUMORAL ACTIVITY WHEN USING A TRANSMEMBRANE CD28 DOMAIN
作者:Oriol Cardús, et al.
研究背景
尽管BCMA 嵌合抗原受体(CAR)T细胞治疗在复发性/难治性(R/R)多发性骨髓瘤(MM)疗效显著,但接受该治疗的患者仍会复发。CAR-T细胞持久性低和 CAR-T 细胞耗竭是可能复发的原因。近期有研究阐明,CAR受体中的CD28跨膜结构域(CD28-TMD)可诱导CD28二聚化,形成CAR-CD28异源二聚体,从而提高对低丰度抗原的敏感性。我们实验室研发第二代CD8α-TMD BCMA-4-1BBz CAR-T 产品(ARI0002h;cesni-cel),将其应用于R/R MM患者取得了令人鼓舞的临床结果。
研究目的
本研究旨在开发一种新的抗BCMA CAR-T细胞,并对其进行CD28-TMD结构域修饰,以提高T细胞活化和敏感性,从而提高对表达低表达BCMA的MM 细胞的疗效。
研究方法
本研究从健康供体提取PBMC获得T细胞,使用CD3/CD28磁珠刺激并用慢病毒转染,其后第8天进行CAR表达评估,T细胞扩增8~10天后进行实验。利用CAR-T细胞处理MM 细胞系(U266、MM.1S 和 MM.1S BCMA dim 细胞系)。体外研究实验主要包括: 细胞毒性(靶细胞和效应细胞以不同比例共培养 24 小时后进行荧光检测)、细胞增殖(用CellTrace Far Red 标记T细胞,T细胞与肿瘤细胞系共培养72小时后通过流式细胞术进行分析)和细胞因子分泌。
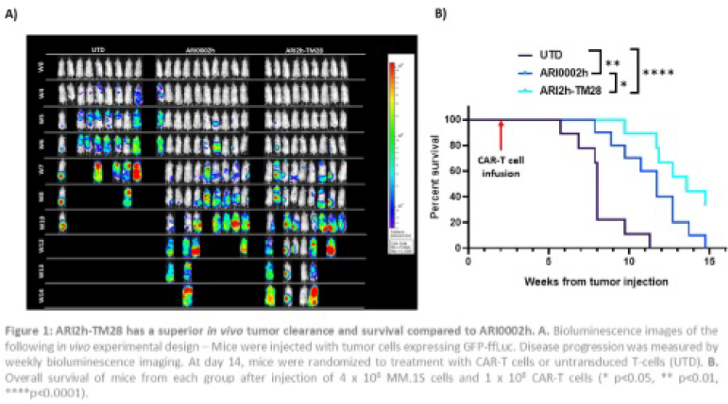
体内异种移植研究:第-1天雄性NSG小鼠接受2Gy辐照。在第0天,将表达GFP-ffLuc的MM细胞(MM.1S)通过尾静脉接种到小鼠体内。在第14天,将小鼠随机分为两组:未转染的CAR-T细胞(UTD)治疗组或CAR-T细胞治疗组。每周拍摄生物发光图像以监测疾病进展。
研究结果
首先,对ARI0002h CAR载体进行了改造,用CD28-TMD分子替换CD8α-TMD分子,得到了ARI2h-TM28。慢病毒转导后,ARI2h-TM28 CAR在T 细胞膜上表达,转染率为65%,与原始ARI0002h CAR(75%)相似。
随后,在高表达BCMA(U266和MM.1S)和低表达BCMA (MM.1S BCMA dim)的MM 细胞系中检测CAR-T对肿瘤细胞杀伤、细胞因子分泌和CAR-T增殖。结果显示,ARI0002h和ARI2h-TM28在细胞因子分泌和增殖能力方面无显著差异,但ARI2h-TM28对BCMA低表达的MM细胞表现出略高的相对细胞毒活性(24 h时细胞毒性高5%~10%),表明其敏感性更高。
为了验证CAR-T细胞的体内活性,我们使用了NSG小鼠和MM.1S细胞的异种移植模型(图1),向小鼠注射了高剂量的肿瘤细胞和低剂量的CAR-T细胞。在第5周时,ARI2h-TM28组的平均发光率为1.04x104 p/s/cm2/sr,而ARI0002h 组为 3.1x105 p/s/cm2/sr(p=0.022),ARI2h-TM28组肿瘤控制效果更佳,且ARI2h-TM28 组具有显著的生存优势(p=0.041)。
研究结论
包含CD28-TMD的ARI0002h CAR可在体外和体内对MM肿瘤细胞系产生更强的疗效,使其能够控制更高的肿瘤负荷,且长期疾病控制优于使用CD8α-TMD的CARs.
Abstract 211:BCMA双特异性抗体ABBV-383在复发/难治性多发性骨髓瘤(RRMM)患者中的疗效、安全性和PR2D测定
标题:EFFICACY, SAFETY, AND DETERMINATION OF RP2D OF ABBV-383, A BCMA BISPECIFIC ANTIBODY, IN PATIENTS WITH RELAPSED/REFRACTORY MULTIPLE MYELOMA (RRMM)
作者:Katja Weisel, et al.
研究背景
研究显示MM最终会对当前的治疗方案产生耐药,因此需要治疗方便、安全性更高的新疗法来提高患者(pt)的依从性、可及性和疗效。ABBV-383是二代BCMAxCD3双特异性抗体,含有2个高亲和力BCMA结合域,1个低亲和力CD3结合域以减轻细胞因子释放综合征(CRS),1个沉默的Fc尾部位点以延长药物半衰期从而降低给药剂量和频率。目前,ABBV-383已在单药治疗复发/难治性多发性骨髓瘤(RRMM)的人体首次I期临床试验中展现出良好的治疗潜力(Vij et al. Blood 2023;142[suppl1]:3378)。
研究目的
根据安全性和有效性分析明确ABBV-383单药治疗最佳的推荐II期剂量(Recommended Phase II Dose, RP2D)。
研究方法
NCT03933735是一项开放的、剂量递增和剂量扩展的I期临床试验,纳入既往接受过至少3种疗法的RRMM患者,包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)、抗CD38抗体疗法。ABBV-383在扩展阶段的用药剂量包括60mg Q4W和40或60mg Q3W。在第1周期的60mg Q4W组中给予固定剂量ABBV-383,并改良用药前地塞米松用量,缩短CRS监测周期,直至出现疾病进展或不可耐受的毒性反应。剂量扩展阶段的主要目标是评估药物安全性、耐受性、药代动力学(PK)、药效动力学(PD)并测定RP2D。疗效评估是次要目标。TEAEs 按照 CTCAE v5.0 标准进行评估,治疗效果按照 IMWG 2016 标准进行评估。
研究结果
截至2023年5月,220例患者接受了ABBV-383的治疗(中位年龄: 68[35~92]岁;中位既往接受疗法种类:5[3~23]种)。60mg Q4W组(n=21)、40mg Q3W组(n=55)和60mg Q3W组(n=61)的中位随访时间分别为4.1(0.8~5.2)个月、12.2(1.3~34.4)个月和24.2(0.6~33.4)个月。60mg Q4W组采用了改良的给药前方案,43%的患者出现CRS(38%G1, 5%G2),5%的患者出现ICANS(G2)。Q3W组有71%(40mg; 45% G1, 25% G2)和70%(60mg; 51% G1, 18% G2, 2% G3)患者出现CRS。60mg Q4W组、40mgQ3W组和60mg Q3W组在G3/4期发生嗜中性粒细胞减少,贫血和血小板减少的概率分别为14/24/10%、31/31/16%和34/13/13%;G3/4期的感染发生率分别为10/24/34%;ORR和≥VGPR分别为65/50%、64/53%和60/52%。暴露-反应(ER)分析和相关分析进一步支持了RP2D的测定结果。
研究结论
根据安全性、有效性和暴露-反应分析,60mg Q4W是ABBV-383单药治疗的最佳剂量。在不增加用药剂量的前提下延长ABBV-383用药间隔至Q4W,并缩短第1周期的CRS检测周期,将提高患者用药的便利性,减少患者治疗负担。综合以上结果,RRMM的III期试验(NCT06158841)将选用ABBV-383 60mg Q4W进行研究。
Abstract 200:双靶向BCMA和CD19的Fastcar-T (GC012F) 应用在符合移植条件的新诊断高危多发性骨髓瘤一线治疗的I期开放标签单臂研究
标题:A PHASE I OPEN-LABEL SINGLE-ARM STUDY OF DUAL TARGETING BCMA AND CD19 FASTCAR-T (GC012F) AS FIRST-LINE THERAPY FOR TRANSPLANT-ELIGIBLE NEWLY DIAGNOSED HIGH-RISK MULTIPLE MYELOMA
作者:Juan Du, et al.
研究背景
高危(HR)新诊断的多发性骨髓瘤(NDMM)采用标准的一线疗法往往疗效不佳,即使是符合移植条件(TE)的患者也是如此。疗效高且安全性可控的CAR-T疗法有可能解决这一困境。GC012F是一种BCMA和CD19双靶向的CAR-T疗法,采用新型FasTCAR-T平台制作CAR-T细胞,可实现次日产出细胞。GC012F在TE HR NDMM患者(NCT04935580)中的研究数据已在2023 ASH会议进行报告(摘要#174841)。在此,我们将介绍这项研究中22位患者的最新数据。
研究目的
该I期单臂研究在TE HR NDMM患者的一线治疗中进行,旨在确定 GC012F CAR-T细胞疗法的安全性和可行性。
研究方法
入组TE NDMM患者年龄在18岁至70岁之间,具有以下一个或多个特征,符合条件:R-ISS-II期或-III期;del17p、t (4;14)、t (14;16)或1q21≥4拷贝;髓外疾病(EM);IgD或IgE亚型;LDH>正常值上限;符合mSMART3.0的任何高危定义。
22例可评估患者具有一种或多种HR特征,其中91%为R-ISS II期或III期,55%为EM,32%为1q21≥4拷贝,9%为IgD亚型。所有患者在输注前均接受了2个周期的诱导治疗。在标准的3天淋清治疗后,GC012F以1x105细胞/kg(n=1)、2x105/kg(n=4)、3x105/kg(n=17)3个剂量水平单次输注。
研究结果
截至2024年2月27日数据截止日,中位随访时间为23.2个月(范围为 11.5~33.3个月)。总体缓解率(ORR)为100%,严格完全缓解(sCR)为95.5%。通过Euroflow(灵敏度为10-6)评估,所有接受治疗的患者(100%)在所有剂量水平上都达到了最小残留病(MRD)阴性。所有可评估的患者在第1个月和第12个月均达到MRD阴性,19例患者在最后一次随访时保持MRD阴性。18个月的无进展生存率为95.45%。只有6例患者(27%)出现低度细胞因子释放综合征(CRS)(5例1级,1例2级)。没有观察到≥3级的CRS和任何级别的ICANS。所有受试者都观察到了明显的CAR-T细胞扩增;中位扩增峰值(Cmax)为62,131个拷贝/μg DNA(范围:8,754~331,159),中位Tmax 为10天(范围:9~14天)。
研究结论
与之前接受GC012F治疗的RRMM患者队列一致,这项研究的初步数据表明,GC012F能使TE HR NDMM患者获得深度和持久的应答,而且安全性非常好。所有三个剂量组都达到了MRD阴性和100% ORR。GC012F取得的令人鼓舞的初步结果,证明了CAR-T疗法治疗NDMM患者的潜力。
Abstract 206:EQUE-CEL,一种新型全人源 BCMA 靶向 CAR-T 疗法,适用于高风险新诊断多发性骨髓瘤患者
标题:Eque-cel, a novel fully human BCMA-targeting CAR-T therapy in patients with high risk newly diagnosed multiple myeloma
作者:Lijuan Chen, et al.
研究背景
Eque-cel是一种全人BCMA特异性CAR结构,已获准在中国上市,用于治疗既往接受过至少三线治疗的复发/难治性多发性骨髓瘤(RRMM)患者。相关数据已在第 20 届 IMS 年会上报告(摘要 P-290)。在此,我们报告Eque-cel在FUMANBA-2研究(NCT05181501)中对符合移植条件的高风险新诊断MM患者的疗效和安全性数据。
研究目的
本研究旨在评估 Eque-cel 的安全性、有效性和 PK/PD。
研究方法
FUMANBA-2是一项多中心、开放标签、1期单臂研究,旨在评估Eque-cel在具有高风险特征(根据mSMART 3.0标准定义为RISS III期、双打击或三打击)的新诊断MM(NDMM)患者中的应用。患者在输注Eque-cel前接受4个周期的诱导治疗(推荐方案包括硼替佐米-来那度胺-地塞米松、硼替佐米-环磷酰胺-地塞米松或硼替佐米-阿霉素-地塞米松)。第三个诱导治疗周期结束后,经评估不符合自体干细胞移植(ASCT)条件的患者进行T细胞采集,用于制备Eque-cel。在使用氟达拉宾-环磷酰胺进行淋清后,患者接受单次输注Eque-cel,剂量为1.0 x 106 CAR-T细胞/Kg。主要疗效终点是观察微小残留病灶阴性(MRD-;灵敏度<10-5)患者的比例和无进展生存期(PFS)。次要终点包括总缓解率、缓解持续时间、安全性、药代动力学和药效学(可溶性BCMA水平和细胞动力学)。
研究结果
16例患者(68.8%男性;中位年龄58.5岁)接受了Eque-cel治疗。16例患者均伴有高危细胞遗传学改变,其中双重打击占62.5%(10/16),三重打击占12.5%(2/16)。患者中25%(4/16)伴有髓外病变,37.5%(6/16)患者为R-ISS Ⅲ期。
截至2024年1月25日,16例患者(68.8%为男性;中位年龄58.5岁[范围 51-69])接受了Eque- cel治疗,中位随访时间为 13.1 个月(范围 7.9-24.3)。全部患者都检测到了高风险细胞遗传学,包括62.5%(10/16)的双基因突变患者和12.5%(2/16)的三基因突变患者。25%(4/16)的患者患有髓外疾病。37.5%(6/16)的患者为R-ISS III期疾病,其中6.3%(1/16)的患者为双基因突变,6.3%(1/16)的患者为三基因突变。仅有1例患者在输注Eque-cel后的第92天开始接受来那度胺作为研究者决定的维持治疗,并在第96天因过敏而停药。
输注 Eque-cel 后中位随访7.46个月(2.8~18.1个月),所有患者均达到 MRD 阴性。其中,71.4%(95% CI:25.8~92.0)的患者在 6 个月内持续 MRD 阴性。观察到100%的ORR,93.8%(15/16)≥CR。未达到中位DOR和中位PFS。6个月的PFS率为93.8%(95% CI:63.23~99.10),12个月的PFS率为84.4%(95% CI:49.31~96.00)。
68.8%(11/16)的患者出现了1-2级 CRS。未观察到≥3级CRS,也未观察到ICANS或神经毒性。最常见的≥3级治疗相关AE为中性粒细胞减少(81.3%)、淋巴细胞减少(68.8%)和白细胞减少(62.5%)。25.0%(4/16)的患者发生了≥3级感染疾病,只有1例超过允许啊吧3级呼吸道感染患者被认为与Eque-cel治疗有关。1例患者死亡,研究者认为其死因主要为Covid-19感染,与Eque-cel无关。
Eque-cel扩增的中位峰值水平为79681.30拷贝/μg gDNA,中位时间为10 天(7~21天)。输注后,Eque-cel的中位持续时间为75天(29~283天)。81.25%(13/16)患者体内的可溶性BCMA在输注后1个月内被全面清除。观察到炎症细胞因子的诱导,IL-6的中位峰值水平为64.28(范围:9.12~3017.83)pg/mL,CRP为49.30(范围:3.66~117.30)mg/L,铁蛋白为553.35(范围:68.10~2349.00)ng/mL。
研究结论
Eque-cel在不符合移植条件的高危NDMM患者中取得了深度反应。与RRMM相比,高风险NDMM的CRS发生率和严重程度较低,显示出更有利的安全性。这些结果支持Eque-cel在符合移植条件的NDMM患者中具有良好的临床获益-风险特征。
排版编辑:Amiee
2024EHA官网
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


