恶性胸腔积液(MPE)是胸腔内大量渗出液体的聚集,主要源于恶性肿瘤患者的胸膜转移。MPE的形成与血管生成、血管通透性增加、淋巴管阻塞、免疫反应和肿瘤转移微环境有关,但目前仍缺乏针对 MPE 的分子诊断和新一代治疗策略。外泌体是一种具有双层脂膜结构的囊泡,广泛分布于体液中,几乎所有细胞都能产生。越来越多的证据表明,外泌体与MPE的发展有关,并与靶向或免疫治疗的疗效和反应有关。虽然外泌体是MPE的主要组成部分之一,但外泌体在MPE中的来源和功能作用尚不清楚。近期,浙江省肿瘤医院赵安研究员等对该问题进行了通讯报道,发表在《中华医学杂志(英文版)》杂志上(2024 Apr 3. doi: 10.1097/CM9.0000000000003078)。
2002年,Andre等人[1]首次在癌症患者的恶性积液中发现了外泌体的积累。外泌体可以将特定的肿瘤抗原转移到树突状细胞(DC),并诱导抗肿瘤反应,为肿瘤免疫提供了新的机会。2004年,Bard等人[2]从间皮瘤患者的胸腔积液中分离出外泌体,发现内体转运蛋白分选连接蛋白(sorting nexin)诱导表皮生长因子受体(epidermal growth factor receptor, EGFR)表达降低,并将肿瘤抗原转移到DC。Creaney等人[3]进行了一项全面的蛋白质组学研究,恶性胸膜间皮瘤(MPM)细胞比非恶性间皮细胞分泌更多的外泌体,外泌体高表达 MPM 相关蛋白。上述发现表明肿瘤细胞是外泌体的主要来源之一。
也有报道称,健康人的胸腔积液主要由CD8+ T细胞组成,而间皮瘤、腺癌胸膜转移或与石棉暴露相关的良性胸膜病变患者的胸腔积液主要由CD4+ T细胞组成[4]。此外,耗尽的CD8+ T细胞分泌的程序性死亡蛋白1 (PD1)+外泌体已被证明在MPE中发挥免疫调节作用[5]。调节性T细胞(Tregs)分泌的外泌体在器官移植过程中通过破坏自身反应性CD8+T细胞来抑制免疫排斥反应和诱导免疫耐受[6]。胸膜丰富的淋巴系统导致胸腔积液中免疫细胞的显著丰富,胸膜内肿瘤细胞的转移提示MPE中淋巴细胞来源的外泌体可能具有恶性功能。
最近有研究报道CD14+ CD163+巨噬细胞(MACs)可作为MPE的诊断标志物,并且MPE中的CD163+MACs与肺癌患者的无进展生存期呈负相关[7]。例如,M2 型 MAC 衍生的外泌体可以通过传递 microRNA (miRNA) 并通过将 miRNA 转移到 CD4+ T 细胞来诱导 Treg/CD4+ T 辅助细胞 17 失衡来促进肿瘤进展[8]。除了 MPE 中的肿瘤细胞和淋巴细胞外,髓系细胞及其释放的外泌体在MPE中的作用除了 MPE 中的肿瘤细胞和淋巴细胞外,髓系细胞及其释放的外泌体在 MPE 中的功能也值得进一步研究。
MPE是各种恶性肿瘤晚期常见的并发症,几乎在所有恶性肿瘤中都有发生。尽管MPE的存在通常是预后不良的标志,但MPE中丰富的肿瘤来源的外泌体为迅速增加可用于潜在诊断和治疗应用[图1]。
利用外泌体作为生物标记物的优势在于其包裹的核酸片段可以抵抗核酸酶的消化,从而实现对外泌体 RNA 的定性和定量检测。Tamiya等人[9]报道,外泌体 miRNA-182 和 miRNA-210 可区分肺腺癌的良性和恶性病例,他们认为,由于血清和胸腔积液中的 miRNA 表达没有相关性,分析 MPE 相关外泌体可能是诊断和监测肺癌的更准确方法。Wang等人[10]在分析肺良性疾病、肺腺癌和肺结核胸腔积液的外泌体表达谱时,也发现了一些miRNA,包括miRNA-205-5p、miRNA-483-5p、miRNA-375和miRNA-141-3p,它们在肺癌中的表达显著增加。
来自MPE患者的外体DNA已被用于检测EGFR突变;与肿瘤组织活检相比,该方法在预测表皮生长因子受体酪氨酸激酶抑制剂 (TKI) 治疗反应方面的灵敏度为 100%,特异性为 96.55%,有效率为 83%[11]。此外,有针对性的下一代测序已经被用于分析晚期肺腺癌患者的胸腔积液外泌体 DNA,发现276个基因突变,这些突变与胸腔积液中的游离DNA(cf-DNA)分析高度相似[12]。在18例EGFR-TKI耐药患者中,胸水外DNA检测EGFR基因突变13例(72.2%),cf-DNA检测T790M突变11例(61.1%)。
从MPE中提取的外泌体是理想的载体,可以从几个方面克服传统药物的局限性: (1)外泌体可从多种来源获得,并广泛分布于人体各处;(2)如果外泌体来自自体,则毒性低,免疫原性可控;(3)外泌体可穿透血脑屏障,将各种底物运送到靶点;(4)外泌体膜表面的蛋白质可作为配体或受体,增强其靶向能力;(5)外泌体还可通过抗原呈递刺激免疫系统。另一方面,来自肿瘤细胞的外泌体可结合新的抗原和/或主要组织相容性复合体-肽复合体,这些抗原和/或主要组织相容性复合体-肽复合体可直接被 DCs 呈递和交叉呈递,也可以直接激活自然杀伤细胞或巨噬细胞,从而启动和激活T细胞。
最近,一项将腹水中提取的细胞外囊泡(AEXs)与粒细胞-巨噬细胞集落刺激因子(GM-CSF)结合用于治疗结直肠癌的I期临床试验报告称,将AEXs直接注入患者体内是安全且耐受性良好的,并且AEXs与GM-CSF的结合可有效激活细胞毒性T淋巴细胞[14]。间充质干细胞相关外泌体还被开发为气雾化疫苗,其安全性和耐受性正在健康人群中进行评估(NCT04313647)[15]。鉴于MPE的原因之一是胸膜中淋巴细胞的高反应性,使用间充质干细胞相关外泌体作为疫苗来降低晚期癌症患者的MPE发生率也是一种改善患者预后的潜在方法。
尽管有关外泌体用于疾病诊断和治疗的研究仍在进行中,但有关应用外泌体治疗MPE的基础和临床研究还很缺乏。更好地了解外泌体在这一过程中的作用可能对逆转 MPE的关键。这一生理现象也提出了一个问题:是否可以在动物模型中创造一个体外MPE环境,以获得更多具有所需疗效的工程化和人源化外泌体。此外,随着合成生物学的快速发展,在合成外泌体的过程中自组装治疗分子成分正变得越来越可行性。
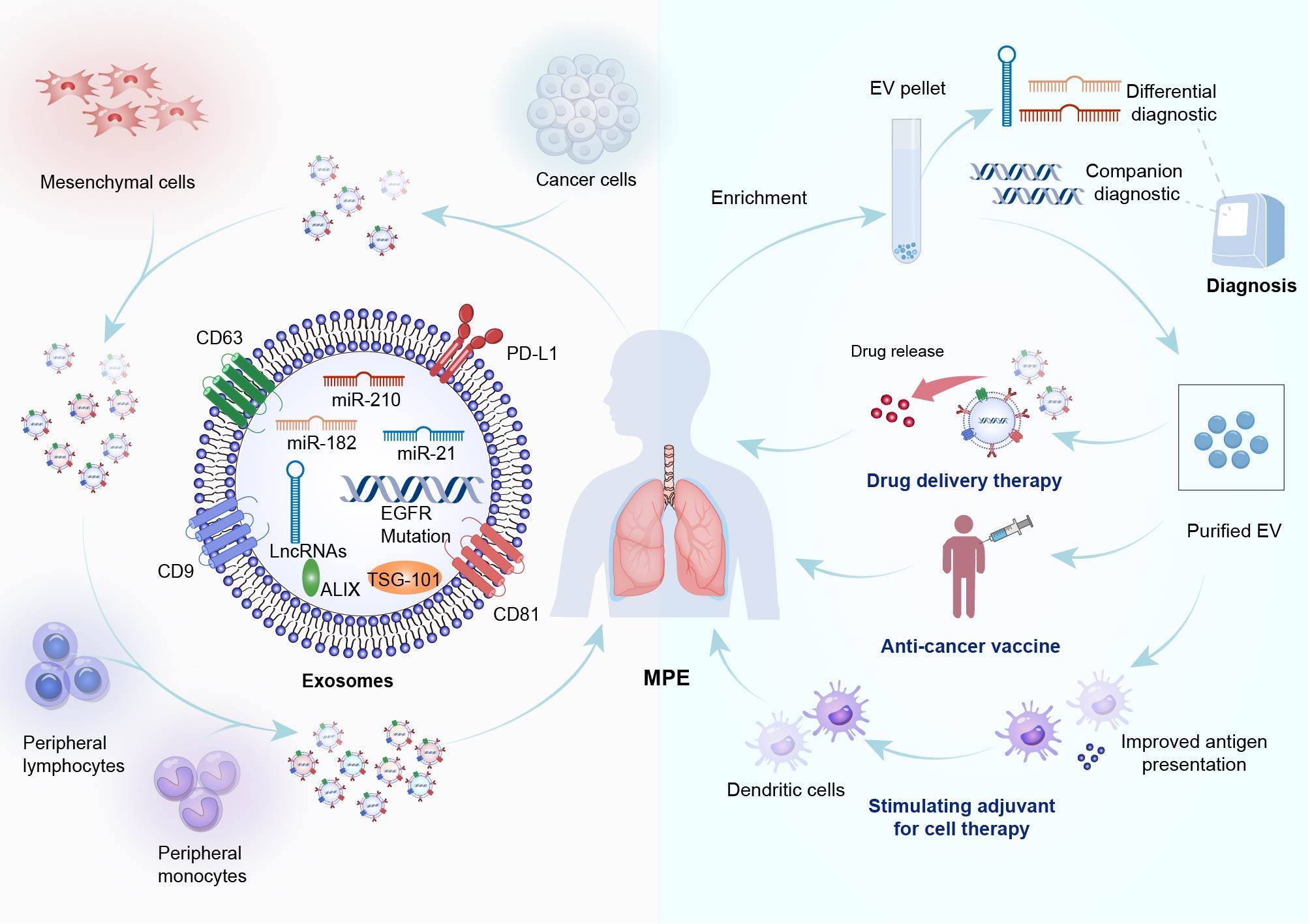
Figure1::MPE 中的外泌体:来源与应用。外泌体是细胞外囊泡 (EV) 的一个亚群,由癌细胞或基质细胞自然释放,在介导细胞间通信、促进形成转移前生态位、促进促血管生成效应和诱导免疫抑制方面发挥着关键作用。这些源自脂质双层膜的纳米囊泡含有多种细胞成分,包括核酸(如表皮生长因子受体突变、mRNA、miRNA-21、miRNA-182、miRNA-210 和 lncRNA); 生物生成相关蛋白(ALIX 和 TSG-101)、热休克蛋白、酶、脂质、粘附分子、受体以及参与抗原呈递的各种组织特异性跨膜蛋白(CD9、CD63、CD81 和 PD-L1)。外泌体的组成反映了其起源细胞的特征,这表明有可能利用下一代测序和质谱分析等技术将肿瘤衍生的外泌体作为潜在的癌症诊断生物标记物进行研究。外泌体有望成为药物输送和个性化癌症免疫疗法的治疗载体。例如,从 MPE 提取的外泌体可作为疫苗佐剂,而负载抗原的 DC 外泌体则显示出作为一种细胞疗法治疗癌症的潜力。从 MPE 中提取的大量外泌体具有巨大的转化应用潜力。ALIX: ALG-2-相互作用蛋白X;CD:分化簇;DC:树突状细胞; EGFR:表皮生长因子受体;EV:细胞外囊泡;lncRNA:长非编码 RNA; miRNA:mRNA:microRNA;MPE:恶性胸腔积液;mRNA:信使 RNA: PD-L1:程序性死亡配体 1;TSG-101:肿瘤易感基因-101。
Andre F, Schartz NE, Movassagh M, Flament C, Pautier P, Morice P, et al. Malignant effusions and immunogenic tumour-derived exosomes. Lancet 2002; 360 (9329): 295-305. doi: 10.1016/S0140-6736(02)09552-1.
2. Bard MP, Hegmans JP, Hemmes A, Luider TM, Willemsen R, Severijnen LA, et al. Proteomic analysis of exosomes isolated from human malignant pleural effusions. Am J Respir Cell Mol Biol 2004; 31 (1): 114-121. doi: 10.1165/rcmb.2003-0238OC.
3. Creaney J, Dick IM, Leon JS, Robinson BW. A Proteomic Analysis of the Malignant Mesothelioma Secretome Using iTRAQ. Cancer Genomics Proteomics 2017; 14 (2): 103-117. doi: 10.21873/cgp.20023.
4. Scherpereel A, Grigoriu BD, Noppen M, Gey T, Chahine B, Baldacci S, et al. Defect in recruiting effector memory CD8+ T-cells in malignant pleural effusions compared to normal pleural fluid. BMC Cancer 2013; 13 324. doi: 10.1186/1471-2407-13-324.
5. Wang X, Shen H, He Q, Tian W, Xia A, Lu XJ. Exosomes derived from exhausted CD8+ T cells impaired the anticancer function of normal CD8+ T cells. J Med Genet 2019; 56 (1): 29-31. doi: 10.1136/jmedgenet-2018-105439.
6. Bezie S, Anegon I, Guillonneau C. Advances on CD8+ Treg Cells and Their Potential in Transplantation. Transplantation 2018; 102 (9): 1467-1478. doi: 10.1097/TP.0000000000002258.
7. Yang L, Wang F, Wang L, Huang L, Wang J, Zhang B, et al. CD163+ tumor-associated macrophage is a prognostic biomarker and is associated with therapeutic effect on malignant pleural effusion of lung cancer patients. Oncotarget 2015; 6 (12): 10592-10603. doi: 10.18632/oncotarget.3547.
8. Zhou J, Li X, Wu X, Zhang T, Zhu Q, Wang X, et al. Exosomes Released from Tumor-Associated Macrophages Transfer miRNAs That Induce a Treg/Th17 Cell Imbalance in Epithelial Ovarian Cancer. Cancer Immunol Res 2018; 6 (12): 1578-1592. doi: 10.1158/2326-6066.CIR-17-0479.
9. Tamiya H, Mitani A, Saito A, Ishimori T, Saito M, Isago H, et al. Exosomal MicroRNA Expression Profiling in Patients with Lung Adenocarcinoma-associated Malignant Pleural Effusion. Anticancer Res 2018; 38 (12): 6707-6714. doi: 10.21873/anticanres.13039.
10. Wang Y, Xu YM, Zou YQ, Lin J, Huang B, Liu J, et al. Identification of differential expressed PE exosomal miRNA in lung adenocarcinoma, tuberculosis, and other benign lesions. Medicine (Baltimore) 2017; 96 (44): e8361. doi: 10.1097/MD.0000000000008361.
11. Qu X, Li Q, Yang J, Zhao H, Wang F, Zhang F, et al. Double-Stranded DNA in Exosomes of Malignant Pleural Effusions as a Novel DNA Source for EGFR Mutation Detection in Lung Adenocarcinoma. Front Oncol 2019; 9 931. doi: 10.3389/fonc.2019.00931.
12. Hur JY, Kim HJ, Lee JS, Choi CM, Lee JC, Jung MK, et al. Extracellular vesicle-derived DNA for performing EGFR genotyping of NSCLC patients. Mol Cancer 2018; 17 (1): 15. doi: 10.1186/s12943-018-0772-6.
13. Lee JS, Hur JY, Kim IA, Kim HJ, Choi CM, Lee JC, et al. Liquid biopsy using the supernatant of a pleural effusion for EGFR genotyping in pulmonary adenocarcinoma patients: a comparison between cell-free DNA and extracellular vesicle-derived DNA. BMC Cancer 2018; 18 (1): 1236. doi: 10.1186/s12885-018-5138-3.
14. Dai S, Wei D, Wu Z, Zhou X, Wei X, Huang H, et al. Phase I clinical trial of autologous ascites-derived exosomes combined with GM-CSF for colorectal cancer. Mol Ther 2008; 16 (4): 782-790. doi: 10.1038/mt.2008.1.
15. Shi MM, Yang QY, Monsel A, Yan JY, Dai CX, Zhao JY, et al. Preclinical efficacy and clinical safety of clinical-grade nebulized allogenic adipose mesenchymal stromal cells-derived extracellular vesicles. J Extracell Vesicles 2021; 10 (10): e12134. doi: 10.1002/jev2.12134.
排版编辑:肿瘤资讯-Hanna











 苏公网安备32059002004080号
苏公网安备32059002004080号


