p53基因是一种抑癌基因,自研究者们发现超过50%的人类肿瘤中均存在p53基因突变以来,p53基因及其蛋白产物就成为了领域内的研究热点[1]。靶向p53通路具有广泛的抗肿瘤潜力,但将其作为药物靶点的研究却面临着诸多挑战。为了克服这些挑战,研究者们转向了一种间接的策略——靶向鼠双微体基因2(MDM2)等p53负调控因子,即通过干预抑制p53功能的蛋白质或基因来恢复p53的抑癌功能[1]。基于该策略,MDM2-p53拮抗剂作为一种颇具前景的靶向药物被研发并投入临床研究。现有研究表明,部分MDM2-p53拮抗剂在临床治疗中展现了积极的效果,值得进一步的关注和期待。
本文旨在分享MDM2-p53信号通路的作用机制,并概述相关药物的研究进展,以促进学术交流与探讨。
环环相扣
论MDM2-p53信号通路与肿瘤
p53蛋白作为一种肿瘤抑制蛋白,在抑制肿瘤生长方面扮演着关键角色(图1)[2,3]。在正常的生理情况下,细胞内的p53蛋白具有较短的半衰期,从而令p53维持在一个相对较低的水平。然而,当细胞受到DNA损伤、氧化应激等情况时,p53泛素化被抑制,导致细胞内p53蛋白水平迅速升高,引发细胞周期停滞或凋亡。通过这种经典的p53信号通路调控方式,受损的细胞可以通过凋亡途径被体内清除[4],从而防止了潜在肿瘤细胞的累积。
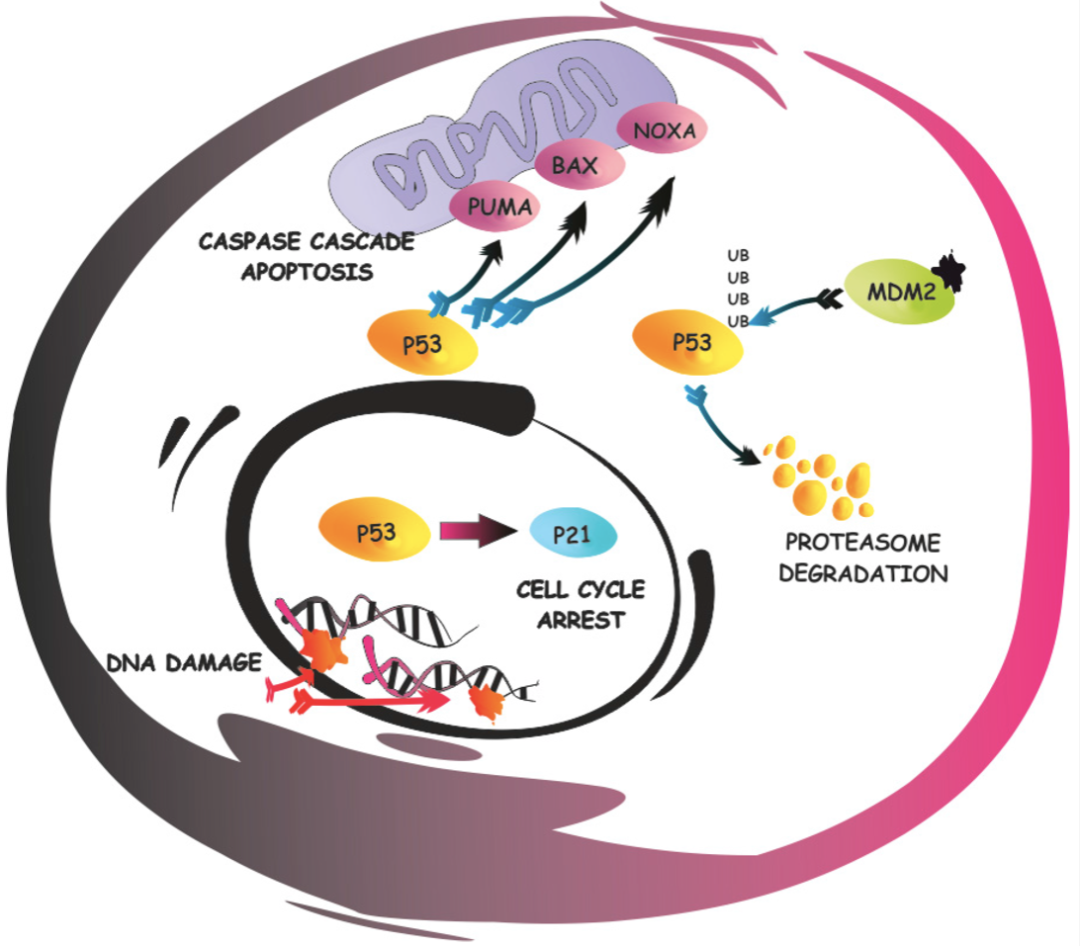
图1.p53通路[3]
p53与MDM2之间存在一种关键的负反馈调节机制,这种精细的调节机制对于确保细胞能够发挥正常的生物学功能至关重要[5]。MDM2蛋白作为负调控p53蛋白的E3泛素连接酶,能够通过泛素化对p53蛋白进行降解,进而抑制p53的抑癌功能,因而DNA损伤的细胞可能会逃避免疫监视并继续增殖,从而导致肿瘤的形成和进展[6,7]。大约5%~7%的肿瘤存在MDM2扩增[8],包括肉瘤、胆道癌、肺癌等多种肿瘤。以肉瘤为例,超过90%的高分化脂肪肉瘤(WDLPS)和去分化脂肪肉瘤(DDLPS)患者存在野生型TP53和MDM2扩增[9]。因此,阻断MDM2-p53相互作用以恢复野生型p53功能是具有野生型或功能性p53癌症患者的潜在治疗策略[10]。
如日方升
盘点靶向MDM2-p53通路相关在研药物
近年来,针对MDM2–p53信号通路的治疗策略已成为肿瘤学研究的热点领域之一,并显示出作为潜在治疗选择的巨大潜力。目前,多种靶向MDM2-p53通路的药物已经进入临床研究阶段(表1),并且在已公布的临床试验中展现出不同的疗效和安全性特征[11]。
表1.部分靶向MDM2-p53通路的药物[11]

Milademetan作为首个进入临床试验的MDM2-p53通路小分子抑制剂,在体外试验中显示出了抗肿瘤活性[12]。Milademetan的首次人体研究在107例晚期实体瘤或淋巴瘤患者中进行,结果显示,疾病控制率(DCR)为45.8%,中位无进展生存期(mPFS)为4.0个月;在DDLPS亚组中,DCR和mPFS分别为58.5%和7.2个月,初步显示疗效潜能[13]。然而,后续的Ⅲ期MANTRA试验中,与标准治疗(曲贝替定)相比,Milademetan治疗WD/DDLPS并未达到PFS的主要终点。因此,Milademetan暂停了在肉瘤领域的进一步开发[11]。
Siremadlin的Ib/II期临床研究探索了Siremadlin联合CDK4/6抑制剂治疗局部晚期或转移性脂肪肉瘤患者的疗效和安全性。入组的74例患者中,3例达到部分缓解(PR),38例患者疾病稳定(SD)[14]。口服抑制剂Alrizomadlin在临床前模型中也显示出了良好的抗肿瘤作用 [15],目前在实体瘤和血液肿瘤的多项临床研究正在开展。其中,在中国晚期脂肪肉瘤或其他实体瘤患者中的I期临床研究正在进行中[16]。
在众多靶向MDM2-p53通路的药物中,Brigimadlin(BI 907828)脱颖而出,成为特别值得关注的药物。作为一种高效口服的小分子MDM2-p53拮抗剂,Brigimadlin作用机制具有显著优势:一方面,它能够直接靶向肿瘤细胞,阻断MDM2-p53的相互作用,导致肿瘤细胞周期阻滞或凋亡,从而抑制肿瘤细胞的生长与扩散;另一方面,它还具有免疫调节功能,可以增加CD8+T细胞群,并诱导抗肿瘤免疫记忆,进而增强抗肿瘤效果(图2)[17,18]。在药代动力学(PK)特性方面,Brigimadlin因出色的高溶解性/高渗透性和低全身清除率而具有高生物利用度,且半衰期可达30至60小时,这些特性使得Brigimadlin能够满足多种不同的临床给药方案 [19]。凭借上述机制优势,临床前研究已证实Brigimadlin具有出色的抗肿瘤活性[19]。
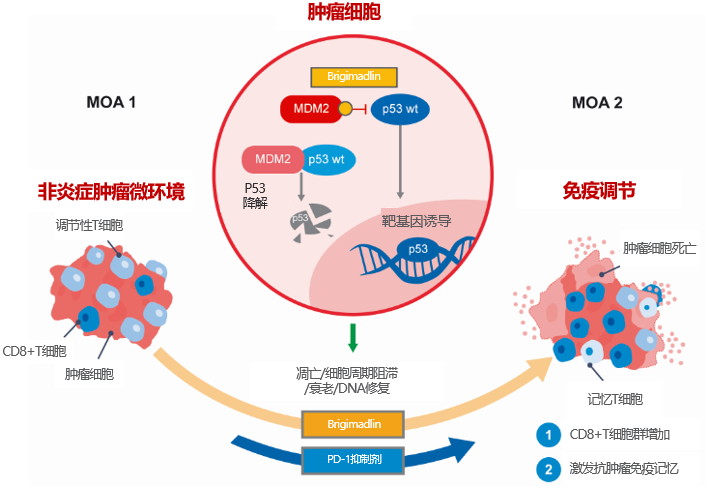
图2.Brigimadlin作用机制[18]
前景朗朗
Brigimadlin临床研究全面梳理
鉴于Brigimadlin独特的机制及其潜在的应用前景,多项相关临床研究已经有序地进行。目前公布的研究结果初步证实了Brigimadlin在临床治疗中具有良好的疗效和安全性。首先进行的Ia/Ib期剂量递增/扩展研究旨在评估Brigimadlin基于剂量限制毒性(DLT)的最大耐受剂量(MTD)、剂量拓展期推荐剂量(RDE)、安全性和耐受性、药代动力学、药效学以及初步疗效。该研究结果展现了Brigimadlin在晚期/转移性MDM2扩增实体瘤患者中的初步抗肿瘤活性,在整体人群中具有较高的DCR(74.1%)和较长的缓解时间,且安全可控。这些数据为Brigimadlin进一步的临床研究提供了更多证据和支持[20]。
2024年欧洲肿瘤内科学会肉瘤及罕见癌症大会(ESMO SRCC)上公布的最新数据显示,截至2024年1月23日,对85/86例DDLPS患者进行了疗效评估,初步mPFS为8.1个月 (95% CI 5.7–9.9),客观缓解率(ORR)为18.6%,DCR为86%(图3)[21]。截至2023年11月7日,对20/31的WDLPS患者进行疗效评估,3例(15%)达到PR,16例(80%)达到SD,DCR为95%,初步mPFS为25.1个月。对该研究中全部人群进行安全性分析,恶心(69.5%)和疲劳(54.2%)是最常见的治疗相关不良事件(TRAE),中性粒细胞减少症(27.4%)和血小板减少症(23.7%)是最常见的≥3级TRAEs。总体上,36.8%的患者发生了导致剂量减少的AE,仅11例患者(5.8%)停药[22]。
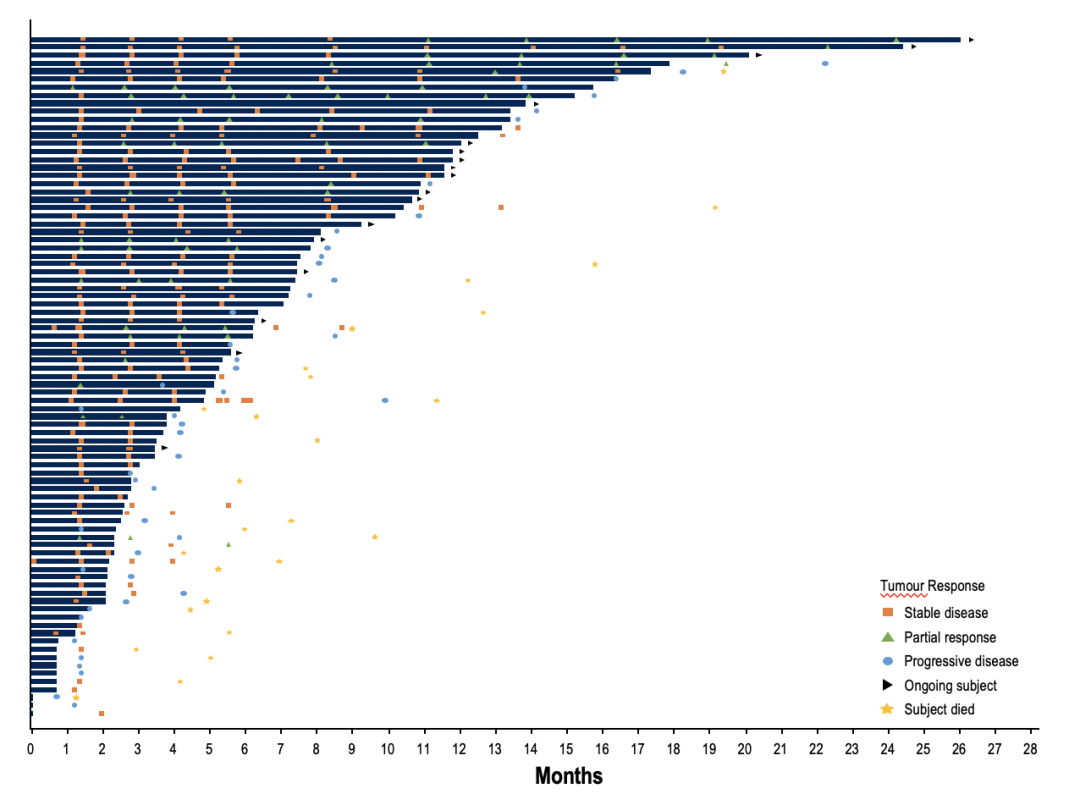
图3.Brigimadlin在DDLPS患者中的疗效[21]
基于Brigimadlin在前期临床研究中展现出的出色数据,其在DDLPS治疗领域的探索正逐步深入。Brightline-1是一项随机、开放标签、全球多中心的II/III期临床试验,旨在比较Brigimadlin与多柔比星一线治疗晚期DDLPS的疗效与安全性。主要终点是PFS,次要终点包括ORR、总生存期(OS)等[23]。Brightline-1研究在24个国家的130多个中心进行,目前已完成全球入组,其关键性试验结果值得期待[23]。
审稿专家
吴荻 教授
吉林大学第一医院肿瘤中心、肿瘤综合治疗疗区主任
主任医师,博士生导师
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会(CSCO)黑色素瘤专家委员会副主任委员
中国临床肿瘤学会(CSCO)非小细胞肺癌专家委员会委员
中国临床肿瘤学会(CSCO)小细胞肺癌专家委员会委员
中国临床肿瘤学会(CSCO)骨与软组织肉瘤专家委员会委员
中国临床肿瘤学会(CSCO)肿瘤心脏病学专家委员会常务委员
中国抗癌协会肿瘤转移专业委员会委员
中国抗癌协会黑色素瘤专业委员会常务委员
中国抗癌协会肉瘤专业委员会常务委员(化放疗学组副组长、
黑色素瘤学组副组长)
中国医药教育协会骨与软组织专家委员会常务委员
中国医药教育协会化疗专家委员会常务委员
亚洲黑色素瘤联盟委员
吉林省生命关怀协会黑色素瘤专业委员会主任委员
吉林省卫生系统拔尖创新人才
[1] Levine AJ. p53, the cellular gatekeeper for growth and division. Cell. 1997, 88: 323 – 331.
[2] Koo N, Sharma AK, Narayan S. Therapeutics Targeting p53-MDM2 Interaction to Induce Cancer Cell Death. Int J Mol Sci. 2022, 30;23(9):5005.
[3] Carrà G, Crivellaro S, Taulli R, Guerrasio A, Saglio G, Morotti A. Mechanisms of p53 Functional De-Regulation: Role of the IκB-α/p53 Complex. International Journal of Molecular Sciences. 2016; 17(12):1997.
[4] Wang H, Guo M, Wei H, Chen Y. Targeting p53 pathways: mechanisms, structures, and advances in therapy. Signal Transduct Target Ther. 2023, 1;8(1):92.
[5] Li B, Cheng Q, Li Z, et al. p53 inactivation by MDM2 and MDMX negative feedback loops in testicular germ cell tumors[J]. Cell Cycle, 2010, 9(7): 1411-1420.
[6] Traweek RS, Cope BM, Roland CL, Keung EZ, Nassif EF, Erstad DJ. Targeting the MDM2-p53 pathway in dedifferentiated liposarcoma. Front Oncol. 2022 Nov 10;12:1006959..
[7] Zhao Y, Yu H, Hu W. The regulation of MDM2 oncogene and its impact on human cancers. Acta Biochim Biophys Sin (Shanghai). 2014, 46(3):180-9.
[8] Momand J, Jung D, Wilczynski S, Niland J. The MDM2 gene amplification database. Nucleic Acids Res. 1998, 1;26(15):3453-9.
[9] Rekhi B, Karnik N, Agrawal R, Shetty O, Patkar S. Detection of MDM2 gene amplification on tissue microarray-based Fluorescence In-Situ Hybridization (FISH) in well-differentiated and dedifferentiated liposarcomas, displaying a wide morphological spectrum: a validation study at a tertiary cancer referral centre. Indian J. Pathol. Microbiol. 2022, 65(1), 65–75.
[10] Konopleva M, Martinelli G, Daver N, Papayannidis C, Wei A, Higgins B, Ott M, Mascarenhas J, Andreeff M. MDM2 inhibition: an important step forward in cancer therapy. Leukemia. 2020 Nov;34(11):2858-2874.
[11] https://clinicaltrials.gov/study/NCT04979442
[12] Ishizawa J, Nakamaru K, Seki T, et al. Predictive gene signatures determine tumor sensitivity to MDM2 inhibition. Cancer Res. 2018, 78:2721-2731, 2018.
[13] Mrinal M. Gounder et al. A First-in-Human Phase I Study of Milademetan, an MDM2 Inhibitor, in Patients With Advanced Liposarcoma, Solid Tumors, or Lymphomas. JCO . 2022, 41, 1714-1724(2023).
[14] Abdul Razak AR, Bauer S, et al. Co-Targeting of MDM2 and CDK4/6 with Siremadlin and Ribociclib for the Treatment of Patients with Well-Differentiated or Dedifferentiated Liposarcoma: Results from a Proof-of-Concept, Phase Ib Study. Clin Cancer Res. 2022,15;28(6):1087-1097.
[15] Fang DD, Tang Q, Kong Y, et al. MDM2 inhibitor APG-115 exerts potent antitumor activity and synergizes with standard-of-care agents in preclinical acute myeloid leukemia models. Cell Death Discov. 2021 May 3;7(1):90.
[16] Zhang X et al. ASCO 2020. Poster 11542.
[17] Rudolph D, et al. AACR 2018. Abstract 4868.
[18] Tolcher A et al. ASCO 2020. Abstract 390.
[19] Cornillie J, Wozniak A, Li H, et al. Anti-tumor activity of the MDM2-TP53 inhibitor BI-907828 in dedifferentiated liposarcoma patient-derived xenograft models harboring MDM2 amplification. Clin Transl Oncol. 2020 Apr;22(4):546-554.
[20] LoRusso P, Yamamoto N, Patel MR, et al. The MDM2-p53 Antagonist Brigimadlin (BI 907828) in Patients with Advanced or Metastatic Solid Tumors: Results of a Phase Ia, First-in-Human, Dose-Escalation Study. Cancer Discov. 2023 Aug 4;13(8):1802-1813.
[21] Schöffski P, et al. 2024 ESMO Sarcoma and Rare Cancers Congress. 56O.
[22] Reichardt P, et al. 2024 ESMO Sarcoma and Rare Cancers Congress. 61MO.
[23] Schöffski P, Lahmar M, Lucarelli A, Maki RG. Brightline-1: phase II/III trial of the MDM2-p53 antagonist BI 907828 versus doxorubicin in patients with advanced DDLPS. Future Oncol. 2023 Mar;19(9):621-629.
SC-CN-15149
有效期:4/1/2025
排版编辑:栗子












 苏公网安备32059002004080号
苏公网安备32059002004080号


