患者作为疾病亲身经历者,对疾病的痛苦感受和对健康产品的需求最直接也最明确。虽然当前防治疾病和维护健康的技术手段不断丰富,但人类的疾病负担并未减少,患者的健康需求并未充分满足。因此,“以患者为中心药物研发”势在必行。通过多渠道全面收集患者的诉求,并将收集的信息纳入药物研发全过程,有助于确保患者的体验、观点、需求和优先事项被关注重视。本文将从相关概念、发展过程、面临的具体问题等方面对“以患者为中心药物研发”进行介绍。

随着医学的发展,人们对疾病和健康的认识不断加深,防治疾病和维护健康的技术手段也不断丰富,但人类的疾病负担并未减少,患者的健康需求也在日益增长。在研发健康相关产品时,既往多围绕疾病发生发展的关键病理环节,进行药物及相关产品研发。例如:降脂药、降压药、抗病毒药等,这些药物针对的是疾病相关靶标,患者的获益是间接的,他们自身的需求和感受未被充分关注。 在药物疗效评价中也很少纳入患者的诉求,虽然患者报告结局(patient-reported outcome,PRO)作为指标受到重视,但从产品研发、设计到实施的全过程患者参与不足。因此,需要在健康相关产品研发之初,在获益风险评价中及研究实践过程中全方面、全过程纳入患者的需求。
以患者为中心药物研发(patient-focused drug development,PFDD)的提出背景
患者参与医药产品研发的重要性
患者作为疾病的亲身经历者,他们对疾病痛苦的感受和对健康产品的需求最直接也最明确。在过去的临床试验中,患者作为受试者仅是数据的产生源,而并未参与临床试验设计和研究决策,这可能会导致研究方向或其结果脱离医药产品研发的根本目的。而 PFDD 的提出就是为了解决既往存在的问题,在药物研发全过程重视患者意见,获得患者全过程的理解和配合,保障产品研发能最终满足患者需求。
信息化技术为患者全程参与药物研发提供便利
传统临床试验多以医院为中心,由临床试验合同研究组织(CRO) 、临床试验现场管理组织(SMO)等组织实施,随着信息技术的快速发展,临床试验信息平台得到推广应用,数据获取与利用向着数字化、智能化转变,这为患者与申办者、研究者能实时沟通提供了可能性,也为远程临床试验提供条件。美国食品药品监督管理局(FDA)发布的 PFDD 指导原则中也提到可以利用网络和社交媒体直接获取患者对疾病的关注内容。2023 年 5 月 2 日,FDA 发布“分散式临床试验(decentralized clinical trials,DCT)”指南草案,提出临床试验中部分或全部与试验相关的活动可发生在传统临床试验以外的地点。这有利于“以患者为中心”的理念在临床研究中得以实现。患者在临床试验中的地位,从被动参与者转变为重要决策者,深度参与研究的设计、实施、结果总结和发表,这不仅会增强患者参与临床试验的主动性,提高自我管理能力,也将使患者的需求进一步得到重视,体现“以人为本”的发展目标。
PFDD 概念的发展历程
国外有关 PFDD 的概念发展历程
2012 年 5 月,FDA 工作人员的公开演讲中,正式提出 PFDD,并成立了 PFDD 小组。同年 7 月, 美国发布了《美国食品药品监督管理局安全和创新法案》(food and drug administration safety and innovation act,FDASIA),提到“患者参与医疗产品讨论”。《处方药用户费用法案》也建议美国 FDA 需在获益-风险评估、患者报告结局、产品研发监管、咨询委员会、终点研发和风险沟通中加强患者参与,并呼吁 FDA 制定计划,将患者需求/观点正式纳入 FDA 的决策中。
2016 年 12 月,美国国会颁布《21世纪治疗法 案》,要求 FDA 在五年内制订一个或多个关于收集患者体验数据(patient experience data,PED)的指导原则,并说明在药物研发中如何使用此类数据和相关信息。2018 年,欧洲患者治疗创新研究院 (EUPATI)讨论并发布了关于“以患者为中心”的 独立指导文件,涵盖了整个药物研发周期中与患者使用药物相关的所有功能之间的相互作用。
2020 年 6 月起,PFDD 小组连续发布 4 项指导原则,以期为 PFDD 的数据收集、使用及在药物开发中的作用提供相关方法学指导,见表 1。

2021 年 6 月,国际人用药品注册技术协调会 (ICH)也发布文件,确定将患者观点纳入药物研发 的关键领域,从而提高药物研发的质量、效率,增强与患者需求以及疾病的关联性、安全性,为监管决策提供依据。
从 2012 年至 2023 年 6 月,FDA 已经举行了 173 场针对特定疾病的 PFDD 会议,以期更系统地获取患者对特定疾病及其治疗的观点。PFDD 会议为关键利益相关方提供了倾听患者诉求的机会。获取的信息包括但不限于患者最关注的方面、患者对治疗获益的看法以及患者希望如何参与药物研发过程。
除了 FDA 之外,欧洲药品管理局(EMA)也支持在药物研发全过程纳入患者的想法和诉求,其监管科学战略(Regulatory Science to 2025)也提出,需要确定患者参与药物开发和获益风险评估的最佳方法,包括制定设计、执行、分析和报告相关研究的标准,以及纳入 PED 并阐明这些数据如何为制定监管决策提供信息。
国内有关 PFDD 的进展
国家药品监督管理局药品审评中心(CDE)在 2022 年 8 月连续发布《以患者为中心的临床试验设计技术指导原则(征求意见稿)》、《以患者为中心的临床试验实施技术指导原则(征求意见稿)》、《以患者为中心的临床试验获益-风险评估技术指导原则(征求意见稿)》,2022 年 11 月发布 《组织患者参与药物研发的一般考虑指导原则(试 行)》,2023 年 7 月 27 日又连续发布 3 项“以患者为中心的临床试验”指导原则的试行版本,7 项文件的陆续发布表明了我国药品监管动向对 PFDD 的重视。
国内外 PFDD 概念发展历程详见图 1。

PFDD 的相关概念
PFDD
FDA 将 PFDD 定义为通过多渠道全面收集患者的诉求和建议,并将收集的信息进行规范化处理后纳入药物研发全过程,有助于确保患者的体验、观点、需求和优先事项被纳入药物研发和评估中。EMA 和 ICH 沿用了 FDA 关于 PFDD 的概念解释,但他们在推行 PFDD 的过程中侧重点有所不同,详见表 2。
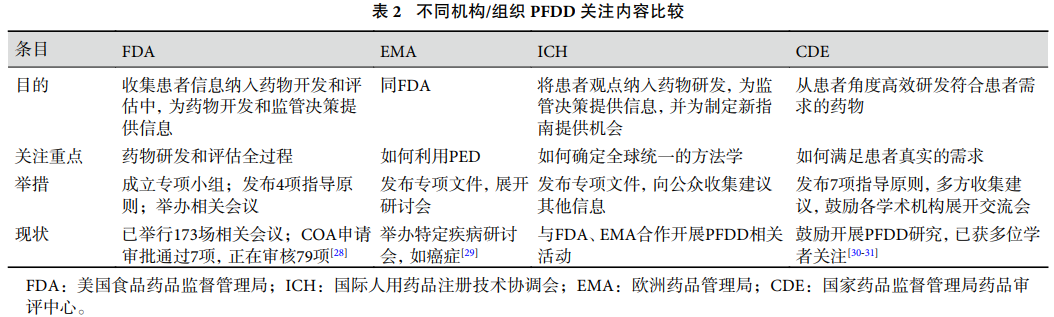 CDE 在发布的《以患者为中心的药物临床试验设计技术指导原则(试行)》文件的背景概述中指出 PFDD 是基于患者角度开展的药物开发、设计、实施和决策的过程,旨在高效研发更符合患者需求的有临床价值的药物。国内其他学者认为“以患者为中心”的基本含义是所有的药品开发应该紧密围绕患者,考虑患者的需求甚至建立“以
患者为中心”的决策体系。这与循证医学提倡的“重视患者意愿在医学决策中的作用”一致。
CDE 在发布的《以患者为中心的药物临床试验设计技术指导原则(试行)》文件的背景概述中指出 PFDD 是基于患者角度开展的药物开发、设计、实施和决策的过程,旨在高效研发更符合患者需求的有临床价值的药物。国内其他学者认为“以患者为中心”的基本含义是所有的药品开发应该紧密围绕患者,考虑患者的需求甚至建立“以
患者为中心”的决策体系。这与循证医学提倡的“重视患者意愿在医学决策中的作用”一致。
PED
FDA 发布指导原则指出,实施 PFDD 首先要收集综合且有代表性的数据,《21 世纪治疗法案》将这类“数据”命名为 PED,并将其定义为:可以由不同主体收集(包括患者、患者家属和照护人员、患者权益组织、疾病研究基金会、研究人员和药品制造商),旨在提供关于患者患有某种疾病或经历过某症状的信息(包括疾病症状、相关治疗、临床调查对身体和心理社会的影响,以及患者对疾病或病情治疗的偏好)。PED 的广泛定义拓宽了信息收集的渠道,可为医疗产品的研发提供参考信息。
临床结局评估(clinical outcome assessment, COA)
FDA 指导原则中建议的 PFDD 流程,包括:第一步,收集 PED;第二步,在庞杂的数据中识别对患者有重要意义的信息;第三步,选择或开发合适的评估工具来处理患者关注的信息。其中,合适的评估工具,即 COA,指通过临床医生、患者、其他评估人员的报告来评价患者个体感受、功能或生存状态的评估工具或手段。通常由 COA 分数(通过标准化过程生成的数值或评级值)来呈现,从而明确药品的临床效益和风险。COA 主要包括 4 种类型:PRO、临床医生报告结局(clinician -reported outcome,ClinRO)、观察者报告结局(observer-reported outcome ,ObsRO)以及功能结局 (performance outcome,PerfO)。同一研究中可以使用多种 COA,以识别、测量有重要意义的 PED。
PFDD 概念虽暂未普及,但已有少数学者开展相关研究或提交 COA 研发申请。目前在“FDA 药品开发工具资格认证网站”(CDER & CBER Drug Development Tool Qualification Project Search)上可以查询到共 86 项 COA 申请,类型以 PRO 数量最多(53 项),涉及疾病类型最多是神经学,其次是胃肠病学,86 项中有 7 项申请已提交全部文件并通 过 FDA 认证。
其中,美国学者报告了罕见疾病(rare diseases, RDs)相关研究采用 PRO 和 ObsRO 时面临的挑战 以及解决方案。他认为过去治疗 RDs 缺乏有效措施或调整措施时遇到困难很可能是因为在临床试验中较少获取患者视角,且医生对治疗 RDs 获益的理解与患者有差距。如果在医疗产品研发全过程中结合患者视角,会使治疗效果更显著、更有用、更明确。EMA 也发布了关于癌症研究中 PRO 测量的相关政策草案,内容包含 PRO 的制定、评估和分析标准,以期解决以往治疗癌症时遇到的迷惑。
目前已开展 PFDD 研究的案例大多是目前存在困惑较多、患者需求强烈的疾病。通过 PFDD 相关研究的开展,人们越来越认识到患者诉求对于了解治疗获益以及改善临床和医疗保健决策的重要性,PFDD 概念的出现在一定程度上可以给予患者及其他利益相关方一个更有意义的期待。
实施 PFDD 面临的具体问题
PFDD 研发模式并不是要推翻传统临床试验,而是要在成熟的流程基础上将患者、患者需求纳入到研究的各个环节,从而解决患者的真实需求,使患者利益最大化。然而,实施 PFDD 过程中将面临一系列具体问题,需要不断完善实施流程。
患者参与的条件
FDA 建议 PED 最好由患者直接报告,除非患者无法准确地表明其关注要点(如:幼儿或有认知障碍的患者)。使用患者直接报告 PED 前应考虑患者的认知水平、身体功能、精神状态、语言技能、计算能力、健康素养以及健康状况。
当无法直接从患者处收集数据时,也可从照护人员、患者权益组织、医生等处获得有价值的信息。然而有研究证实,在获取体征和症状的严重程度和频率等信息时,“患者报告”和“非患者报告”缺乏一致性。因此,研究启动前,定义“报告者”的标准也非常重要,需考虑:① 患者能够可靠、有效地自我报告的程度;② 哪种情况下需要多位“报告者”;③ 研究期间“报告者”可能出现怎样的变更。FDA 提示,研究中每位“报告者”都应记录在册,如有必要,还应记录不同时间点的“报告者”。
患者参与的支持平台
随着 DCT 的日趋普及,临床试验的场地变得分散,连接和吸引患者变得尤为重要。患者参与临床试验每一阶段产生的庞杂的信息以及这些信息的整合、分析、流通都要有技术设施支持。因此要建立“以患者为中心”服务理念的患者支持平台,这有助于解决传统研究在实践管理上的局限和困难,为患者提供电子知情同意、远程访视、药品直达、通知提醒等各项服务支持,提高患者参与研究的便利性,满足更多临床需求。但在平台建立及运转过程中,也存在诸如患者隐私保护和数据安全性、敏感性、完整性、真实性等方面挑战,需要申办方和研究者提前规划及应对。
COA 的科学性和公认度
准确的 COA 是临床试验成功的关键,使用科学和公认的 COA 测量工具是获得准确、可靠结果的前提。由于并不是所有被患者、照护人员和临床医生认为重要的事情都能被证明有意义或可评估,故应考虑如何选择评估项目以体现临床收益,并考虑如何识别或开发适用于开发目的的 COA 以评估对患者重要的结局。FDA 发布的《临床结局评估(COA)纲要》是促进 PFDD 的一部分,旨在通过将多种不同疾病和病症的 COA 信息进行整理和汇总,促进沟通并为药物开发人员和研究人员提供清晰透明的信息。使用 COA 于临床试验时,以 COA 纲要为参考,这是保证 COA 科学性和公认度的有效路径。但目前社会各界对 COA 的关注度并不高,且相关方法学尚不普及,这是导致相关研究基数少,通过认证比例低的主要原因。
小结
本文从提出背景、发展历程、概念等方面介绍了 PFDD 的具体内容,并进一步提出未来实施 PFDD 将面临的具体问题。“以患者为中心”的理念符合人民群众对健康生活的追求,也具有提高研究成功率、加快临床试验进程、降低研究成本的潜在巨大价值。在未来的药物研发中,提示研究人员进一步以患者需求为出发点,视患者为主动参与者,以临床价值为最终目的进行研究。
吴晓蕾, 史梦龙, 张晨瑶, 马毓聪, 杜亮, 刘炳林, 曹璐佳, 张俊华. 以患者为中心药物研发相关概念介绍. 中国循证医学杂志, 2023, 23(12): 1472-1477. doi: 10.7507/1672-2531.202307066.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


