过去8年,细胞周期依赖性激酶(CDK)4/6抑制剂在乳腺癌治疗中取得了里程碑式进展,改变了激素受体阳性HER2阴性(HR+/HER2-)乳腺癌的治疗格局,目前CDK4/6抑制剂联合疗法已成为晚期HR+乳腺癌标准治疗方法。《Nature Reviews Clinical Oncology》杂志(影响因子:78)近期发表了由乳腺癌研究和治疗领域的关键人物Nicholas C. Turner教授主导的一篇综述,对这一领域进行了全面总结[1]。【肿瘤资讯】对该综述主要内容予以整理,以飨读者。本篇(上)主要全面回顾三种CDK4/6抑制剂,介绍其在乳腺癌中的应用(HR阳性、HER2阳性、以及三阴性),其毒性特征差异,总结了III期试验的最新数据,包括总生存期(OS),并讨论了不同药物间研究结果差异的可能原因。

回顾CDK4/6抑制剂
细胞周期的失调和异常增殖是癌症的关键特征之一,抑制快速细胞分裂成为抗癌治疗的核心策略。细胞周期的进程受到一系列严格检查点和步骤的控制,细胞必须按顺序通过这些检查点才能完成分裂。在这一过程中,细胞周期蛋白依赖性激酶(CDK)扮演了至关重要的角色。CDK通过与细胞周期蛋白的互作被激活,进而调控细胞周期的关键过渡阶段。
CDK长期以来一直是抗癌药物研究的重要靶点。但在早期实验中,针对CDK的广谱抑制剂因其严重的毒性而导致终止研究。在小鼠模型中发现,CDK1基因的敲除会导致胚胎死亡,因此一些严重的毒性反应被认为与CDK1的抑制有关。因此,开发既安全又有效的CDK抑制剂,关键在于选择性抑制CDK同工酶。
目前,在国内已获批上市的CDK4/6抑制剂哌柏西利、阿贝西利、瑞波西利和达尔西利均选择性抑制CDK4/6。其中,哌柏西利是全球首个CDK4/6抑制剂,于2013年获得FDA突破性疗法认定;达尔西利为中国首个自主研发的新型高选择性CDK4/6抑制剂。CDK4和CDK6这两种激酶在结构和功能上存在相似之处。它们的主要作用是通过磷酸化细胞周期抑制蛋白——视网膜母细胞瘤蛋白1(RB1),来调控细胞通过有丝分裂中G1阶段的检查点。在小鼠模型中,单独敲除CDK4或CDK6并不致命,这表明CDK4和CDK6之间存在功能性补偿。然而,同时敲除CDK4和CDK6则会导致严重的贫血症状。在未磷酸化状态下,RB1通过与E2F转录因子家族的结合,抑制细胞周期进程的基因的转录。依赖CDK4/6的细胞在G0和早期G1阶段通常表现出D型细胞周期蛋白(细胞周期蛋白D1至D3)的低水平表达。随着D型细胞周期蛋白水平的上升,由此产生的细胞周期蛋白D-CDK4/6复合物对RB1(轻度磷酸化)以及RB口袋蛋白p130和p107进行部分磷酸化。RB1的磷酸化降低了其与E2F的亲和力,并减弱了其对E2F功能的抑制,从而解除了对细胞周期进展的抑制。在这一过程中,细胞周期蛋白E的表达被不断激活,与CDK2形成的复合物可进一步磷酸化RB1,形成正反馈,启动向有丝分裂S期的转录。(图1) 单细胞追踪实验数据表明,细胞在完成有丝分裂后立即表达的CDK2水平,是决定细胞是进入静止状态(表现为低CDK2活性)还是直接继续进行细胞周期(表现为高CDK2活性)的关键因素。具有高CDK2活性的“新生”细胞可能在增殖过程中不依赖于CDK4/6,这解释了某些肿瘤细胞对CDK4/6抑制剂不敏感的原因。
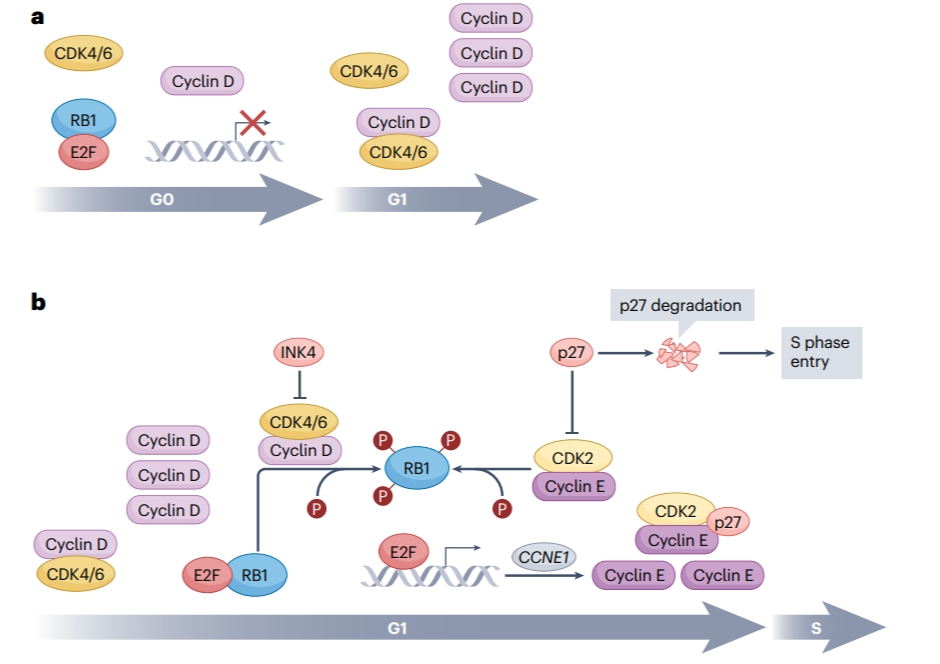
图1 CDK4/6抑制剂作用机制
成功抑制CDK4/6信号通路的关键在于:一是保持细胞周期蛋白D-CDK4/6-RB1轴的完整性;二是特定细胞类型对CDK4/6的依赖性。在雌激素受体(ER+)乳腺癌患者中,细胞周期蛋白D1通常高度表达,约13%的原发性乳腺癌过度表达,与CCND1基因的扩增有关。此外,ER直接调控CCND1的表达,即使在没有CCND1基因扩增的情况下,也可能出现细胞周期蛋白D1的高水平表达。研究表明,细胞周期蛋白D还能以激素非依赖性方式直接促进ER的活化。这些因素共同说明ER+乳腺癌细胞在细胞周期进展中特别依赖CDK4/6。同时,RB1蛋白的完整性对于CDK4/6信号也至关重要,而RB1的失活可能与CDK4/6抑制剂耐药性有关。
哌柏西利对CDK4和CDK6亲和力相似,瑞波西利和阿贝西利是更强的CDK4抑制剂。阿贝西利独特之处在于它还可抑制CDK2等激酶。这些药物对CDK4/6亲和力的差异可能导致不同的毒性特性。在乳腺癌和骨髓祖细胞中,针对CDK4或CDK6的主导作用分别解释了CDK4/6抑制剂的效果或中性粒细胞减少症的发生。
阿贝西利对CDK2的弱抑制可能导致其不同的活性,表现为对哌柏西利抗药性细胞的敏感性。此外,不同于其他CDK4/6抑制,阿贝西利能更有效穿过血脑屏障。其代谢特点要求需每天两次给药。
CDK4/6抑制剂在乳腺癌中的应用
HR+/HER2-晚期乳腺癌
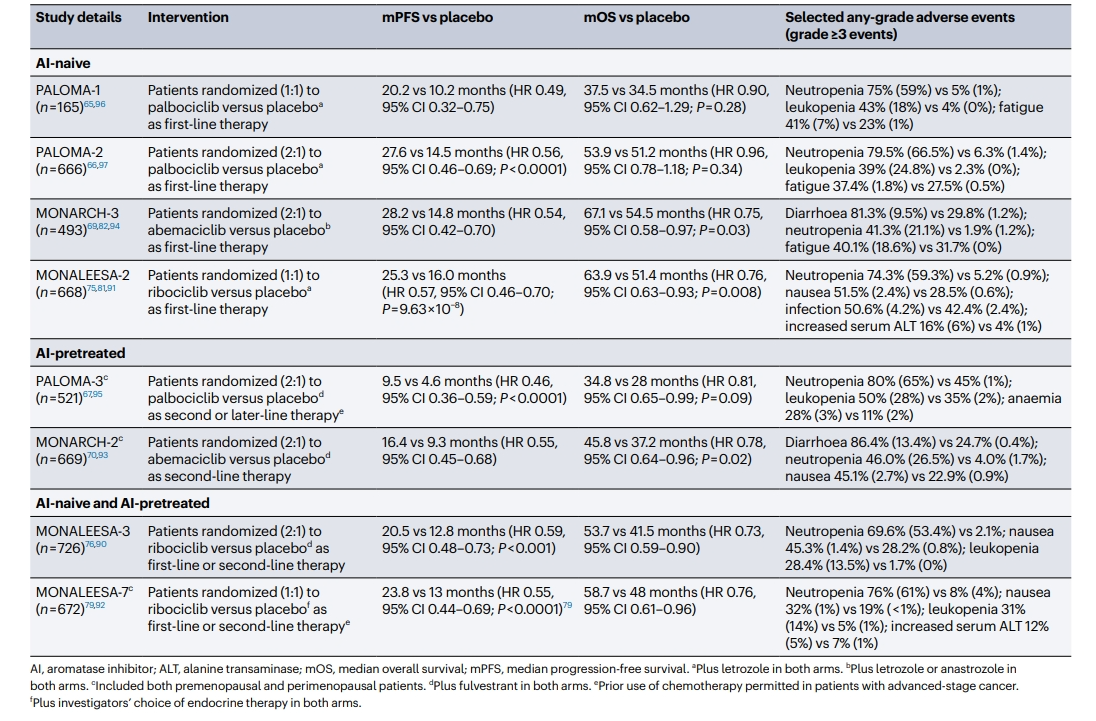
随着阿贝西利的MONARCH 3研究在2023年SABCS公布了其最终总生存期(OS)结果,三种CDK4/6抑制剂(哌柏西利、瑞波西利、阿贝西利)被批准与内分泌治疗联用治疗晚期HR+ HER2-乳腺癌一线/二线的研究OS数据相继成熟。这三种药物在无进展生存期(PFS)上表现出一致性(表1),且哌柏西利和阿贝西利已被FDA批准用于男性乳腺癌患者。
表1:CDK4/6抑制剂在晚期HR+/ER2-乳腺癌患者的研究
当前CDK4/6抑制剂的使用情况:Right Choice与Right Time?
与PFS数据不同,OS数据在三种药物间并不一致(表1)。对于瑞波西利,长期随访显示了与氟维司群或来曲唑联合使用时,OS有显著改善(MONALEESA-3、MONALEESA-2试验)。在MONALEESA-7试验的绝经前/围绝经期患者中也观察到类似改善。阿贝西利在MONARCH-2试验中与氟维司群联合使用时,OS有显著改善,而在MONARCH-3试验中与来曲唑联合使用时,OS改善虽有数值上提升,但尚未达到统计学显著。相比之下,哌柏西利与氟维司群联合使用在PALOMA-3试验中只显示数值上的OS改善,而在PALOMA-1和PALOMA-2试验中与来曲唑联合使用时并未明显改善OS。同时,可以看见不同试验中OS结果与PFS不总是一致,可能有多种解释。
对于联合氟维司群的研究,OS结果的差异最可能源于研究设计。PALOMA-3试验中超过50%的患者既往接受过两线及以上的治疗,33%接受过晚期化疗,这限制了氟维司群对照组的效果和中位PFS的绝对改善(6.8个月)。MONARCH-2试验允许患者既往接受过一线内分泌治疗,其中位PFS改善为8.5个月,而MONALEESA-3主要招募辅助内分泌治疗后复发的患者,PFS改善最大(12.2个月)。其OS结果与PFS改善相符,MONALEESA-3显示最大OS获益,PALOMA-3最低。潜在的结论是,从联合氟维司群的试验中可以看出,CDK4/6抑制剂应主要在一线治疗中使用,在这种情况下,这些药物提供了最大程度的绝对益处,并且这最终转化为最实质性的OS改善。
而在CDK4/6抑制剂联合来曲唑的研究中,存在两种不同的解释。
首先,这些研究的设计在统计上没有足够的力量来检测到OS的显著改善,这限制了统计效能,增加了任何发现仅凭偶然出现的风险,即使真正对OS的影响相同。PALOMA-2试验中27%患者病情进展后转用CDK4/6抑制剂,哌柏西利组和安慰剂组分别有13%和21%的患者缺乏OS数据,可能导致偏倚,统计效能进一步降低。通过高度一致的中位PFS结果可以支持这一观点,即哌柏西利未见中位OS改善的最可能的解释。
另一种可能的解释是,不同药物之间可能存在真正的疗效差异,哌柏西利可能不如瑞波西利或阿贝西利有效,这一差异体现在OS方面,而非PFS。临床前数据表明,阿贝西利和瑞波西利对 CDK4的选择性抑制相比都是比CDK6更强[2,3],而CDK6的抑制导致更多骨髓相关不良事件[4],因此可能潜在的限制哌柏西利的耐受性,同时为这一观点提供了支持。
基于前述研究,CDK4/6抑制剂现在被推荐作为大多数晚期HR+HER2-乳腺癌患者的一线治疗方法。然而,部分患者仍不建议使用CDK4/6抑制剂,包括早期器官功能衰竭和/或其他合并症,如肝功能不佳。对于存在早期器官功能衰竭的患者,通常是侵袭性疾病导致的内脏危象、器官浸润和疾病迅速进展,标准治疗方法是首先进行化疗,然后通过内分泌治疗和CDK4/6抑制剂维持治疗。然而,根据2023年3月II期RIGHT Choice试验的会议摘要,瑞波西利联合内分泌疗法在这种情况下可能比化疗更有效。
通常使用芳香化酶抑制剂作为CDK4/6抑制剂的伴随内分泌治疗。如果患者在辅助治疗中疾病进展或在停药后的12个月内出现疾病进展,可以选择氟维司群。患者的年龄和绝经状态不应影响治疗决策。
医生在选择CDK4/6抑制剂时可能会出于个人偏好,同时也需要考虑三种已批准的药物之间的差异,以便将治疗方案与患者的自身基础如并发症和治疗副反应相匹配。虽然长期以来哌柏西利一直是许多医生的首选,但随着OS数据的发布,已经看到了向其他CDK4/6抑制剂的转变的趋势。
HR+/HER2-早期乳腺癌
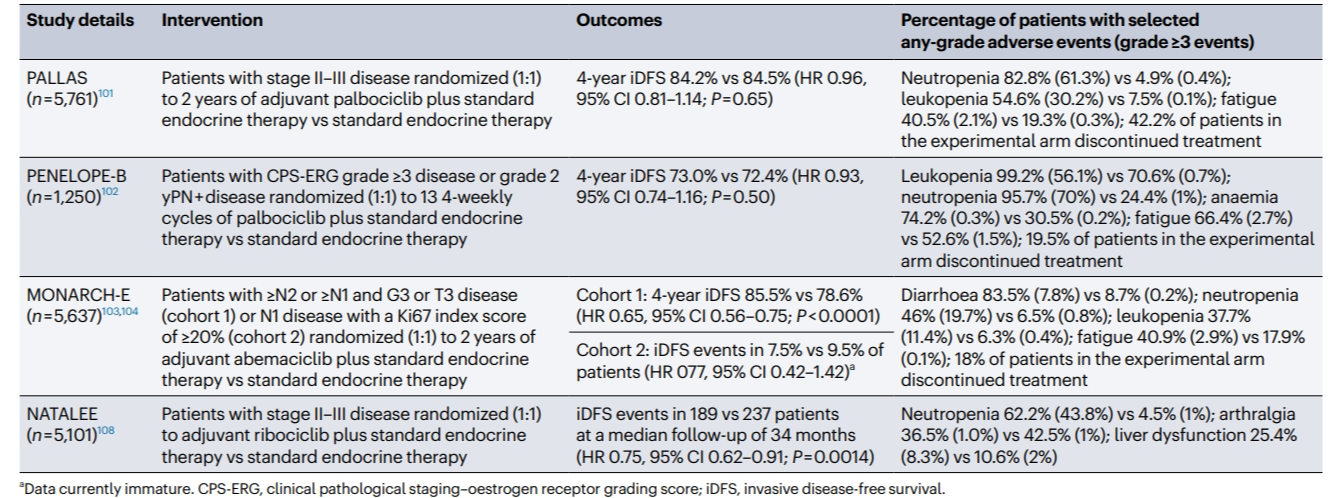
绝大部分患者初诊时处于早期阶段(I-III期)时,可接受潜在的根治性治疗,包括手术,并可能伴随新辅助和/或辅助化疗以及/或放疗。通常持续5到10年的内分泌治疗已经降低了复发率,但仍有相当一部分患者会经历局部或远处复发。已有多项大型试验评估了CDK4/6抑制剂在绝经前和绝经后妇女的辅助治疗中延长无复发生存期(recurrence-free survival)的潜力(表2)。与晚期患者的试验结果相比,HR+/HER2-早期患者中的疗效似乎存在明显差异。
表2 HR+/HER2-乳腺癌患者中CDK4/6抑制剂作为辅助治疗的研究
辅助治疗结果不同的可能原因
鉴于在晚期患者中三种CDK4/6抑制剂的III期研究的主要终点PFS获益大体一致,在早期人群中的PALLAS和MONARCH-E试验的所得不同结果令人意外,但有几个原因可以解释:
MONARCH-E试验招募了更高风险的患者,其更有利的结果可能反映了一个事实:更高风险的患者从辅助治疗中获益更大,类似于在APHINITY试验中观察到的HER2+患者。然而,对PALLAS试验数据的亚组分析并未显示高风险患者有更大的益处。
PENELOPE-B试验同样招募了比PALLAS更高风险的患者,然而只进行了1年的哌柏西利辅助治疗,更长的治疗时间可能会带来不同的结果。
在PALLAS试验中,患者的依从性相对较差,有42%的患者在计划的2年哌柏西利治疗结束前就中断了治疗,而在MONARCH-E试验中这一比例更低(18%),这可能反映了在更高风险的人群中更能耐受毒性。
药物活性的差异可能是PALLAS、MONARCH-E和PENELOPE-B三项试验结果不同的最合理解释。阿贝西利在接受过多线治疗且内分泌治疗不敏感的患者中,单药治疗的应答率高于哌柏西利或瑞波西利。这可能是因为阿贝西利能抑制更广泛的激酶,包括CDK2,或许解释了其增加的单药活性。然而,目前不宜直接比较MONARCH-E和NATALEE试验的结果,因为NATALEE试验的随访时间有限。
其他亚型乳腺癌
在HR+/HER2-乳腺癌患者中CDK4/6抑制剂的积极数据激发了在其他亚型中的探索。尽管三阴性乳腺癌(TNBC)由于周期蛋白E1的异常表达和RB1的变化而被认为对CDK4/6抑制剂有抵抗性,但TNBC的基因表达模式分类揭示了一个表达雄激素受体(AR)的Luminal雄激素受体(LAR)亚型。这种亚型的细胞系和小鼠异种移植模型已显示出对哌柏西利的反应。目前正在进行一项I期试验(NCT04360941),探索在AR+ TNBC患者中将哌柏西利与抗PD-1单抗Avelumab联合使用的效果。
HER2阳性乳腺癌通常是Luminal型,已知携带ERBB2驱动基因的小鼠模型对CDK4/6抑制剂敏感。临床前研究表明,CDK4/6抑制剂可能有助于克服对HER2靶向治疗的耐药性,但临床证据仍待确认。在NA-PHER新辅助治疗试验中,正在研究曲妥珠单抗和帕妥珠单抗联合哌柏西利治疗HER2阳性乳腺癌的组合。目前的数据显示,这种组合显著降低了Ki67指数(基线几何平均值31.9vs手术时的12.1;P = 0.013),并展现了有希望的病理完全缓解率(pCR)(27%)。此外,该组合似乎是可耐受的,并可能为HER2阳性乳腺癌患者提供去化疗选择, 因为它与在NeoSphere试验中化疗的总缓解率(ORR)相似。在晚期阶段,有三项临床试验正在研究CDK4/6抑制剂与抗HER2靶向治疗和内分泌治疗的组合。PATINA III期试验(NCT02947685)旨在确定在诱导化疗后,将哌柏西利添加到以曲妥珠单抗或帕妥珠单抗联合内分泌治疗为基础的维持治疗中的效果。该研究预计将于2026年完成。
II期PATRICIA试验(NCT02448420)正在评估多线治疗后的HER2阳性乳腺癌患者中哌柏西利伴或不伴来曲唑与曲妥珠单抗联合使用的效果,这些患者既往已接受两线及以上治疗。初步数据表明,接受三联疗法的患者PFS更长。另外,MONARCH-HER试验在晚期HR+/HER2+乳腺癌的患者中探索了阿贝西利联合氟维司群和曲妥珠单抗的组合。受试者随机分配至阿贝西利加氟维司群和曲妥珠单抗(A组),阿贝西利加曲妥珠单抗(B组)或标准化疗加曲妥珠单抗(C组)。该研究达到主要终点,显示A组与C组之间的PFS差异(8.3vs 5.7个月)。尽管A组的中位OS数值上更长(31.1个月vs 20.7个月),但未达到统计学意义(HR 0.75, 95% CI 0.47–1.21; P = 0.24),可能反映了统计效能不足。这一队列的随访目前正在进行中。这些研究可能为晚期HER2阳性患者提供无化疗的治疗选择。
CDK4/6抑制剂的毒性差异
三种CDK4/6抑制剂(哌柏西利、瑞波西利、阿贝西利)在毒性特征上存在重要差异。在I期试验中,哌柏西利和瑞波西利主要的剂量限制性毒性(DLT)是中性粒细胞减少,而瑞波西利还引起QTc间期延长等其他DLT。阿贝西利的主要DLT是腹泻和疲劳。
III期试验数据显示,哌柏西利和瑞波西利最常见的毒性是中性粒细胞减少(PALOMA-2试验中66.5%的患者出现3-4级事件,安慰剂组为1.4%;MONALEESA-2试验中为60% vs4%),而发热性中性粒细胞减少的发生率很低(哌柏西利2.1%,瑞波西利 1.5%)。表明尽管循环中的中性粒细胞水平较低,但部分中性粒细胞仍保持功能。两药的其他常见毒性包括疲劳、恶心和脱发。瑞波西利与哌柏西利相比,恶心(53%vs35%)和肝功能异常(20%vs12%)的发生率更高。在MONALEESA-2试验中,3%接受瑞波西利的患者中出现QTc间期延长超过60ms,而来曲唑组仅有一位患者(0.3%)。这些患者中大多数无症状,可通过瑞波西利剂量调整进行管理。当前指南建议开始使用瑞波西利的患者前两个周期进行心电图监测,并且避免合用QT延长药物。
阿贝西利与哌柏西利和瑞波西利相比具有不同的毒性特征。在MONARCH-2和MONARCH-3试验中,接受阿贝西利治疗的患者中高达90%出现腹泻,20%需要剂量调整(停药、减量或终止治疗)。阿贝西利引起的腹泻通常在治疗初期出现,中位发病时间为7天。然而,在MONARCH-3试验的阿贝西利组中,3-4级中性粒细胞减少的发生率(24%)低于其他CDK4/6抑制剂。
阿贝西利的一个特有不良反应是血清肌酐增加,这种情况在治疗期间持续,表现为尿液中肌酐排泄减少,而肾功能未见变化,停药后可恢复正常。此外,阿贝西利还轻微增加了静脉血栓栓塞(VTE)的风险,在MONARCH-3试验中6.1%的患者发展为VTE,在真实世界中数据为7.4%。与他莫昔芬联用时,VTE风险进一步增加(4.3%vs联合芳香化酶抑制剂的1.8%)。这一增加的风险在可能接受他莫昔芬治疗的绝经前患者中尤为重要,需根据患者个别的血栓栓塞风险因素进行谨慎评估。
上市后监测研究发现,接受CDK4/6抑制剂治疗的患者比对照组有轻微增加的肺炎症或间质性肺病风险(1.6%vs0.7%)。这些事件的发展机制仍不清楚。毒性特征的差异让医生可以根据患者需求选择合适的药物。遇到问题性毒性时,转换至其他CDK4/6抑制剂通常是一个合理选择。
排版编辑:肿瘤资讯-Kelly
[1]Morrison, L., Loibl, S. & Turner, N.C. The CDK4/6 inhibitor revolution — a game-changing era for breast cancer treatment. Nat Rev Clin Oncol (2023). https://doi.org/10.1038/s41571-023-00840-4
[2] Tripathy, D., Bardia, A. & Sellers, W. R. Ribociclib (LEE011): mechanism of action and clinical impact of this selective cyclin-dependent kinase 4/6 inhibitor in various solid tumors. Clin. Cancer Res. 23, 3251–3262 (2017)
[3] Gelbert, L. M. et al. Preclinical characterization of the CDK4/6 inhibitor LY2835219:
in-vivo cell cycle-dependent/independent anti-tumor activities alone/in combination with gemcitabine. Invest. N. Drugs 32, 825–837 (2014).
[4] Maurer, B., Brandstoetter, T., Kollmann, S., Sexl, V. & Prchal-Murphy, M. Inducible deletion of CDK4 and CDK6 – deciphering CDK4/6 inhibitor efects in the hematopoietic system. Haematologica 106, 2624–2632 (2021).











 苏公网安备32059002004080号
苏公网安备32059002004080号


