世界卫生组织国际癌症研究机构(IARC)发布的2020最新全球癌症负担数据显示,乳腺癌是全球范围内女性发病率、病死率最高的恶性肿瘤[1],30%~50%的乳腺癌患者在原发肿瘤切除术后出现局部复发或远处转移[2]。其中,肝脏是继肺、骨之后第3个常见的乳腺癌远处转移部位[2],约50%的转移性乳腺癌患者会发生肝转移,肝转移亦是晚期乳腺癌患者死亡的主要原因之一[3]。如何有效防治肝转移是乳腺癌治疗的重点内容。本期特别分享一例Luminal B型乳腺癌患者肝转移的诊疗经历。该患者经手术及术后多线治疗后出现肝部转移,后采用NX方案治疗,最佳疗效达到完全缓解(CR),并为患者带来了长达3年的无进展生存期(PFS),且耐受性良好。再次进展后,临床给予CDK4/6抑制剂联合内分泌治疗,目前患者病情稳定(SD)。
病例分享专家简介
华中科技大学同济医学院附属协和医院
哈佛医学院联合培养博士生
湖北省临床肿瘤学会第一届肿瘤微环境专家委员会委员
湖北省医学生物免疫学会 (ESMI) 专家委员会委员
主持1项国家自然科学基金青年项目
以第一或通讯作者在 Hepatology、JBC 等医学杂志发表论文多篇
病例介绍
基本信息:女,60岁。
月经史:已绝经。
既往治疗史:患者于2018年6月在外院行左侧乳腺癌根治术+腋窝淋巴结清扫术,术后病理示:左侧浸润性癌(组织学分级:2级),肿块大小3*2*1.8cm,未见脉管癌栓级神经侵犯;免疫组化示:ER(+,100%),PR(-),Her2(1+),Ki67(LI:约15%);左侧腋窝淋巴结1/9转移。诊断为:Luminal B型乳腺癌 pT2N1M0。2018年7月-2018年12月,于外院行6周期EC(表柔比星+环磷酰胺)*4-T(多西他赛)*2化疗;2018年12月,因患者不能耐受副反应,停止治疗,换用阿那曲唑治疗11个月;至2019年11月,外院查MRI示:肝脏新发0.9*0.5cm结节,疗效评估:疾病进展(PD),遂换用依西美坦治疗6个月,但因疫情未返院复查,期间疗效未知,此为外院治疗经过。
现病史:患者于2020年5月因“乳腺癌首次”来我院就诊,查MRI示(图1):肝右叶近膈顶异常信号影(2.2*1.6cm),多考虑转移瘤,其余全身检查未见异常。因肝脏病灶位于膈顶,穿刺难度大,未行穿刺。
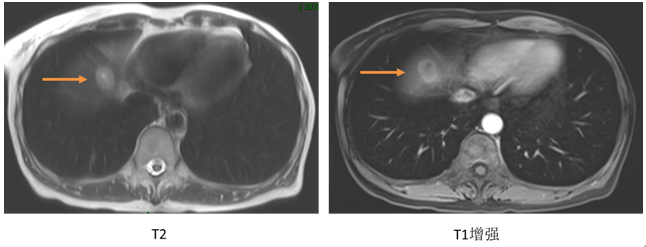
图1 MRI结果(2020.05)
临床诊断:乳腺癌IV期(肝转移)。
治疗经过:
一、NX方案治疗
2020年5月至2020年9月,予6周期NX方案治疗(长春瑞滨软胶囊+卡培他滨) 。治疗2周期时,疗效评估:部分缓解(PR);治疗4周期时,疗效评估:CR。
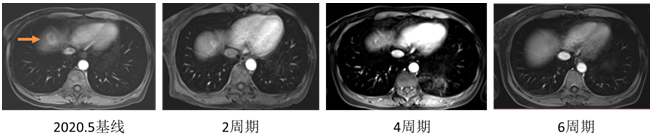
图2 MRI结果(2020.05-2020.09)
2020年10月起,继续NX方案治疗。2023年6月,复查MRI示(图3):肝脏S7段新发环形强化影(6mm),考虑转移可能。但因肝脏病灶太小无法穿刺活检。LuminalB型的乳腺癌治疗后进展(肝M)。
疗效评估:PD,PFS:3年。
二、CDK4/6抑制剂+内分泌治疗
2023年6月,开始给于阿贝西利+氟维司群治疗,疗效评估:病情稳定(SD)。
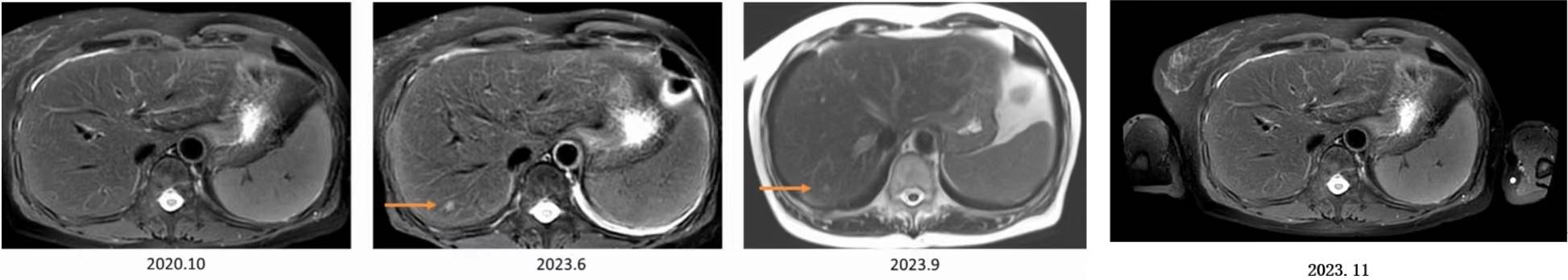
图3 MRI结果
点评专家简介
华中科技大学同济医学院附属协和医院
肿瘤中心乳腺肿瘤科主任
中华医学会肿瘤分会乳腺肿瘤学组委员
中国抗癌协会肿瘤异质性与个体化治疗专业委员会常委
中国抗癌协会肿瘤分子医学专业委员会委员
中国抗癌协会多学科MDT专业委员会委员
中国抗癌协会中西整合乳腺癌专委会常委
中国女医师协会乳腺专业委员会委员
湖北省医学生物免疫学会转化医学委员会常委
湖北省医学生物免疫学会乳腺肿瘤专委会主任委员
专家点评
Luminal型乳腺癌是最常见的乳腺癌分型,占全部乳腺癌的60%~70%[4]。相对于Luminal A型乳腺癌,Luminal B型乳腺癌具有较差的临床病理学特征,患者预后较差。本例患者初诊为Luminal B型乳腺癌,术后即接受了6周期化疗,但因不能耐受化疗的副反应而停药。对于激素受体阳性乳腺癌患者,内分泌治疗不失为一种有效的治疗手段,遂临床换用阿那曲唑进行内分泌治疗。治疗11个月后,患者病情出现进展,MRI结果显示肝部发现新发结节。与肺转移、骨转移相比,发生肝转移的乳腺癌患者预后更差,5年生存率更低[5]。若未能及时接受有效治疗,患者生存期仅约4~8个月[3]。在临床上术后辅助内分泌治疗2年后出现复发转移,或在完成辅助内分泌治疗后12个月内出现复发转移为继发性内分泌耐药。二线治疗可以考虑CDK4/6抑制剂,但当时CDK4/6抑制剂未被纳入医保,患者负担不起CDK4/6抑制剂的治疗费用。临床进行了多项内分泌治疗失败后靶向联合内分泌治疗的研究探索。ACE研究结果显示,西达本胺联合依西美坦治疗的研究者评估的PFS为7.4个月(安慰剂组的PFS为3.8个月)[6];PALOMA3研究显示,哌柏西利联合氟维司群治疗绝经前后的激素受体阳性/人表皮生长因子受体2阴性(HR+/HER2-)晚期内分泌治疗失败的患者的PFS为11.2个月(安慰剂组为4.6个月),总体人群的中位OS为34.8个月(安慰剂组为28.0个月),但既往内分泌敏感的患者中OS为39.3个月(安慰剂组为29.7个月),获益更明显[7]。而BOLERO-2研究中,入组了724例来曲唑或阿那曲唑治疗后复发或进展的绝经后HR+/HER2-晚期乳腺癌患者,并随机分入依维莫司联合依西美坦治疗组和安慰剂联合依西美坦组,研究者中心评估的PFS分别为7.8个月 vs 3.2个月,OS分别为31.0个月 vs 26.6个月[8]。可见,在来曲唑进展后换用依西美坦治疗,疗效亦不如人意。那么,内分泌治疗失败后,应该如何选择?
化疗是乳腺癌肝转移的主要手段之一。鉴于患者已进行了内分泌治疗,化疗成为此类患者的重要选择。CSCO指南指出[9],激素受体阳性晚期乳腺癌,其中有内脏转移、既往对内分泌治疗耐药或无最佳内分泌治疗选择的患者,首选解救化疗。临床综合参考患者的具体情况,如肿瘤负荷、疾病进展情况、既往治疗、患者身体状况等,合理选择化疗方案。长春瑞滨软胶囊和卡培他滨作为晚期乳腺癌常用化疗药物,在各指南中均有推荐。研究表明[10],长春瑞滨+卡培他滨的疗效与紫杉醇+卡培他滨相似,但长春瑞滨+卡培他滨较少引起中性粒细胞减少、感染、手足综合征、疲劳/虚弱和脱发,加上该方案为双口服方案,便于患者服药,是一种可以完全替代紫杉醇+卡培他滨的更具优势的治疗选择。Norbreast231研究对比了长春瑞滨与紫杉醇治疗晚期乳腺癌的疗效和安全性。结果显示,口服长春瑞滨与紫杉醇的疾病控制率(DCR)相似【75.8%(95%CI:63.6%~85.5%) vs 75.4%(95%CI:63.1%~85.2%)】[11]。一项纳入了11项随机对照研究的荟萃分析显示,晚期乳腺癌患者的一线化疗周期越长,总生存期(OS)和PFS越长[12]。而相比静脉用药,患者更愿意接受口服化疗药物,大部分患者认为口服用药对日常生活的影响更少[13],大大增加了患者的治疗依从性,使长期化疗成为可能。
长春瑞滨软胶囊和卡培他滨均为口服用药,在提高疗效及用药便捷性的同时,能够改善患者的生活质量。本例患者采用NX方案治疗2周期,疗效即达到PR,治疗4周期,疗效达到CR,再证了NX方案在肝转移乳腺癌患者中的优异疗效。2020年5月至2023年6月,NX方案为该患者带来了长达3年的PFS。可见,对于转移性乳腺癌患者而言,长春瑞滨联合卡培他滨这一高效、持久、方便的化疗方案可以成为临床治疗的优先选择。化疗失败后,基于指南推荐和药物可及性,临床继续给予CDK4/6抑制剂阿贝西利联合内分泌药物氟维司群治疗,患者病情得到了一定的控制,疗效评估为SD。我们将继续关注患者的后续病情变化,并期待能够有更多新的治疗药物、治疗方案,可以为患者带来更长的生存期及更佳的生活质量。
[1] New estimates of the global burden of cancer in2020 now published! #Globocan2020.IARC estimatesthat the cancer burden has risen to 19.3 million newcases 8 10.0 million deaths this year gco.iarc.fr/today/home
[2]赵京阳, 顾梅, 党受涛, 等. 乳腺癌肝转移诊断及治疗的研究进展[J].中国医药, 2015(10):1722.
[3]王淋, 刘莉花, 王海瑞, 等. 乳腺癌肝转移综合治疗的进展[J]. 医学综述,2021,27(13):2570-2576,2582. DOI:10.3969/j.issn.1006-2084.2021.13.013.
[4]王海, 刘西禹, 江一舟, 等. Luminal型乳腺癌的治疗难点和应对策略[J]. 中华肿瘤杂志, 2020, 42(3):192-196.
[5]宋雨航, 鲁海玲, 巩方, 等. 乳腺癌肝转移基础研究进展[J]. 中华乳腺病杂志(电子版),2019,13(5):313-317. DOI:10.3877/cma.j.issn.1674-0807.2019.05.012.
[6]Zefei Jiang, Wei Li, Xichun Hu, et al. Tucidinostat plus exemestane for postmenopausal patients with advanced, hormone receptor-positive breast cancer (ACE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019 Jun;20(6):806-815.
[7]Massimo Cristofanilli, Hope S. Rugo, Seock-Ah Im, et al. Overall Survival with Palbociclib and Fulvestrant in Women with HR+/HER2- ABC: Updated Exploratory Analyses of PALOMA-3, a Double-blind, Phase III Randomized Study. Clin Cancer Res
. 2022 Aug 15;28(16):3433-3442.
[8] M Piccart, G N Hortobagyi, M Campone, et al. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2?.[J].Annals of Oncology Official Journal of the European Society for Medical Oncology, 2014.
[9]2023CSCO乳腺癌诊疗指南
[10] Campone M , Dobrovolskaya N , Tjulandin S ,et al.A three-arm randomized phase II study of oral vinorelbine plus capecitabine versus oral vinorelbine and capecitabine in sequence versus docetaxel plus capecitabine in patients with metastatic breast cancer previously treated with anthracyclines.[J].Breast Journal, 2013, 19.DOI:10.1111/tbj.12098.
[11]Aapro M, Ruiz-Borrego M, Hegg R, et al. Randomized phase II study evaluating weekly oral vinorelbine versus weekly paclitaxel in estrogen receptor-positive, HER2-negative patients with advanced breast cancer (NorBreast-231 trial). Breast, 2019, 45: 7-14.
[12]Gennari A, Stockler M, Puntoni M, et al. Duration of chemotherapy for metastatic breast cancer: a systematic review and meta-analysis of randomized clinical trials. J Clin Oncol 2011;29(16):2144-9.
[13]Eva María Ciruelos, María Nieves Díaz, María Dolores Isla, et al. Patient preference for oral chemotherapy in the treatment of metastatic breast and lung cancer[J].European Journal of Cancer Care, 2019, 28(4).
排版编辑:肿瘤资讯-Tracy











 苏公网安备32059002004080号
苏公网安备32059002004080号


