↑关注专栏,更新不错过
35Club—《文献下午茶》,与您相约在轻松的下午茶时光中,解锁医学经典,启迪科研思路。
新的一年,文献下午茶继续陪伴各位的医学之路。
1月8-1月20日文献下午茶共更新5篇肺癌、1篇乳腺癌领域经典及最新文献解读。让我们一起来回顾都有哪些精彩内容。
特别预告:消化系统肿瘤系列即将开启!敬请期待
解读文献(来源:Int J Oncol)
综述:晚期非小细胞肺癌患者的第三代EGFR-TKI耐药机制和管理
解读嘉宾
川北医学院附属医院-曾蓓蕾博士
(第四届35under35优秀青年肿瘤医生)
观点
奥希替尼(Osimertinib)作为首个成功上市的第三代EGFR-TKI可通过C797残基与EGFR T790M或EGFR突变的ATP口袋结合抑制EGFR催化活性中心的活性,进而阻断EGFR下游的信号传导通路从而解决因EGFR T790M导致的耐药问题。基于AURA3和FLAURA研究,Osimertinib分别于2015年和2018年批准用于EGFR敏感突变局部晚期或转移性NSCLC的二线和一线治疗。目前已有多个三代EGFR-TKI上市,如伏美替尼、阿美替尼等。然而,无论是二线还是一线治疗,三代EGFR-TKIs都不可避免的出现耐药,进而限制其临床应用。第三代EGFR-TKIs的耐药机制十分复杂且存在异质性,此外,三代EGFR-TKI一线应用,和在T790M 出现后的二线应用,二者耐药机制并不完全相同。因此,耐药患者组织和液体活检的NGS测序为三代EGFR-TKIs耐药机制揭示了多种潜在途径,对于存在不同耐药机制患者,应参考目前的临床研究结果给予相应的治疗方案,以期更进一步提高患者的生存。
原文传送门
解读文献(来源:J Clin Oncol)
Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial
奥希替尼辅助治疗EGFR突变IB-IIIA期NSCLC:III期随机试验ADAURA研究最新结果
解读嘉宾
湖南省肿瘤医院-张乐蒙教授
(第一届35under35优秀青年肿瘤医生)
观点
ADAURA研究脑转移亚组数据解读
ADAURA为早期可手术切除NSCLC带来靶向辅助治疗的最强循证医学证据,IB-IIIA期EGFR敏感突变、R0切除的NSCLC患者,无论是否接受辅助化疗,奥希替尼3年的靶向辅助治疗都可以带来DFS和OS的获益。
今天解读的是2022年底发表在JCO杂志的ADAURA研究第三次公布数据,即不同亚组DFS的数据。既往解读较多关注不同临床分期,今天我们重点关注中枢神经系统,因为EGFR敏感突变术后患者更容易发生颅内转移,而且一旦发生则会严重影响患者的生活质量和预后。
ADAURA的中枢神经系统DFS数据再次证实奥希替尼的中枢神经系统疗效。奥希替尼组和安慰剂组分别有8%和14%的患者出现中枢神经系统转移。II-IIIA期患者CNSDFS的HR为0.24,整体人群CNSDFS的HR为0.36,提示3年奥希替尼术后辅助治疗对于中枢神经系统转移具有卓越的控制作用。II-IIIA期人群中位CNSDFS均未达到,48个月无中枢神经系统事件率分别为90%和75%。其中,奥希替尼组有15/18例中枢神经系统转移发生在治疗完成或停止治疗后,仅3例发生在奥希替尼用药期间。从控制颅内转移的角度,3年的辅助治疗是否足够,仍值得思考。
此外,如何筛选界定EGFR敏感突变术后中枢神经系统转移的高风险人群,MRD如何监测中枢神经系统转移,国产三代EGRF-TKI术后辅助对于中枢神经系统转移的控制作用,如何平衡生存获益、生活质量、药物经济学和不良反应等,都需要进一步研究。
原文传送门
解读文献 (来源:N Engl J Med)
Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer
新辅助纳武利尤单抗联合化疗治疗可切除NSCLC
解读嘉宾
四川省肿瘤医院-冷雪峰教授
(第二届35under35优秀青年肿瘤医生)
观点
CheckMate816是一项III期临床试验,目的是评估新辅助治疗中纳武利尤单抗联合铂类化疗与单纯铂类化疗在可手术切除的IB-IIIA期非小细胞肺癌(NSCLC)患者中的疗效。这一研究的背景是新辅助或辅助化疗对于这类肺癌患者只提供了有限的生存获益。而在前期临床试验中,基于纳武利尤单抗的新辅助治疗方案已显示出其具有前景的临床价值。该项研究结果显著,首先,纳武利尤单抗联合化疗组的患者无事件生存期(EFS)明显长于单纯化疗组。具体来说,纳武利尤单抗联合化疗组的中位EFS为31.6个月,而单纯化疗组为20.8个月。这一数据指出,纳武利尤单抗的加入明显地改善了患者的预后。其次,纳武利尤单抗联合化疗组的患者在病理完全缓解率(pCR)方面也表现得更好。这意味着,在接受了纳武利尤单抗联合化疗的患者中,有24.0%的患者手术切除的肺肿瘤和淋巴结中没有肿瘤存在,而单纯化疗组这一比例仅为2.2%。这一发现进一步确认了纳武利尤单抗在新辅助治疗中的显著疗效。此外,与单纯化疗相比,纳武利尤单抗并未增加与治疗相关的不良事件发生率。这为临床医生提供了强有力的证据和安全性保障,支持在可手术切除的NSCLC患者中使用纳武利尤单抗作为新辅助治疗。
原文传送门
解读文献 (来源:Nature Medicine)
Trastuzumab deruxtecan in metastatic breast cancer with variable HER2 expression: the phase 2 DAISY trial
T-DXd在不同HER2表达的转移性乳腺癌中的作用:2期DAISY研究
解读嘉宾
中山大学肿瘤防治中心-蒋逵葵博士
(第六届35under35优秀青年肿瘤医生)
观点
T-DXd作为倍受瞩目的明星ADC药物,已经在HER2阳性以及HER2低表达型晚期乳腺癌中证实了其疗效,但仍有部分患者疗效欠佳,且大部分患者最终依旧出现疾病进展和死亡。这就涉及到T-DXd的作用机制和耐药相关的问题,包括:HER2表达及其空间分布对药物疗效的影响;T-DXd在肿瘤中的分布;对肿瘤微环境的潜在影响以及耐药的分子机制等等。为了解决这些问题,开展了二期临床试验DAISY研究。首先,研究评估了T-DXd对不同HER2表达水平的转移性乳腺癌患者的作用,研究结果支持T-DXd在不同HER2表达转移性乳腺癌患者中的疗效与安全性。此外,研究还通过分析不同时间点肿瘤样本的生物标志物,进一步探索T-DXd的作用机制和耐药性。结果表明HER2表达是 T-DXd敏感性的决定因素,但在一小部分不表达HER2的肿瘤患者中也观察到抗肿瘤活性,这就提示了其他作用机制的存在。通过生物标志物的分析还发现T - DXd耐药可发生在不同水平,可能与HER2表达下降、DXd细胞毒作用的改变和肿瘤微环境的变化有关,这提示我们有必要应用基于分子分析的精准医学方法来优化T - DXd耐药后的治疗策略。可以说DAISY研究为探索T-DXd的作用和耐药机制给出了重要线索与启示,但尚不足以明确其相关性。未来还需要更多研究进行深入探讨以阐明T-DXd的作用和耐药机制,从而进一步改善目前的治疗现状。
原文传送门
https://www.liangyihui.net/doc/121595
解读文献(来源:Lancet )
Stereotactic ablative radiotherapy with or without immunotherapy for early-stage or isolated lung parenchymal recurrent node-negative non-small-cell lung cancer: an open-label, randomised, phase 2 trial.
一项开放标签、随机、2期试验:立体定向消融放疗伴或不伴免疫治疗早期或孤立性肺实质复发性淋巴结阴性非小细胞肺癌
解读嘉宾
湖北省肿瘤医院-马佳博士
(第六届35under35优秀青年肿瘤医生)
观点
尽管立体定向消融放疗是早期NSCLC不可手术治疗的标准替代疗法,但5年SABR的复发或者转移率仍有42%,主要的失败区域为放疗区域外,提示我们全身治疗仍是必要的。消融放疗通过促进肿瘤释放相关的抗原,增加PD-L1的表达,可使肿瘤转化成所谓的原位癌症特异性疫苗,更好地激活肿瘤T淋巴细胞向肿瘤导向,从而增加局部治疗效果以及杀灭远处微转移灶,这是放疗联合免疫治疗的理论基础。因此,研究者设计这个2期随机、开放标签临床试验是为了对比SABR和SABR联合免疫治疗(I-SABR)的4年无事件生存率。来自美国德州三家医院的IA-IIB期或淋巴结阴性肺肿瘤复发的NSCLC患者1:1随机接受了SABR治疗(剂量:50Gy/4F或者中央型肺癌为70Gy/10F),或SABR联合nivolumab治疗(480mg,每4周一次共4个周期,首次用药在放疗当天或放疗36h以内)。结果表明,SABR组和I-SABR组4年的无事件生存率分别为53%和77%,HR值为0.38,具有统计学差异。事后亚组分析显示,肿瘤大小小于等于2cm、年龄72岁及以下、男性、PS评分0-1分,初治肺癌为无事件生存率延长的有利因素。安全性方面,I-SABR组安全性良好,没有发生3级以上的不良反应,包括肺炎,且都能恢复。这项研究提示I-SABR相较于SABR有望成为早期或肺肿瘤复发NSCLC患者更有效的治疗策略。
原文传送门
解读文献(来源:J Clin Oncol)
A Phase 3, Randomized study of atezolizumab plus bevacizumab and chemotherapy in patients with EGFR or ALK mutated in non-small cell lung cancer (ATTLAS, KCSG-LU19-04)
3 期随机ATLAS,KCSG-LU19-04研究:阿替利珠单抗+贝伐珠单抗+化疗治疗EGFR或ALK突变NSCLC
解读嘉宾
南京市第二医院-朱传东教授
(第二届35under35优秀青年肿瘤医生)
观点
EGFR敏感突变的非小细胞肺癌TKI耐药后的治疗手段一直十分有限。2017年ESMO会议首次报道的IMPower150研究在EGFR突变人群的用药上给了我们很大的提示。此项研究是一项多中心、开放标签的随机对照Ⅲ期临床试验,评估阿替利珠单抗+卡铂+紫杉醇联合或不联合贝伐珠单抗在未接受过化疗的Ⅳ期非鳞非小细胞肺癌(NSCLC)中的疗效及安全性。1202例患者按1:1:1的比例随机分为阿替利珠单抗+卡铂+紫杉醇组(A组,ACP)、阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇组(B组,ABCP)和贝伐珠单抗+卡铂+紫杉醇(C组,对照组,BCP)。该研究入组的患者是IV期初治复发转移性非鳞NSCLC,由于亚裔人群当中非鳞NSCLC患者的EGFR突变率人群占比很大,50%左右,所以IMPower150研究在设计之初就没有排除EGFR与ALK突变患者。众所周知,EGFR阳性人群由于生物学特性不同,强驱动性的癌基因导致免疫抑制激活的通路多、同时在免疫微环境中存在较多抑制信号,因此被认为是“免疫豁免”的人群,并且在既往众多的免疫单药临床试验中总体治疗效果不佳。IMpower150研究入组了124例经靶向治疗失败的非鳞NSCLC患者。该研究结果显示,EGFR敏感突变亚组患者(含少量ALK阳性患者)在PFS和OS的结果均赢得非常漂亮,四药方案阿替利珠单抗的加入显著提高了患者的PFS:8.3m vs 6.8m(HR值0.617,p<0.0001)。同时我们从森林图可以看到突变患者呈现出相较于贝伐+化疗,四药方案突变患者获益更多(mPFS:9.7m vs 6.1m),在OS上,B组较C组延长EGFR+亚组的OS高达11.3个月(29.4 vs 18.1 个月,HR=0.60 ;95%CI:0.31-1.14),甚至比整体人群的结果还要好。
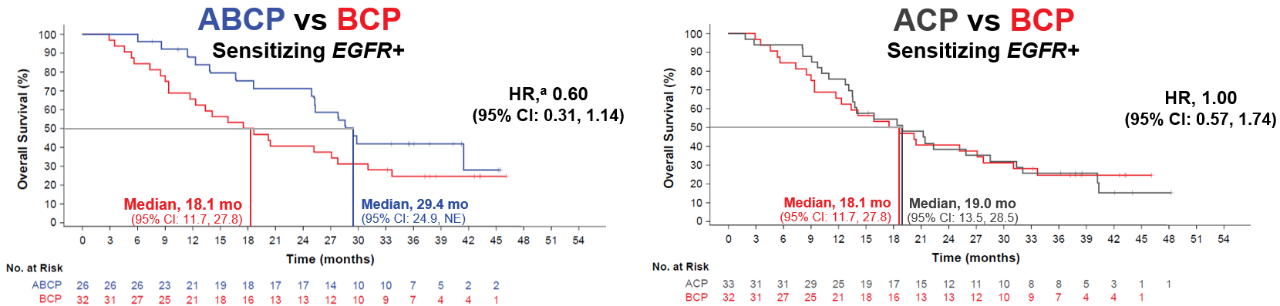
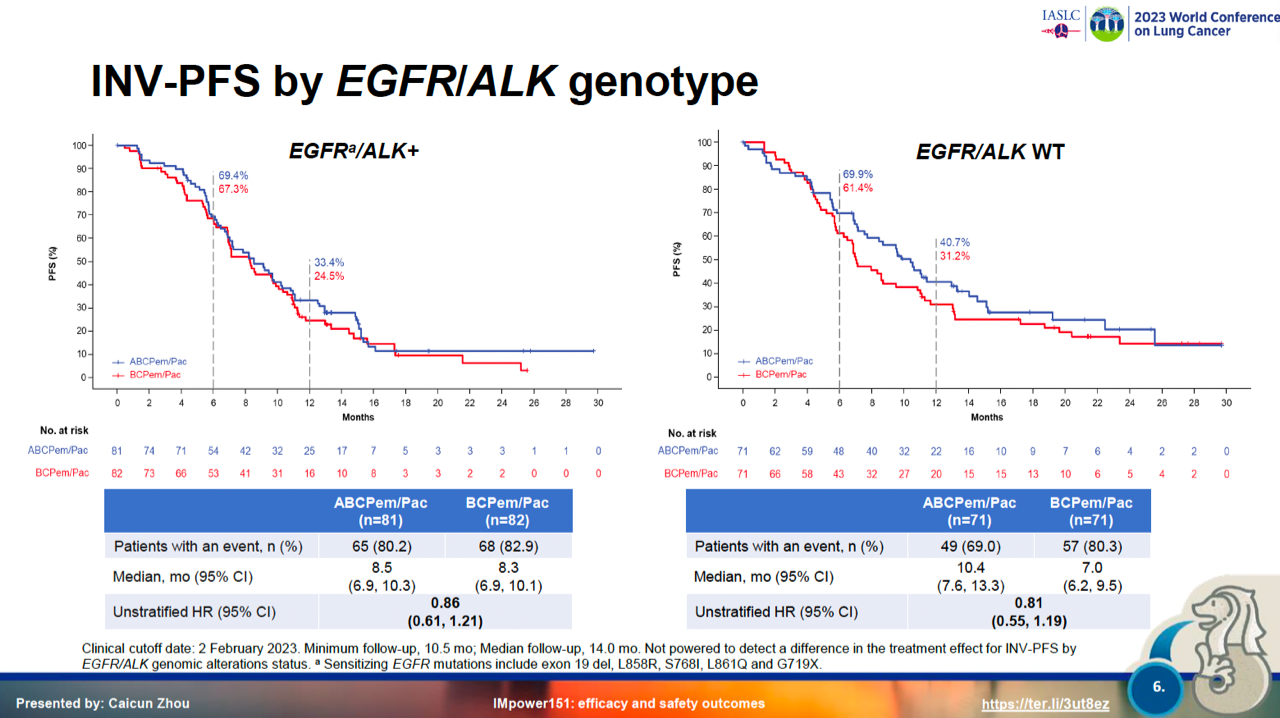
基于IMpower150研究结果,ABCP四药联合方案在多个国家或地区获批用于转移性非鳞NSCLC的一线治疗,可伴有或不伴有EGFR或ALK基因改变。同时也提出了一个新的探索方向:驱动基因阳性靶向治疗耐药人群能否从免疫治疗中获益?2020年,为了明确患者基因组构成(如:EGFR突变率)和临床实践(如:培美曲塞的使用)存在的地区差异,在中国进行了III期IMpower151 研究,评估阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇或培美曲塞(ABCP)与BCP作为转移性非鳞NSCLC一线治疗的有效性和安全性。研究纳入既往未接受过化疗的转移性非鳞NSCLC患者,按1:1随机分组,接受ABCP或BCP治疗,直到不可接受的毒性或疾病进展。分层因素包括:EGFR或ALK基因型(野生型 vs. 突变型,野生型患者占全人群的上限为50%),结果显示在EGFR或ALK阳性亚组,两组间的PFS相似,ABCP vs. BCP的中位INV-PFS分别为8.5个月和8.3个月(HR=0.86,95%CI:0.61-1.21),IMpower151并没有复制出IMpower150的阳性结果。但从驱动基因阴性两组人群的PFS分别为10.4 和7.0个月来看,说明驱动基因阳性人群相比阴性人群更能从不含PDL1单抗的联合治疗中获益,反之,驱动基因阴性人群相比阳性人群更能从含PDL1单抗的联合治疗中获益。基于此,作为驱动基因阳性人群占比达50%的IMPOWER 151研究自然会是一个阴性结果,而驱动基因阳性人群占比10%左右的IMPOWER 150研究是一个阳性结果就不难理解了。此项首次证明驱动基因阳性获得性耐药的晚期NSCLC采用贝伐单抗联合化疗的三药方案就能取得与PDL1单抗联合贝伐单抗及化疗四药方案同等的PFS疗效。
ATTLAS研究在IMpower150和IMpower151的基础上,进一步验证当初IMpower150研究留下的悬念,招募了228名携带有EGFR突变或ALK易位的患者,其中EGFR突变患者占比95.5%。结果显示ATTLAS研究达到了主要终点,中位随访时间为26.1个月,ABCP组中位PFS为8.48个月(95%CI,8.18-10.28),相较于PC组显著延长(P=0.004),疾病进展的风险比(HR)为0.62(95%CI,0.45-0.86)。ABCP组较 PC组的1年PFS率与2年PFS率分别为36%vs 23%(P=0.012)及13% vs 9%(P=0.006),ORR率也有明显的提高 (69.5% vs 41.9%),意味着更多的患者能够达到缓解。ATTLAS研究结果证实了IMpower150研究亚组分析中初步数据的结果。
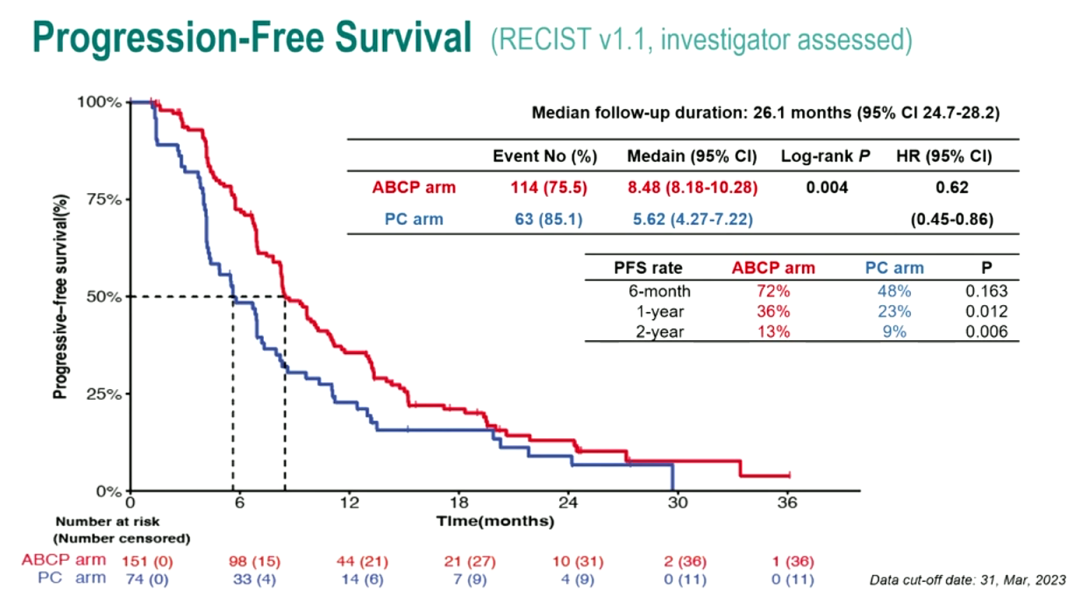
因此ATTLAS研究是第一个证明ABCP四联方案相比化疗有更多获益的前瞻性试验。从ATTLAS研究的PFS亚组分析我们还可以看到: L858R(HR0.52)获益高于19Del (HR0.69);未吸烟者,存在脑转移的患者,1代/2代 TKI经治,无T790M突变,以及PD-L1≥1%的患者获益更多,整体来看ATTLAS仍有很多数据比如作为金标准的OS还未公布详细亚组数据。
IMpower 150所催生出的相关研究已经阶段性的划上了一个句号,但肿瘤治疗新模式的探索从未停止。免疫+血管靶向模式既是突破各自治疗瓶颈,最大程度实现“双赢”;同时,作为Chemo-free时代的宠儿,这一模式的“成功”再次显示改变或调整肿瘤微环境对于控制肿瘤发展、提高肿瘤治愈率的特别意义。那么对于EGFR耐药后治疗如何迎来新突破呢?4代EGFR TKI已经在做早期研究,EGFR/cMET双特异性抗体、TROP2 ADC在EGFR突变患者中展示了不错的前景。但就现阶段而言,免疫联合抗血管与化疗的模式仍是EGFR突变患者耐药后的首要选择之一。
原文传送门
诚邀35under35青年医生报名
↓请添加35under35班长微信↓

*目前已开放肺癌、乳腺癌、消化系统肿瘤领域,后续将陆续开放其他瘤种
在这个《文献下午茶》的共享时光里,我们期待您的参与和分享。让我们一起在品茗文献的同时,领略医学的魅力,感受学术的快乐。我们相信,每一次的解读和讨论,都将是一次领域知识的盛宴,也是一次专业思维的碰撞。











 苏公网安备32059002004080号
苏公网安备32059002004080号


