乳腺癌作为抗体药物偶联物(ADC)研发的主战场,众多ADC药物已经取得了令人瞩目的成绩,为患者带来了进一步改善生存的希望和曙光。随着ADC药物的广泛应用,不良反应管理也成为了临床医生的“必修课”。眼毒性是乳腺癌ADC药物治疗中的常见不良反应之一。在2023年欧洲肿瘤内科学会(ESMO)大会上,HER2 ADC药物DP303c治疗晚期实体瘤(大部分为乳腺癌)的研究中,眼毒性的高发生率引发了广泛的关注和讨论。此外,恩美曲妥珠单抗(T-DM1)、德曲妥珠单抗(T-DXd)、Datopotamab deruxtecan(Dato-DXd)等多种ADC均可导致眼毒性的发生。因此,在临床实践中,临床医生需加强对ADC眼毒性重视并采取科学的管理措施,以确保患者的安全和治疗效果。【肿瘤资讯】特邀重庆医科大学附属第一医院甘露教授就ADC相关眼毒性管理进行分享。
医学博士、主任医师、副教授、硕士研究生导师
中国抗癌协会乳腺癌专业委员会 常委
中国抗癌协会肿瘤临床研究管理学专委会 常委
中国抗癌协会肿瘤科普防治专业委员会 委员
中国抗癌协会肿瘤临床化疗专业委员会 委员
重庆市抗癌协会肿瘤心理学专业委员会 副主任委员
重庆市医学会乳腺病分会 常委
重庆市肿瘤医疗质量控制中心乳腺癌诊疗专家组 成员
不可小觑:多款ADC药物眼毒性获FDA黑框警告
ADC是将单克隆抗体与细胞毒性药物通过连接子偶联而成的靶向治疗药物,被誉为肿瘤治疗领域的“魔法子弹”。作为一种新型的生物制剂,ADC药物已经在多癌种领域展现出巨大的临床价值。然而,由于连接子稳定性、靶标特异性、载荷传递等方面的局限性,ADC药物研发面临诸多挑战。目前已有多款ADC药物因安全性问题而停止临床研究,或被美国FDA予以黑框警告。
2023 ESMO大会报道了DP303c用于既往经治HER2阳性晚期实体瘤的首次人体I期研究结果,其中眼毒性的高发生率备受关注[1]。DP303c由人源化抗HER2抗体、可裂解连接子和载药MMAE偶联组成。这项多中心、开放标签、剂量递增和扩展研究共纳入94例HER2阳性晚期实体瘤患者,大部分(68例,72.3%)为乳腺癌患者,在剂量递增阶段给予不同剂量的DP303c治疗,并确定剂量扩展阶段的剂量为3mg/kg。如图1所示,剂量为3mg/kg时,DP303c治疗相关角膜疾病、干眼症和视力模糊的发生率均较高。在随后的迷你口头摘要讨论环节中,法国波尔多大学Hervé Bonnefoi教授表示,DP303c(3mg/kg)治疗的3级视力模糊、干眼症和角膜疾病的发生率分别达18%、8%和2%,对患者的日常生活造成影响,并指出“Eye toxicity is an issue”。
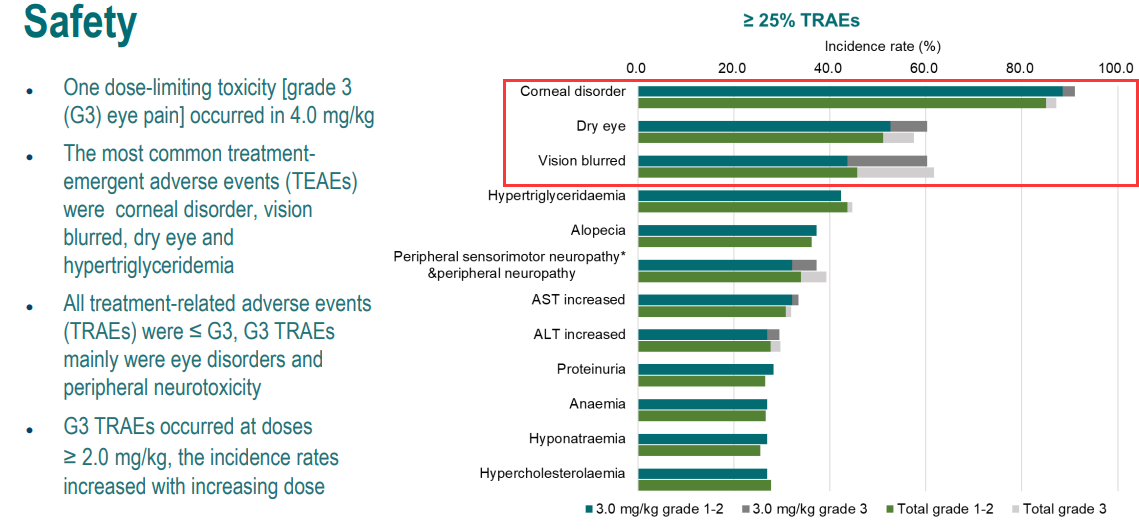
图1. DP303c治疗的安全性结果[1]

图2. Hervé Bonnefoi教授对DP303c的研究结果点评(图片来自2023ESMO迷你口头摘要讨论视频)
在ADC药物相关临床研究中,眼毒性是其特征性不良事件之一。虽然大多数眼部不良事件程度轻微且可逆,但部分患者的治疗进程可能受到影响,甚至可能导致视力下降等严重不良反应。目前已有3种ADC药物因突出的眼毒性被美国FDA予以黑框警告,包括Belantamab Mafodotin(用于多发性骨髓瘤)、Tisotumab Vedotin(用于宫颈癌)和Mirvetuximab Soravtansine(用于卵巢癌)[2]。
在乳腺癌领域,以HER2、Trop-2为靶点的ADC药物为临床治疗带来了重大突破,但随之而来的眼毒性问题也不容忽视。在临床研究中,已有多种ADC药物表现出眼部不良反应。而且,由于不同ADC药物的设计和结构存在差异,ADC药物报告的眼部不良反应种类繁多,临床表现各异。现有数据显示,眼毒性通常发生于≥2个治疗周期后,累及眼表,包括角膜炎、干眼症、角膜小囊或沉积物、结膜炎等。患者最常见症状为视力模糊,其次为视力下降和复视[3]。
ADC药物报告的眼部AE种类繁多,临床表现各异,发生机制尚未完全明确。循证证据显示,ADC的每个组成部分,包括抗体、连接子和有效载荷,都可能影响ADC诱导毒性的程度。常见引起ADC药物脱靶眼毒性的因素包括:①连接子-载药不稳定导致循环中载药过早释放;②旁观者效应,即ADC药物的游离有效载荷对邻近的靶抗原阴性细胞产生细胞毒性作用;③正常细胞通过受体依赖性和非受体依赖性(非特异性内吞)机制摄取/转运完整的ADC药物[2]。目前已报道的ADC眼毒性主要与靶点或有效载荷有关[4],在靶点方面,以HER2为例,由于HER2表达于角膜上皮,在促进角膜缘干细胞增殖和上皮伤口愈合中发挥重要作用,因此对HER2的抑制可能导致角膜和眼表不良反应[3]。在有效载荷方面,以广泛应用的美坦辛衍生物(如DM1、DM4)、澳瑞他汀(如MMAF、MMAE)为例,眼毒性可能与其造成的靶外效应有关[2,5]。
知而后行:全面了解不同乳腺癌ADC药物
眼毒性风险
如前所述,除DP303c外,T-DM1、T-DXd、SYD985等多种HER2 ADC药物在临床研究中均有报告眼毒性的发生。
其中T-DM1由抗HER2单抗曲妥珠单抗与细胞毒药物DM1(美坦辛衍生物),通过不可裂解硫醚连接子偶联而成。一项T-DM1后线治疗HER2阳性晚期乳腺癌的II期研究中,有31.3%的患者报告了眼部不良反应,包括干眼症、流泪增加、视力模糊/视力受损和结膜炎,大部分为1~2级[6]。另一项I期剂量递增研究纳入之前接受过曲妥珠单抗治疗的HER2阳性患者,结果显示约一半(13/28)患者报告眼部不良反应,包括眼表疾病、点状角膜炎和干眼症等,其中2例为3级不良反应[7]。
T-DXd由曲妥珠单抗、高活性拓扑异构酶Ⅰ抑制剂DXd和可裂解连接子偶联组成。目前认为T-DXd引起眼毒性可能与其靶向HER2抗体有关[8]。DESTINY-Breast01研究中,11.4%接受T-DXd治疗的患者报告了干眼症,其中1例为4级[9]。DESTINY-Breast03研究未报告眼部不良反应,但试验方案推荐在治疗期间进行眼部评估,包括眼底检查、视力检查和裂隙灯检查[10]。
表1. DESTINY-Breast01研究中眼部不良反应发生情况[8]
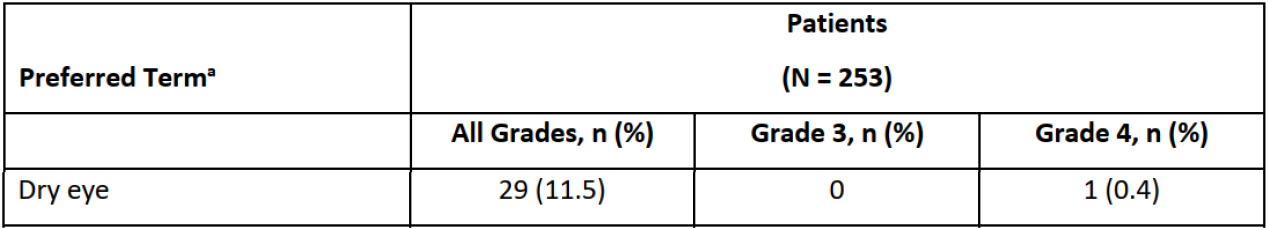
眼毒性也是Trastuzumab duocarmazine(SYD985/T-Duo)的常见不良反应。SYD985治疗实体瘤的一项Ⅰ期剂量递增和剂量扩展研究显示,在剂量递增阶段(0.3~2.4mg/kg),有8%的患者发生治疗相关角膜炎。此后,研究采取了预防措施,包括输注前使用血管收缩滴眼液和类固醇滴眼液,以及输注后2天内使用类固醇滴眼液。但剂量扩展阶段,使用1.2mg/kg的剂量时(部分组之后剂量减少为0.9mg/kg或减少给药频率),但仍有71%的患者报告至少一种眼部不良反应,干眼症和结膜炎的发生率均为31%[11]。此外,2023 ESMO大会公布的III期TULIP研究最终结果显示,有78.1%的SYD985治疗患者报告眼部不良反应,21.2%为≥3级不良反应,并且眼毒性导致21.5%的患者停止治疗以及22.9%的患者减量。具体而言,所有级别和≥3级结膜炎的发生率分别为38.2%和5.6%,角膜炎为38.2%和12.5%,干眼症为30.2%和4.2%,并有18.4%发生流泪增加[12]。与其他HER2 ADC不同,SYD985采用烷基化剂作为有效载荷以及可裂解的val-cit作为连接子,因此眼毒性在SYD985治疗中高发可能强调了载荷和连接子的重要性。
表2. TULIP研究中眼部不良反应发生情况[12]
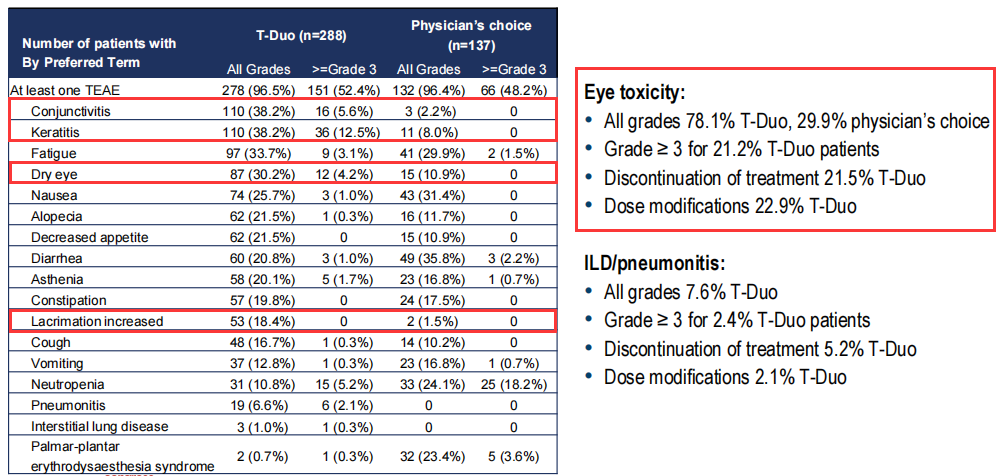
在Trop-2 ADC药物Dato-Dxd和SG治疗中也观察到了眼毒性。据2023 ESMO大会公布的TROPION-Breast01研究显示,眼毒性是Dato-Dxd需要特殊关注的不良反应。该研究中,眼毒性的总体发生率为49%,大部分为干眼症;有3例患者发生3级眼部不良事件,分别为干眼症、点状角膜炎以及干眼症伴溃疡性角膜炎,并且有1例患者因眼部不良反应停药[13]。此外,Dato-DXd联合免疫一线治疗三阴性乳腺癌的BEGONIA研究队列7结果显示,有21%的患者发生干眼症,14.5%报告角膜炎[14]。就SG而言,ASCENT研究中有不到5%的患者报告眼部不良反应,但IMMU-132-01和TROPiCS-02研究中均未报告[7,15]。

图3. TROPION-Breast01研究中眼部不良反应发生情况(图片来自2023SABCS Heather McArthur教授专题报告)
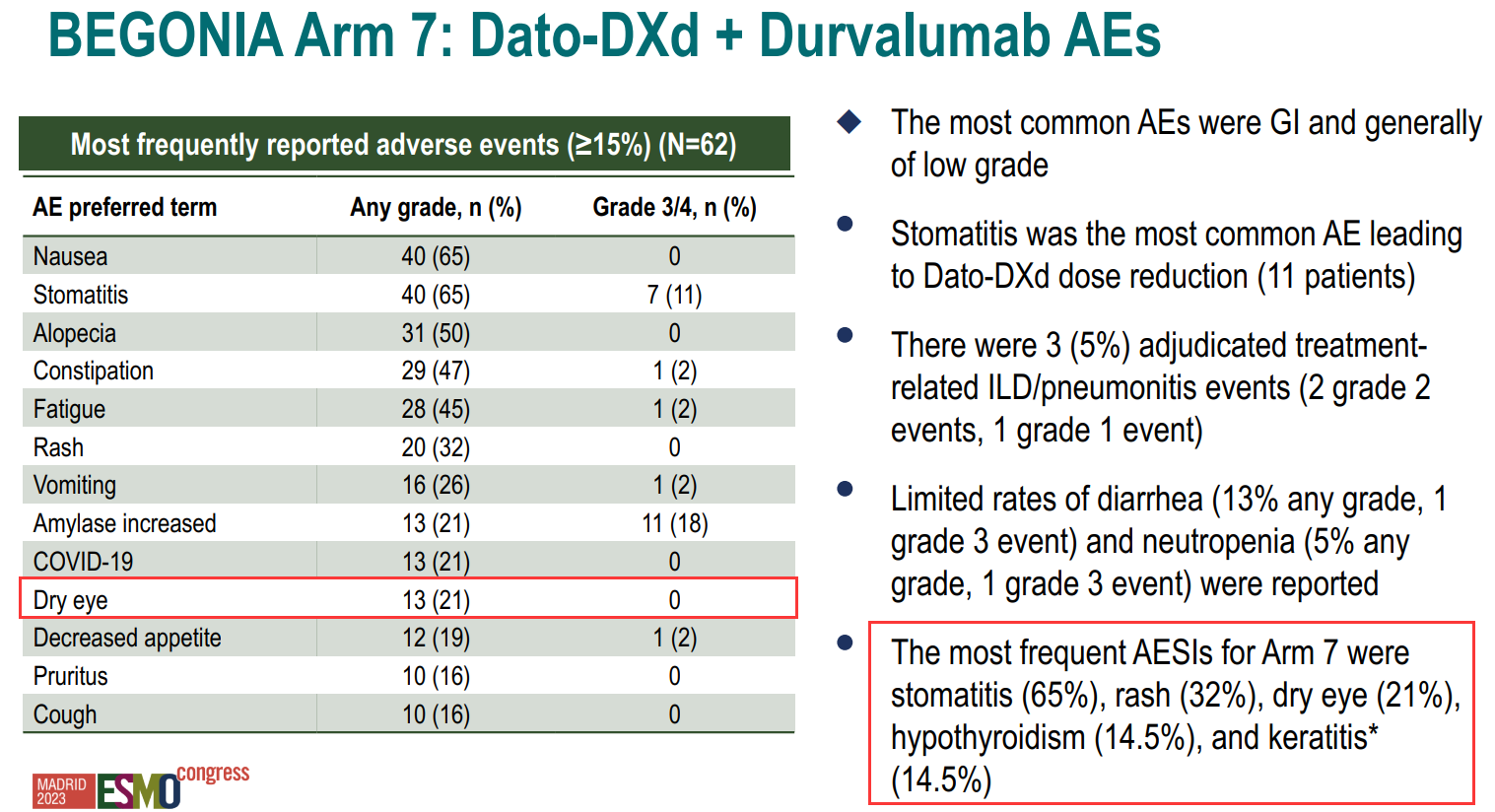
图4. BEGONIA研究队列7眼部不良反应发生情况(图片来自2023SABCS Heather McArthur教授专题报告)
规范管理:筑就乳腺癌患者ADC治疗安全保障
眼毒性作为一种特殊的ADC药物不良反应,可明显影响患者的生活质量,甚至带来严重后果。因此,在临床治疗的过程中,需对眼毒性予以特别关注,密切监测并及时管理眼部不良反应。多数情况下,经暂停用药以及给予对症支持治疗后,眼部不良反应可逆转[3]。
根据《中国乳腺癌抗体药物偶联物安全性管理专家共识》推荐,裂隙灯检查为诊断与评估的常规手段。1级不良事件可应用无防腐剂的人工泪液,同时继续原剂量治疗;2~3级不良事件需暂停治疗,可使用自体血清滴眼液,缓解后降级1个剂量水平继续治疗;4级应终止治疗。应避免使用类固醇类药物治疗。当症状恶化或出现2级以上不良事件时,应请眼科会诊,以制定和优化监测与干预方案[3]。
表3. ADC治疗乳腺癌患者中眼部不良反应分级标准及处理[3]

随着技术的不断升级,ADC药物在乳腺癌治疗领域展现出巨大的潜力。ADC药物兼具高特异性靶向和强效杀伤优势,能够精准地杀灭肿瘤细胞,为乳腺癌患者带来了更长生存的希望。然而,在用药过程中,临床医生对其不良反应也需引起足够的重视。眼毒性是ADC药物的特征性不良反应之一,在部分ADC药物治疗中的发生率较高。临床医生应加强对眼部不良反应的关注,深入了解其发生规律及防治策略,从而实现早期识别和有效干预,为患者安全用药提供保障,使患者更大程度获益。
排版编辑:Jessica
[1] J. Zhang, X. Hu, Y. Du, et al. A multicenter, open-label, dose escalation and expansion study of DP303c in patients with HER2-positive pre-treated advanced solid tumors. 2023 ESMO Abstract 385MO.
[2] 夏凡, 张晶晶, 杭永付, et al. 抗体药物偶联物相关眼毒性的研究进展. 药物流行病学杂志. 2023.32(9): 985-990.
[3] 中国医师协会肿瘤医师分会乳腺癌学组, 中国抗癌协会国际医疗交流分会. 中国乳腺癌抗体药物偶联物安全性管理专家共识. 中华肿瘤杂志, 2022, 44(9):913-927.
[4] D'Arienzo A, Verrazzo A, Pagliuca M, et al. Toxicity profile of antibody-drug conjugates in breast cancer: practical considerations. EClinicalMedicine. 2023;62:102113.
[5] Jaffry M, Choudhry H, Aftab OM, et al. Antibody-Drug Conjugates and Ocular Toxicity. J Ocul Pharmacol Ther. 2023;39(10):675-691.
[6] Burris HA 3rd, Rugo HS, et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER2)-positive breast cancer after prior HER2-directed therapy. J Clin Oncol. 2011;29(4):398-405.
[7] Beeram M, Krop IE, Burris HA, et al. A phase 1 study of weekly dosing of trastuzumab emtansine (T-DM1) in patients with advanced human epidermal growth factor 2-positive breast cancer. Cancer. 2012;118(23):5733-40.
[8] D'Arienzo A, Verrazzo A, Pagliuca M, et al. Toxicity profile of antibody-drug conjugates in breast cancer: practical considerations. EClinicalMedicine. 2023 Jul 27;62:102113.
[9] Modi S, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med. 2020;382(7):610–621.
[10] Hurvitz SA, Hegg R, Chung W-PP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023;401(10371):105–117.
[11] Verma S, Miles D, EMILIA Study Group, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012;367:1783–91.
[12] P.G. Aftimos, N. Turner, J. O’Shaughnessy, E. van den Tweel, et al. Trastuzumab duocarmazine versus physician’s choice therapy in pre-treated HER2-positive metastatic breast cancer: Final results of the phase III TULIP trial. 2023 ESMO Abstract 386MO.
[13] Bardia A, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. 2023 ESMO. LBA11.
[14] Schmid P, et al. Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic triple-negative breast cancer (a/mTNBC): Updated results from BEGONIA, a phase Ib/II study. 2023 ESMO Abstract 379MO.
[15] Rugo HS, Tolaney SM, Loirat D, et al. Safety analyses from the phase 3 ASCENT trial of sacituzumab govitecan in metastatic triple negative breast cancer. npj Breast Cancer. 2022;8(1):1–10.











 苏公网安备32059002004080号
苏公网安备32059002004080号


