乳腺癌是目前全球发病率最高的恶性肿瘤,也是全球女性最致命的恶性肿瘤之一。抗体药物偶联物(ADC)可通过抗体靶向作用将细胞毒性药物递送至肿瘤细胞,从而发挥强大的杀伤作用,素有“魔法子弹”之称。随着ADC药物的不断研发和广泛应用,乳腺癌患者迎来了前所未有的治疗突破。与此同时,如何管理好相关不良反应,确保患者能够从ADC治疗中最大程度获益,也成为临床医生普遍关心的问题。在第46届圣安东尼奥乳腺癌研讨会(SABCS)教育专场,得克萨斯大学西南医学中心Heather McArthur教授对ADC毒性管理进行了专题介绍。【肿瘤资讯】特邀中国医学科学院肿瘤医院马飞教授就该专题报告内容,以及《中国乳腺癌抗体药物偶联物安全性管理专家共识》和美国国家综合癌症网络(NCCN)指南相关推荐,对ADC药物的常见不良反应管理策略进行梳理,以推进ADC更好的临床选择与应用。
博士生导师内科治疗中心主任长江学者特聘教授
国家抗肿瘤药物临床应用监测专委会秘书长
国家肿瘤质控中心乳腺癌专委会副主委
国家癌症中心乳腺癌筛查与早诊早治规范委员会秘书长
健康中国行动推进委员会入库专家
中国药师协会肿瘤专科药师分会副主委
中国抗癌协会整合肿瘤心脏病分会副主委
中国抗癌协会多原发和不明原发肿瘤专委会副主委
中国抗癌协会肿瘤药物临床研究专委会秘书长
全国女性卵巢保护与抗衰促进工程专委会副主委
中国老年学和老年医学学会老年肿瘤分会总干事长
北京乳腺病防治学会副理事长
北京市肿瘤治疗质量控制和改进中心肿瘤化疗质控专委会主委
获得国家科技进步奖二等奖,及“首都十大杰出青年医生”、“中国肿瘤青年科学家奖”等荣誉称号。
未雨绸缪:乳腺癌ADC药物不良反应概览
ADC是一类由高度靶向性的单克隆抗体与小分子细胞毒性药物偶联而成的新型抗肿瘤药物,可通过抗体靶向作用将细胞毒性药物递送到含表面抗原的肿瘤细胞后发挥抗肿瘤作用[1]。ADC的精准制导作用使其能特异性地识别和杀伤肿瘤细胞,并减少传统化疗药物治疗引起的毒性。然而,受当前技术和工艺限制,以及抗体特异性、连接子稳定性等因素影响,ADC仍可能导致多种不良反应。比如,连接子不稳定可造成部分毒性载荷在循环中释放,并导致ADC的脱靶毒性。鉴于抗体、细胞毒性制剂、连接子以及偶联过程等均为ADC相关不良反应的重要决定因素,而不同ADC的结构设计存在差异,因此不同ADC的不良反应谱也存在独特性和异质性[2]。
目前已有三款ADC获批乳腺癌适应症,分别为恩美曲妥珠单抗(T-DM1)、德曲妥珠单抗(T-DXd)和戈沙妥珠单抗(SG)。其中HER2 ADC药物T-DXd常见不良反应以恶心呕吐、腹泻、血液毒性为主,≥3级不良反应以中性粒细胞减少常见,对于其可能导致的间质性肺病(ILD)和胚胎-胎儿毒性FDA予以黑框警告;T-DM1最常见的不良反应为肝毒性、血液毒性、恶心呕吐,其中≥3级不良反应主要为血小板减少、肝毒性,FDA对其可能导致的肝毒性、心脏毒性和胚胎-胎儿毒性予以黑框警告。在TROP2 ADC药物中,SG常见的不良反应为血液毒性、恶心呕吐、腹泻等,其中≥3级不良反应以中性粒细胞减少、腹泻为主;Dato-DXd尚未获批,但也在乳腺癌领域取得了探索成果,据2023 ESMO大会公布的TROPION-Breast01研究显示,其需要特殊关注的不良反应包括黏膜炎和口腔炎、眼部不良反应和ILD[3]。
捍卫未来:做好安全性管理,提升患者获益
鉴于不同ADC的不良反应谱存在差异,因此在临床实践中应根据不同ADC的不良反应特点进行个体化管理。在治疗期间中,需及时采取相应的监测和管理措施,以确保患者能够安全地接受ADC治疗并获得最佳的治疗效果。
间质性肺病
间质性肺病(ILD)是抗肿瘤药物治疗的一种常见肺部不良反应,如果处理不当可能导致治疗暂停或中断,严重者甚至危及患者生命,已成为当前临床关注的重点。ILD是T-DXd需特殊关注的不良反应,其ILD相关死亡率约为1.7%-2.2%[2]。在DESTINY-Breast01研究中,T-DXd后线治疗HER2+晚期乳腺癌,任何级别ILD发生率为15.2%,5级ILD发生率为2.7%(5例)[4]。DESTINY-Breast03研究显示,ILD/肺炎的发生率随着药物暴露和随访时间延长而升高,从16.2个月时的10.5%上升至28.4个月时的15.2%[5,6]。此外,DESTINY-Breast04研究中,T-DXd治疗HER2低表达乳腺癌,ILD/肺炎的发生率为12.1%。
值得一提的是,该研究遵循现行指南对ILD/肺炎进行监测和管理,包括:通过主动监测症状和影像学表现,以识别ILD或肺炎的潜在病例;一旦发现疑似病例,及时暂停治疗,并根据推荐尽早开始糖皮质激素治疗等,但该研究中仍有3例患者发生ILD/肺炎相关死亡[7]。

图1. DESTINY-Breast04研究中T-DXd相关ILD监测和管理策略(图片来自Heather McArthur教授专题报告)
目前HER2 ADC导致ILD的机制尚不明确,可能与其载荷部分相关。动物模型显示,T-DXd导致肺损伤的病理生理机制可能与不依赖于靶点的肺泡巨噬细胞摄取T-DXd有关[2]。此外,有研究发现,其他载荷为DXd的ADC药物也可能导致ILD的发生。比如Dato-DXd后线治疗HR+/HER2-晚期乳腺癌的TROPION-Breast01研究中,有3%的患者发生ILD,并且有1例患者发生5级药物相关ILD[8]。而在ASCENT研究中,SG治疗未发生药物所致的ILD事件[9]。
《中国乳腺癌抗体药物偶联物安全性管理专家共识》(以下简称《共识》)对ILD管理给予了详细的推荐,具体流程如图2所示。《共识》指出,在T-DXd和T-DM1治疗期间,应监测并及时评估呼吸道症状、体征以及影像学相对于基线期的变化,并告知患者可能的风险以及出现症状后立即报告的必要性。接受ADC治疗的患者一旦疑诊ILD或非感染性肺炎,应严格进行ADC剂量调整或终止用药,并考虑立即开始糖皮质激素治疗,同时请呼吸科和影像科会诊[2]。
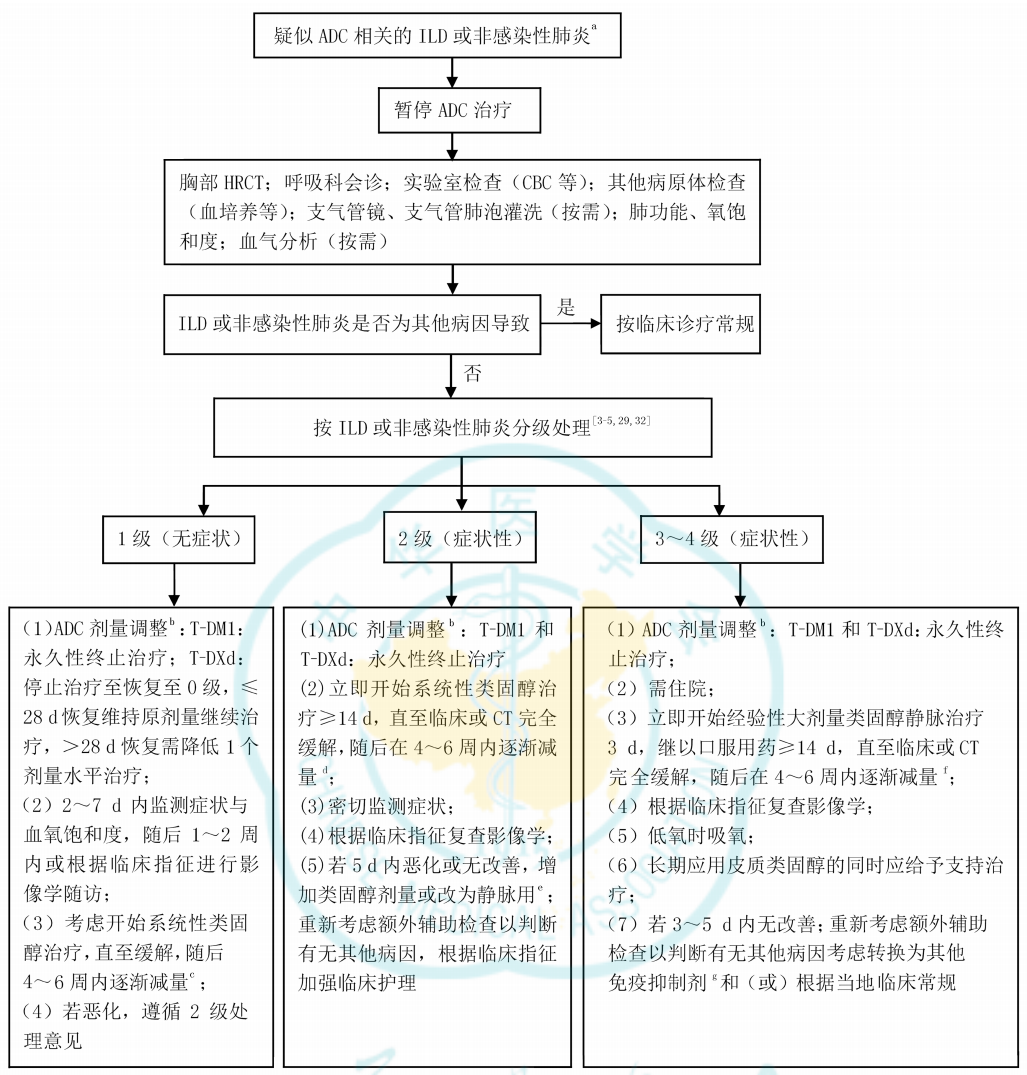
图2.《共识》推荐的治疗相关ILD或非感染性肺炎的常规对症处理流程
恶心/呕吐
呕吐是ADC药物常见的消化道不良反应。DESTINY-Breast03研究中,T-DXd治疗的恶心发生率为73.5%,呕吐发生率为44.4%,大部分为1-2级并可通过预防性止吐及对症治疗得到控制,但有1例患者因呕吐停止治疗[5]。美国NCCN指南推荐,按照高致吐风险管理措施进行T-DXd治疗前的预防性止吐。指南推荐优选奥氮平+NK1受体拮抗剂+5-HT3受体拮抗剂+地塞米松的四药联合方案,也可以选择奥氮平+帕洛诺司琼+地塞米松或NK1受体拮抗剂+5-HT3受体拮抗剂+地塞米松的三药联合方案[10]。
腹泻
腹泻是SG的常见不良反应,T-DXd和T-DM1也有腹泻报告。ASCENT研究中,SG相关腹泻主要为轻中度,无4级腹泻发生,也未发生腹泻相关停药[9]。《共识》推荐,在SG治疗期间应密切监测,并及时处理,必要时给予补液和电解质支持治疗。早发型腹泻如无禁忌证,可使用阿托品预处理和控制。对于迟发型腹泻,需要考虑腹泻是否与感染相关,若排除了其他明确的感染原因,可立即使用洛哌丁胺。洛哌丁胺首次使用剂量为4 mg,以后每次腹泻发作使用2 mg,每天最多使用剂量为16 mg。腹泻缓解12 h后停用洛哌丁胺。对于腹泻不缓解的患者,如前述洛哌丁胺4 mg+2 mg,每2 h给予1次;24 h若无好转,改用奥曲肽100~150 mg,3次/d。重度腹泻应考虑住院[2]。
中性粒细胞减少
中性粒细胞减少为ADC药物治疗中常见的不良反应。ASCENT研究中,SG治疗的任何级别和≥3级中性粒细胞减少发生率分别为63%和34%,但≥3级中性粒细胞减少发生晚、消退快,较少引起发热性中性粒细胞减少,并且未发生中性粒细胞减少相关停药[9]。《共识》推荐,接受SG治疗的患者可考虑粒细胞集落刺激因子(G-CSF)作为二级预防治疗。中性粒细胞减少伴发热或存在重复性感染的患者必须立即开始抗感染治疗。根据患者风险程度选择经验性抗生素治疗,高危患者应进行抗真菌预防。对于已知UGT1A1酶活性下降的患者,或出现提示UGT1A1酶活性下降的证据,如急性早发或异常严重的不良反应,应密切监测,必要时暂停或停止治疗。但目前无证据支持SG治疗之前或过程中需常规进行UGT1A1基因型检测[2]。
血小板减少
血小板减少为接受T-DM1治疗患者中最常见的药物不良反应,其发生率及严重程度在亚裔患者中更高。T-DM1治疗期间,血小板减少是减量甚至停药的首要原因。《共识》推荐,在ADC治疗期间,应常规监测血小板计数,若出现血小板减少,应及时按说明书调整T-DM1剂量或停药。血小板减少≥2级时给予升血小板药物,血小板减少4级时可考虑输注血小板。必要时请血液科会诊(图3)[2]。
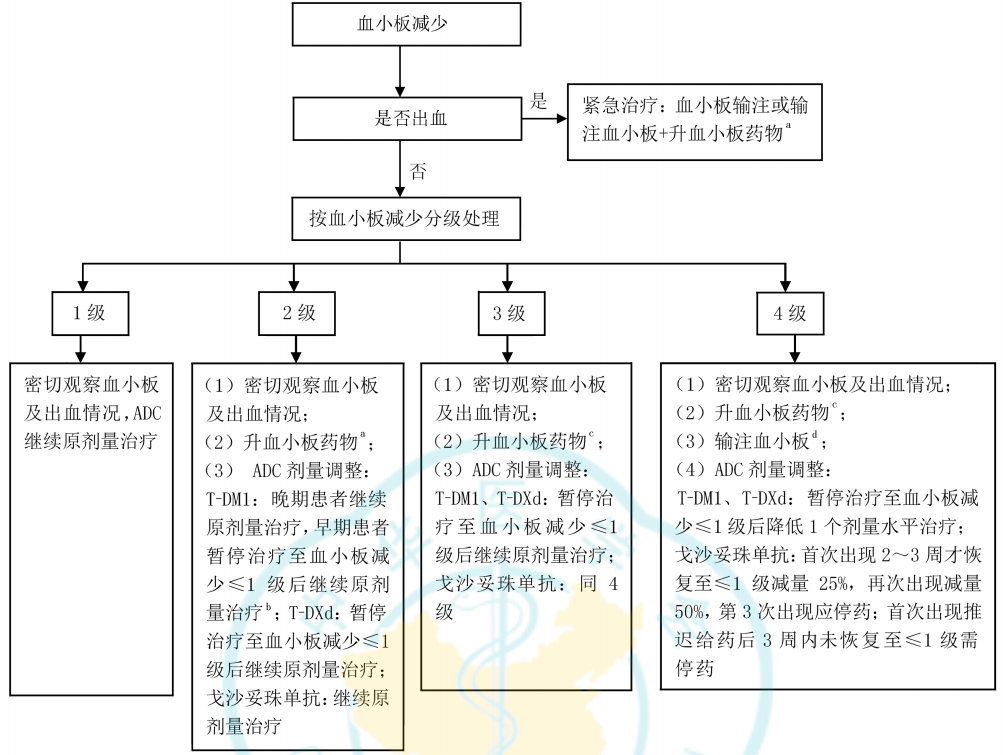
图3.《共识》推荐的ADC治疗相关血小板减少的常规对症处理流程
肝不良反应
T-DM1说明书黑框警告提示,接受T-DM1治疗的患者中出现过肝不良反应、肝功能衰竭及死亡患者。《共识》推荐,在开始T-DM1治疗之前以及每次给药之前应监测肝功能。应根据肝脏酶学、胆红素等实验室检查结果的变化以及肝脏影像学检查结果,必要时行病理组织学检查,及时调整用药剂量或停止治疗[2]。
心脏不良反应
左心室射血分数(LVEF)降低是曲妥珠单抗的一个已知风险,分别列在T-DM1说明书的黑框警告以及T-DXd说明书的警告和注意事项中。《共识》推荐,LVEF基线值较低的患者须在仔细评估获益风险后再决定是否给予T-DM1或T-DXd治疗。开始治疗前以及治疗期间应根据临床指征定期评估LVEF。ADC治疗期间如出现症状性充血性心力衰竭,按照指南推荐的标准流程治疗心力衰竭,并永久停止ADC治疗[2]。
眼部不良反应
ADC用于肿瘤治疗时报告的眼科不良事件种类繁多,不良反应机制和发病机制尚不明确,靶向与靶外效应都可能参与。T-DM1、T-DXd和Dato-DXd均可引起眼部不良事件。TROPION-Breast01研究中,眼部不良反应是Dato-DXd需要特殊关注的不良反应,总体发生率为49%,大部分为干眼症;有3例患者发生3级眼部不良事件,分别为干眼症、点状角膜炎以及干眼症伴溃疡性角膜炎,并且有1例患者因眼部不良反应停药[8]。《共识》推荐,1级不良事件可应用无防腐剂的人工泪液,同时继续原剂量治疗;2~3级不良事件需暂停治疗,可使用自体血清滴眼液,缓解后降级1个剂量水平继续治疗;4级应终止治疗。应避免使用类固醇类药物治疗。当症状恶化或出现2级以上不良事件时,应请眼科会诊[2]。
随着ADC药物的不断发展和应用,乳腺癌治疗领域已经发生了革命性的变化。ADC药物作为“魔法子弹”,以其高效、精准的特点,为乳腺癌患者带来了全新的治疗选择。然而,我们也需要警惕ADC药物可能带来的不良反应,特别是ILD。在临床实践中,应根据国内外指南推荐,通过早期发现、精准评估和及时干预,有效管理ADC相关不良反应,从而改善患者预后,延长生存,提高生活质量。
排版编辑:Jessica
[1] 张军, 刘强. 抗体药物偶联物在乳腺癌治疗领域的应用:从机制到临床应用. 中华内分泌外科杂志, 2023, 17(5):630-634.
[2] 中国医师协会肿瘤医师分会乳腺癌学组, 中国抗癌协会国际医疗交流分会. 中国乳腺癌抗体药物偶联物安全性管理专家共识[J]. 中华肿瘤杂志, 2022, 44(9):913-927.
[3] Aditya Bardia, et al. Randomized phase 3 study of datopotamab deruxtecan vs chemotherapy for patients with previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative breast cancer: Results from TROPION-Breast01. 2023. SABCS, GS02-01.
[4] Modi S, et al. Updated results from DESTINY-breast01,a phase 2 trial of trastuzumab deruxtecan(T-DXd) in HER2 positive metastatic breast cancer. Cancer Res, 2021, 81(Suppl 4): PD3-06.
[5] Cortés J, et al. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med. 2022 Mar 24;386(12):1143-1154.
[6] Hurvitz SA, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023 Jan 14;401(10371):105-117.
[7] Rugo H, et al. Trastuzumab deruxtecan (T-DXd) vs treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): a detailed safety analysis of the randomized, phase 3 DESTINY-Breast04 trial. 2023 ESMO BC. Abstract: 185O.
[8] Bardia A, et al. Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. 2023 ESMO. LBA11.
[9] Bardia A, et al. Sacituzumab Govitecan Versus Treatment of Physician's Choice in Patients With Previously Treated Metastatic Triple-Negative Breast Cancer: Final Data From the Phase 3 ASCENT Study. 2022 ASCO. 1071.
[10]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Antiemesis. Version 1.2024 — December 13, 2023.











 苏公网安备32059002004080号
苏公网安备32059002004080号


