 【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
导读
1)病例简介:本文报告一例T4b期MSI-H乙状结肠癌新辅助PD-1单抗治疗后出现肝及腹膜转移患者的治疗经过。该病例在出现转移后通过双免疫联合治疗,肿瘤逐步缩小,改为PD-1抗体单药维持治疗后行手术治疗,术后病理提示pCR。
病史简介
1)病史摘要:
a) 初诊时间:2022年12月
b) 患者,男,32岁,因“大便习惯改变伴便血2月”至外院就诊
c) 2022-10出现大便次数增加,5-8次/天,间断大便带血,伴里急后重感,无腹痛、腹胀及肛门停止排便排气等不适,2022-12-10外院行肠镜:见直乙交界肿物,内镜不能通过;活检病理示:腺癌;腹部增强CT示:乙状结肠与直肠上段交界部肠壁不规则增厚、肠腔狭窄,符合结直肠癌表现,并有多发淋巴结转移;NGS基因检测提示:MSI-H,TMB 91.62Muts/Mb,KRAS突变(G13D),MLH1胚系致病性突变。
d) 既往史:无特殊。
e) 家族史:外公60+岁患肠癌,母亲30+患肠癌(2次肠癌)。
f) 查体:KPS 100分,浅表淋巴结(-),腹软,无压痛、反跳痛,无肌紧张。未触及腹部包块。肝脾肋下未触及。肠鸣音4次/分,肛门指检(-)。
2)外院治疗经过:
a) 2022-12-27外院行腹腔镜探查术,术中见肿瘤突破浆膜层,侵犯腹壁,固定,可疑侵犯左侧输尿管,余腹盆腔未见种植转移。
b) 2022-12-30、2023-01-17外院行特瑞普利单抗240mg新辅助免疫治疗2程,C2 后复查 CT 提示肿瘤有缩小。2023-02-03患者出现发热、腹痛,考虑肠梗阻,局限性穿孔,在外院予保守处理后好转。
c) 2023-02-11、2023-02-27继续予特瑞普利单抗240mg新辅助免疫治疗第3、4程,过程顺利。C3治疗后患者CA199进行性升高(具体不详)。后至我院就诊。
完善检查
1)实验室检查
2023-03-07肿瘤标志物:CEA 1.16ng/mL; CA19-9 357U/mL
2)肠镜检查
2023-03-13肠镜提示:距肛缘约13-16cm见肿物,呈菜花样,表面凹凸不平,质脆易出血,肠腔狭窄,普通肠镜难以通过,超细肠镜顺利通过;距肛缘约12cm见一直径约为1.5cm的带蒂息肉(图1)。
图1.我院治疗前肠镜图像。距肛缘约13-16cm见菜花样肿物,肠腔狭窄。
3)病理会诊
(直乙交界)至少为粘膜内癌。因送检组织少且浅表,请结合临床及内镜、影像学所见。
4)影像学检查
2023-03-10盆腔MR:乙状结肠癌免疫治疗后复查:距肛缘约86mm处乙状结肠与直肠交界区肠壁增厚,最厚处约18mm,肠腔狭窄,病变范围约102mm,符合乙状结肠癌。病变周围见多个淋巴结,考虑转移。
2023-03-10胸腹CT:肝 S3 结节,大小约 22mm×14mm,考虑转移瘤;大网膜、肠系膜多发结节,考虑肿瘤种植转移。腹主动脉旁、双侧髂总血管旁多发小淋巴结,建议随诊(图2)。
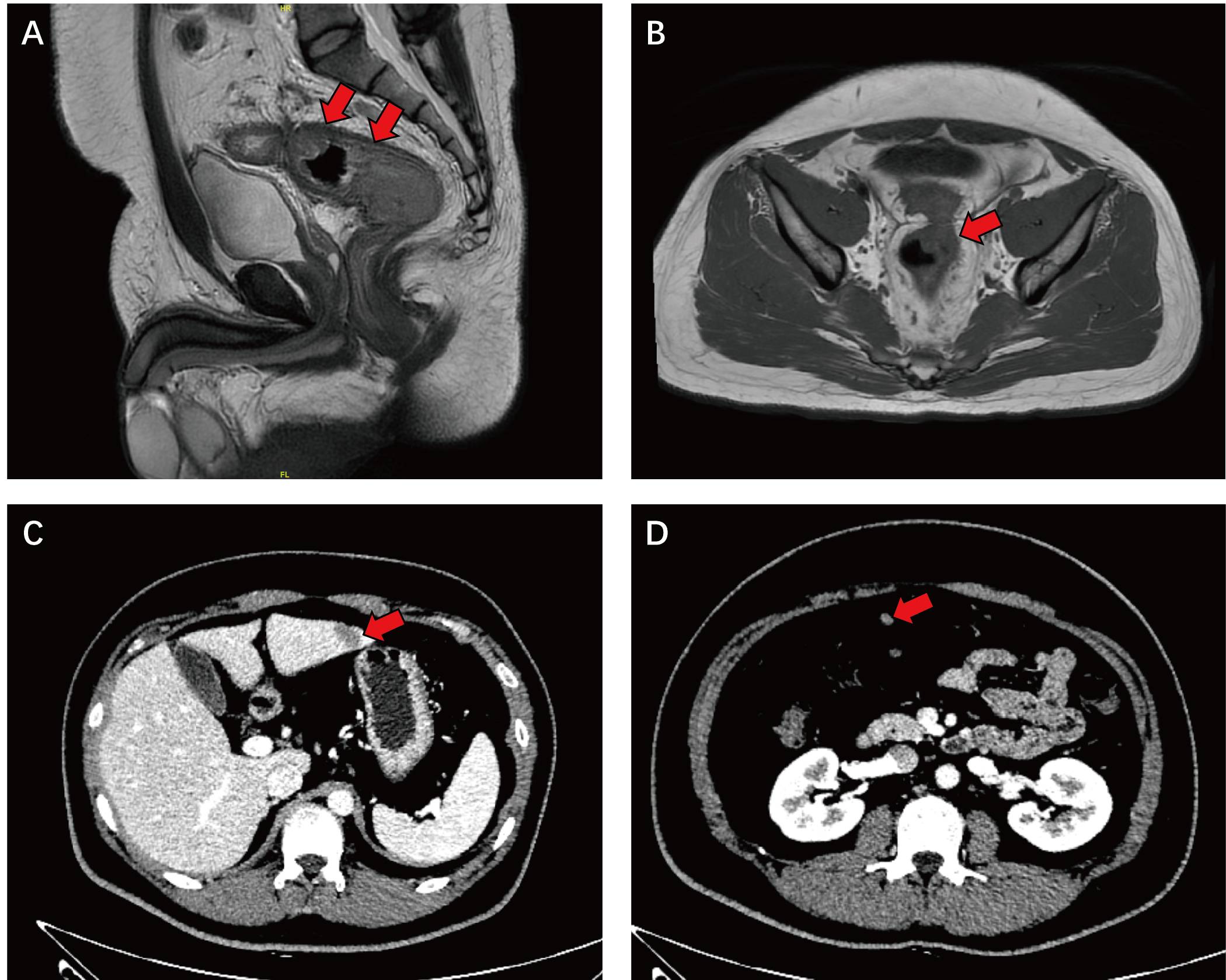
图2.我院治疗前影像学图像。A, B:盆腔MR示距肛缘约86mm处乙状结肠与直肠交界区肠壁增厚,肠腔狭窄,红色箭头示病变区域;C:腹部CT示肝S3结节(红色箭头所示);D:红色箭头示大网膜转移灶
诊断
1) 乙状结肠癌并肝、腹膜转移PD-1抗体治疗后,ycT4bN+M1c,IVC期,MSI-H,TMB-H(91.62Muts/Mb),KRAS G13D突变
2)林奇综合征(MLH1胚系致病性突变)
3)直肠息肉
丁培荣教授分析1
1. 意见:
a) 患者初治时诊断为局部极晚期的乙状结肠癌,手术探查未见盆腹腔种植转移,基因检测提示为MSI-H。本团队既往研究提示,对于dMMR/MSI-H结直肠癌,即使是局部极晚期(T4b)肿瘤,新辅助免疫治疗仍显示出良好的疗效,可显著降低开腹手术以及多脏器联合切除率,并可使部分患者达到病理完全缓解(pCR)。这种显著的疗效也在随后多个临床研究中得到验证。
b) 该患者在外院接受2程新辅助PD-1单抗治疗后复查CT提示肿瘤稍缩小,但C3后CA19-9进行性升高,C4后至我院复查,影像学提示肝转移及腹膜种植转移,考虑继发性免疫治疗耐药可能。目前针对PD-1抗体免疫治疗耐药后的治疗选择暂无指南或共识指导。Checkmate-142研究结果提示PD-1 抗体+小剂量CTLA-4抗体的“双免治疗”在转移性MSI-H/dMMR结直肠癌中显示出良好的疗效。2022年ESMO报告了NICHE-2研究的初步结果,在仅接受2剂PD-1单抗和1剂CTLA-4单抗新辅助治疗的情况下, 95%的非转移性dMMR结直肠癌患者取得了主要病理缓解(MPR),甚至有67%的患者达到pCR。这些研究结果提示双免疫联合治疗可能比单用PD-1抗体疗效更佳,为进一步探索联合CTLA-4抗体能否逆转PD-1抗体单药治疗耐药提供了依据。
c) 该患者非常年青,治疗意愿强烈,目前身体情况好,KPS100分,建议行 PD-1 抗体+CTLA-4抗体“双免治疗”,治疗期间应该严密监测免疫相关副反应。
后续治疗
1. 治疗经过:
2023-03-16至2023-05-18行替雷利珠单抗200mg+伊匹木单抗100mg联合免疫治疗4程;为避免持续常规剂量“双免治疗”带来的 潜在免疫相关副反应,后续治疗改为PD-1抗体单药治疗。2023-06-13至2023-10-18行替雷利珠单抗200mg免疫治疗7程。主要副反应:1级皮疹及2级皮质醇功能减退。
1. 治疗评价:
a) 4程双免疫联合治疗后评价PR:2023-06-03我院肠镜:距肛门约16cm见结节样肿物,管腔狭窄,内镜无法通过(图3)。活检病理提示:肠粘膜慢性炎,未见肿瘤。2023-06-05我院CT及MR提示:乙状结肠与直肠交界区病变较前缩小,周围及直肠系膜区多发淋巴结,部分较前稍缩小。肝 S3 包膜凹陷,考虑转移瘤治疗后,较前缩小。大网膜、肠系膜散在结节,考虑肿瘤种植转移,较前缩小、减少(图4)。
图3.4程双免疫治疗后肠镜图像。距肛门约16cm见结节样肿物,管腔狭窄,内镜无法通过。
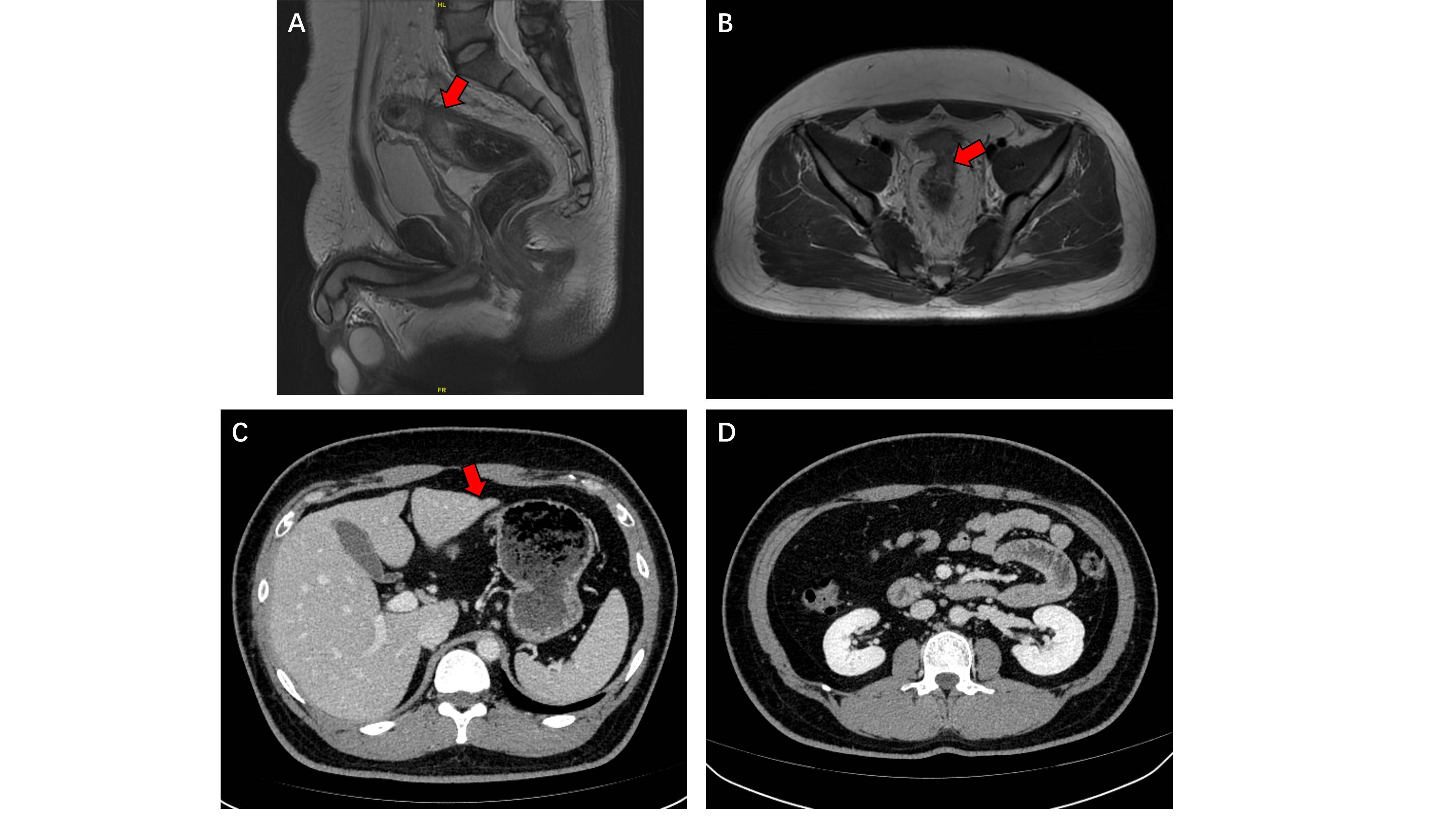
图4。4程双免疫治疗后影像学图像。A, B:盆腔MR示乙状结肠与直肠交界区病变较前缩小,红色箭头示病变区域;C:腹部CT示肝S3包膜凹陷,考虑转移瘤治疗后,较前缩小(红色箭头所示);D:原大网膜转移灶未见明显显示
b) 4程双免疫+4程PD-1单抗单药治疗后评价PR:2023-08-30我院CT及MR:直乙肠交界区肠壁稍增厚,较前相仿。周围肠系膜区未见肿大淋巴结。双侧髂血管旁、腹股沟未见肿大淋巴结。肝 S3 包膜凹陷,考虑转移瘤治疗后。右侧腹膜数个钙化灶,同前(图5)。
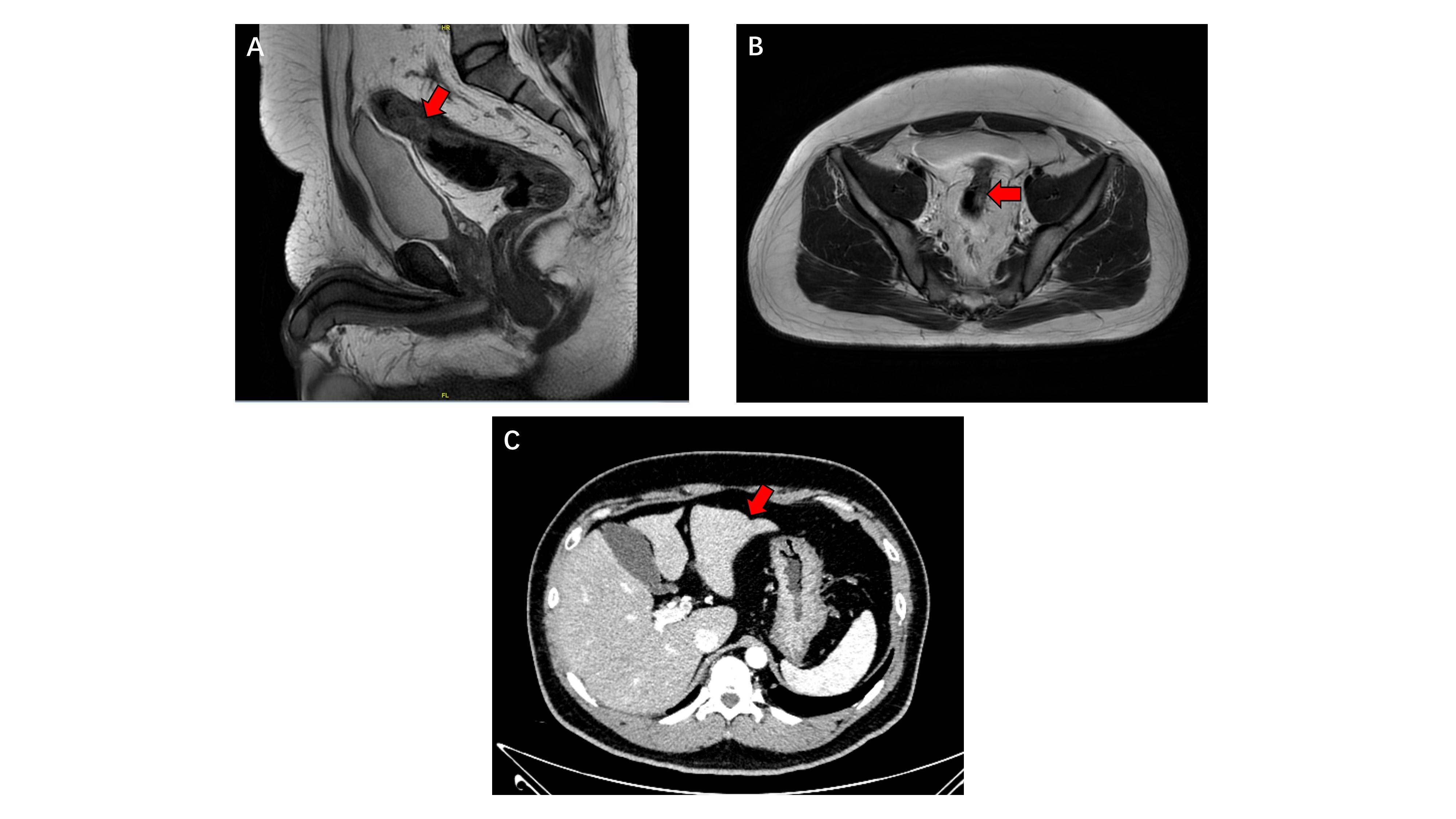
图5.4程双免疫+4程PD-1抗体治疗后影像学图像。A, B:盆腔MR示直乙肠交界区肠壁稍增厚,较前相仿,红色箭头示病变区域;C:腹部CT示肝 S3 包膜凹陷,考虑转移瘤治疗后(红色箭头所示)
c) 肿瘤标志物变化及主要毒副反应:CEA 一直不高,CA19-9持续下降,3程双免疫联合治疗后降至正常(图6);主要毒副作用为1级皮疹及2级皮质醇功能减退,予糖皮质激素补充及对症治疗后均可缓解。
丁培荣教授分析2
双免治疗后肿瘤标志物、影像学、内镜均显示肿瘤明显退缩,考虑CR可能。治疗上可选择手术探查,行原发灶及转移灶切除,根据既往经验和研究数据,病例完全缓解可能性大。也可考虑观察等待和器官保全,但是原发灶治疗后呈纤维化肠腔狭窄改变,后续有潜在梗阻风险。需要充分告知风险并密切随访。
后续治疗
充分沟通后患者及家属要求手术。
手术及病理结果:直肠前切除+大网膜切除+肝S3结节切除。术后病理:直肠大体、肝S3结节、大网膜均未见肿瘤残留。
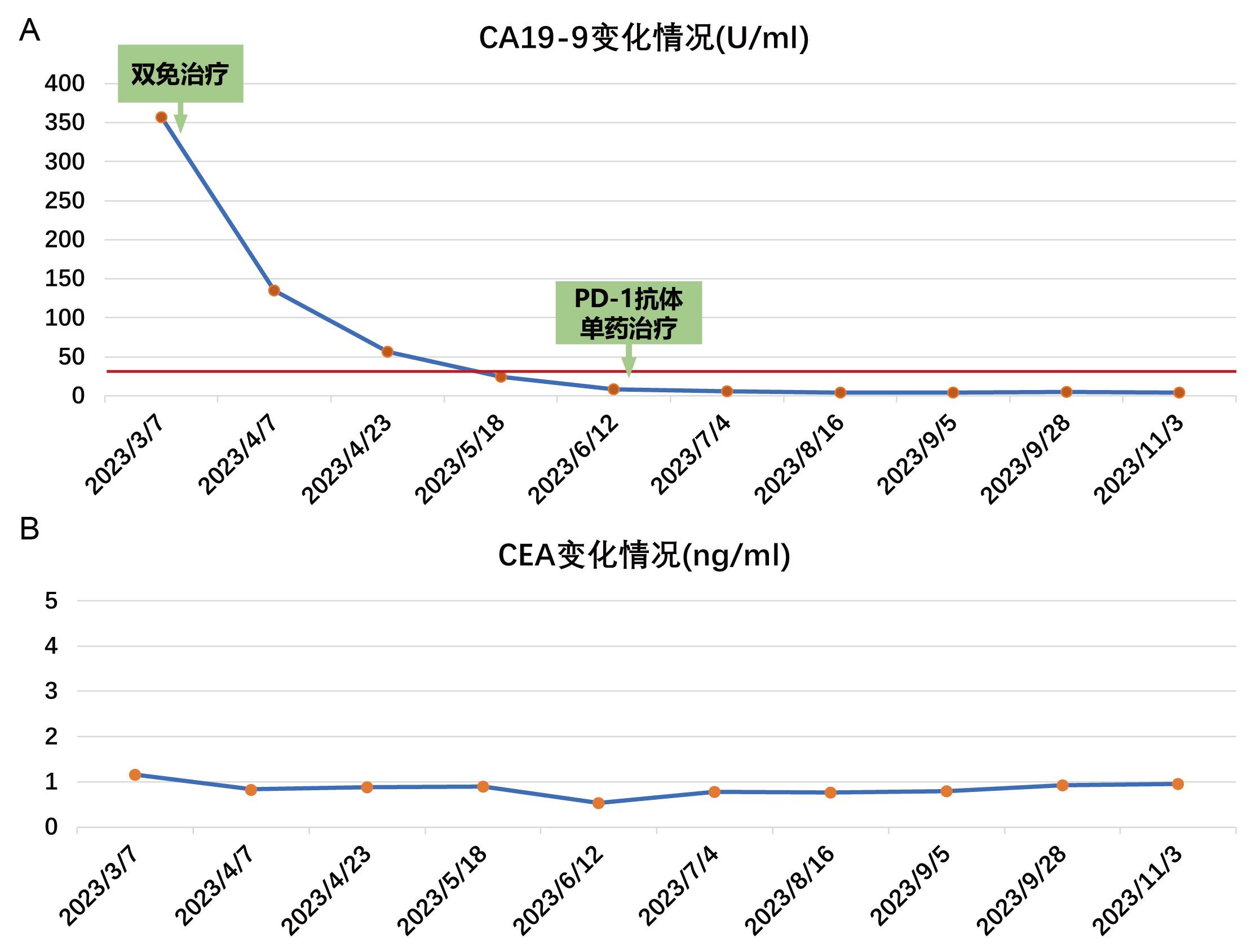
图6.肿瘤标志物变化情况。A: CA19-9持续下降,3程双免疫治疗后降至正常范围(红线示参考正常值上限); B: CEA一直不高。
病例小结
1)诊疗时间轴(图7)
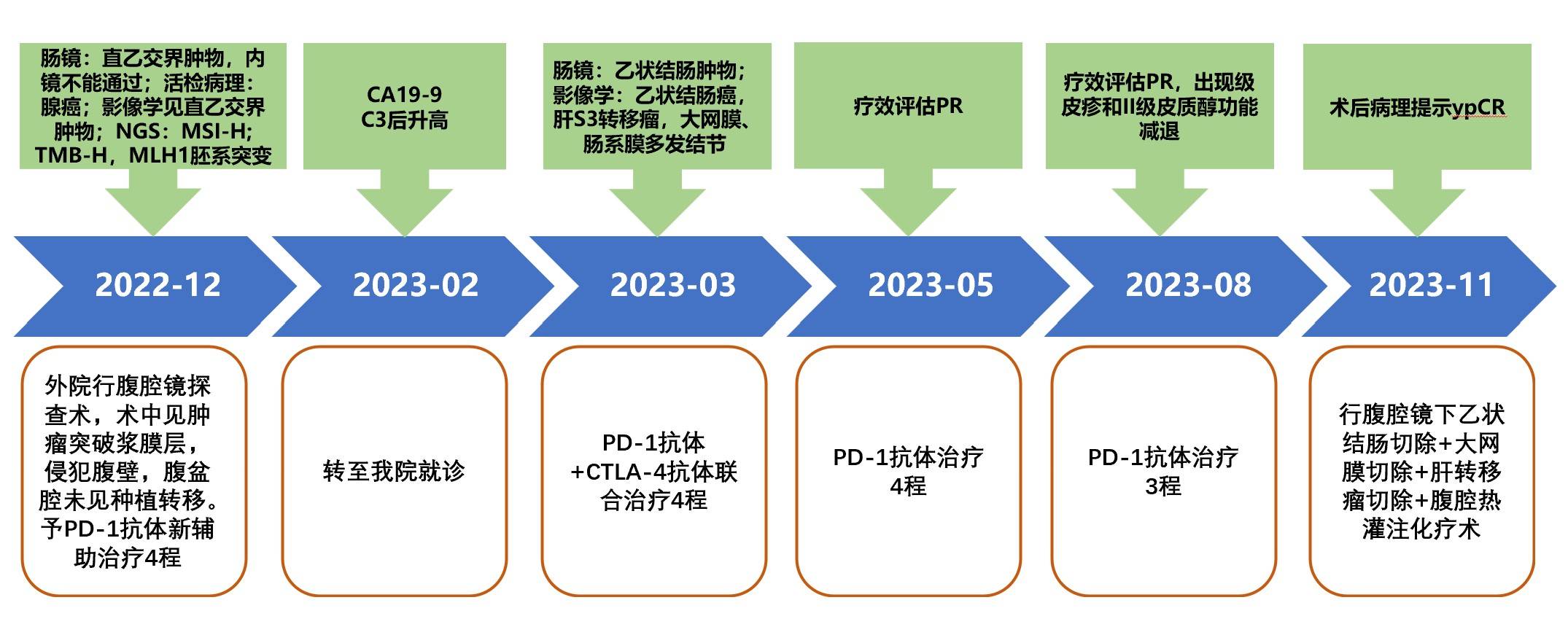
图7.本病例诊疗时间轴
2) 诊治心得:
本病例初诊的时候为局部极晚期乙状结肠癌,外院手术探查发现广泛侵犯无法手术切除,基因检测发现为MSI-H, MLH1基因胚系突变。dMMR/MSI-H肿瘤具有高突变负荷(TMB-H)的特点,由此产生大量的新抗原,触发肿瘤微环境的强大免疫应答,是以PD-1抗体为代表的免疫检查点抑制剂的优势癌种。从既往研究数据看,该类患者新辅助免疫治疗pCR率高达60-70%。但是仍然有少数患者可能在治疗中进展。
本病例治疗决策中的一个难点是判断是否存在假性肿瘤进展,患者在外院2程PD-1抗体单药治疗后肿瘤有退缩,但是出现梗阻和局限性穿孔。继续进行2程治疗后出现肿瘤标志物持续性升高,及新发的肝脏和腹膜转移。从文献报道,多数的假性进展表现为局灶的肿瘤增大,少数可伴新发的区域外淋巴结增大或者肺或肝的局限性病灶,但多不伴有肿瘤标志物的进行性升高,也未见以腹腔新发结节为表现的假性进展。因此,综合判断为肿瘤进展。
PD-1抗体治疗耐药的后续治疗非常棘手,多数研究显示后线治疗PFS约2个月,预后差。既往临床前研究提示,肿瘤负荷的增加可导致肿瘤微环境中营养物成分的改变、TNFα等炎症因子的释放以及中性粒细胞等炎症细胞的浸润增多,进而影响免疫细胞的数量和功能,最后导致抗PD-1治疗抵抗。而CTLA-4抗体有助于促进肿瘤中免疫细胞的浸润和代谢适应性,阻断炎症因子的释放和炎症细胞的聚集,在临床前模型中可有效逆转抗PD-1治疗抵抗。因此,临床实践中,联合CTLA-4抗体或可有助于逆转PD-1抗体治疗耐药,治疗过程中需严密监测不良反应,并及时根据疗效及副反应调整治疗方案。
从临床研究数据看,Checkmate-142研究显示PD-1抗体联合CTLA-4抗体后线治疗ORR显著高于PD-1抗体单药治疗(51% vs.31%);而一线治疗双免疫治疗ORR高达69%,CR率13%,显著高于其他PD-1抗体单药治疗的研究。从队列研究和临床实践中也观察到PD-1抗体单药治疗失败后,联合CTLA-4抗体成功逆转了耐药,并获得了长期的肿瘤控制。因此,对于PD-1抗体治疗耐药或者对于原发耐药高危患者,双免疫联合治疗可能是一个更好的治疗策略。其他的PD-1抗体耐药后的治疗策略包括联合抗血管生成TKI,或者联合化疗及靶向。本例患者成功通过CTLA-4抗体逆转PD-1抗体耐药也进一步支持这种理论。
本例患者另一个重要问题是在双免治疗后获得显著的肿瘤退缩,是否需要进行手术。从转移性结直肠癌的治疗理念看,在全身治疗获得有效控制之后,局部治疗争取NED是获得长期生存的重要前提。但是,对于MSI-H转移性结直肠癌在免疫治疗后是否需要手术可能需要更多的研究数据。MD Anderson癌症中心的一项研究显示,14例dMMR/MSI-H mCRC在接受一线免疫治疗后进行了手术,尽管其中 12 名患者的术前影像显示存在残留肿瘤,仅有一名患者的切除标本显示有肿瘤细胞残留。研究者认为,这类患者可能不需要手术。但是,本中心数据显示病理残留的风险可能与转移部位及病理类型相关,是否进行手术需要更细致的决策。具体到本病例,术前虽然肠镜见黏膜光滑,但是免疫治疗后的疤痕和纤维化导致肠腔狭窄,因此,在充分知情后选择手术切除。最终病理也与预测非常一致。
排版编辑:肿瘤资讯-HYC











 苏公网安备32059002004080号
苏公网安备32059002004080号


