肿瘤靶向治疗及免疫治疗极大地促进了精准治疗的发展。肿瘤个体化治疗有赖于精确的肿瘤伴随诊断(companion diagnostic,CD)。伴随诊断能够为肿瘤患者提供针对治疗药物疗效反应的信息。在临床治疗决策之前,往往需要对特定肿瘤组织生物标记物进行检测,进而筛选获益患者,制定个体化治疗方案。传统的肿瘤病理诊断模式依赖于诊断医师的经验,不可避免具有一定的主观性。随着数字化扫描切片在临床病理中的应用,人工智能(artificial intelligence,AI)辅助诊断的计算机技术在肿瘤组织图像分析中快速发展。本文概述AI在肿瘤病理中的应用进展,并阐述近年来AI在临床诊疗密切相关的组织病理分子标志物定量分析领域的探索及应用,从而为肿瘤智能诊疗模式的发展提供有益的参考。
数字病理与深度学习
全病理切片数字扫描是一种现代数字系统与传统光学显微放大装置有机结合的技术,其通过全自动显微镜扫描采集获得高分辨率的数字图像,并应用计算机量化组织切片扫描图像的形状、大小和颜色等信息,从而得到虚拟的全切片数字图像(whole slide image,WSI)。数字扫描技术推动传统病理图像的数据收集和观察模式发生变化,数字病理(digital pathology,DP)的概念由此产生。DP系统目前已广泛应用于临床诊断、远程会诊及数据分析等病理学领域。不仅如此,DP图像包含大量的像素级数字信息,从而为使用计算机工具辅助分析肿瘤组织的形态特征提供了应用基础。
在过去的几十年里,图像处理领域的AI算法已从传统的机器学习(machine learning,ML)逐渐发展为深度学习(deep learning,DL)。DL是ML的一个重要的分支,起源于人工神经网络的研究,通过堆叠层结构形成一个深度前馈神经网络,从而将低层特征组合成更加抽象的高层特征。相比其他ML算法,DL对图像数据的特征提取能力更强。其中,深度卷积神经网络是组织病理图像计算机识别中常用的网络结构之一,能够将扫描获取的数字化病理图像进行特征提取及分析,从而将肿瘤病理诊断与计算机技术有机结合,进行目标检测、分类诊断和定量分析等病理诊断任务的输出(图1)。目前,DL在肿瘤分类、细胞检测、突变预测及预后分析等方面取得了显著的进展,从而为临床肿瘤病理提供了新的诊断模式。
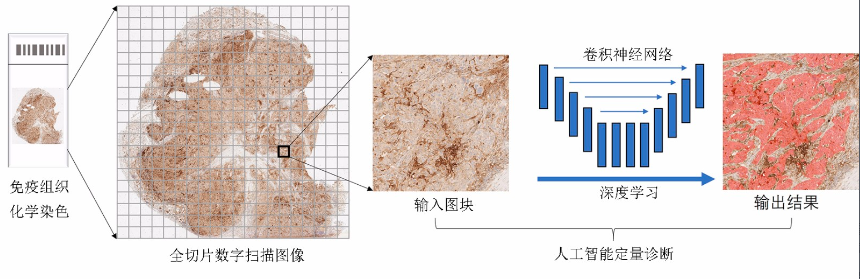
AI在肿瘤组织标志物定量分析中的应用

免疫组织化学(immunohistochemistry,IHC)染色作为检测肿瘤蛋白表达水平的最常用技术方法,常用于确定肿瘤的分类、预后分级、药物治疗的靶点及预测药物治疗的反应等,从而为临床的诊疗策略提供组织病理学的筛选依据[1]。在临床开展治疗之前,检测一些肿瘤分子病理标记物的表达状态已成为必要条件。目前AI应用研究相对较多且具有代表性的肿瘤组织分子指标,如人表皮生长因子受体-2(Her-2)、细胞增殖相关抗原(Ki-67)及细胞程序性死亡配体-1(PD-L1)的图像分析。
2.1 Her-2
在乳腺癌中,评估Her-2蛋白表达和基因扩增状态对乳腺癌的临床用药至关重要。指南推荐采用IHC法检测Her-2蛋白的表达水平或应用荧光原位杂交技术(FISH)检测Her-2基因的扩增水平,两种检测方式相互补充。Her-2在IHC染色切片上通常表现为膜着色,病理医师通过观察肿瘤细胞的阳性比例及着色强度,对Her-2进行综合评分以指导靶向治疗。然而,实践研究表明这种Her-2的人工评分具有主观性,容易出现诊断医生之间的差异。
AI技术在Her-2判读分析中的应用较早,目前有不少应用于乳腺癌Her-2检测的数字分析软件平台。Tuominen等提供了一个Her-2在IHC分析软件─ImmunoMembrane。该研究采用颜色反卷积分离细胞膜阳性,根据膜染色强度和完整性生成定量评分。Brugmann等开发了HER2-CONNECTTM软件用于乳腺癌Her-2的数字图像分析,基于评估细胞膜连续性的算法以评估Her-2的IHC染色结果,在训练集上的总体一致性为92.1%,在验证集上的总体一致性为92.3%。Saha等提出了一种基于DL的Her2Net,能够对Her-2染色进行自动化评估,该模型实现了高准确率和仅6.84%的假阳性率。2016年举办的PathSoc大会上,针对Her-2评分系统进行了算法之间及计算机与病理专家之间的“人机比对”竞赛。参与竞赛的算法模型通过对86例乳腺癌Her-2的数字扫描图像进行分析进而评估表达结果,与病理专家具有高度的可比性。
Her-2在肿瘤细胞中可染色成完整的膜阳性或仅部分膜阳性。针对Her-2染色异质性的特点,Tewary等使用校正的白平衡对输入图像进行预处理,并使用CMYK和RGB色彩空间提取苏木素和肿瘤细胞膜上的二氨基联苯胺(diaminobenzidine,DAB)染色。对于每个染色通道进行分割和后处理生成掩模。随后使用骨骼化和形态学方法对掩模按照完整或不完整膜染色进行计数。此外,在Her-2荧光图像分析中,Hofener等提出了一种基于密度的方法来量化FISH信号,用于计算和确定Her-2与CEP17信号的比率,从而输出Her-2荧光染色判读结果。该研究表明,AI不仅能够应用于IHC图像,也可应用于荧光染色数字图像的自动化分析。
计算机辅助诊断在Her-2染色评分算法的应用表明了AI对分子病理指标进行精确定量评分方面的巨大潜力。Yue等的多中心应用测试表明,使用基于细胞级分类的Her-2评分算法和显微镜实时增强现实系统,可以显著提高病理医生对Her-2评估的准确性和可靠性。Vandenberghe等的研究显示,AI辅助诊断可以通过识别误诊风险高的病例以及显著减少人工评分主观性带来的偏差,进而辅助乳腺癌的临床诊疗。除乳腺癌外,Her-2也广泛使用于胃癌等肿瘤靶向治疗获益患者的筛选,但目前在其他癌种中AI判读Her-2的研究鲜见报道。
2.2 Ki-67
Ki-67作为肿瘤增殖指数的指标,常应用于评估肿瘤的生长活性及肿瘤分级。在胃肠道神经内分泌肿瘤(neuroendocrine neoplasm,NEN)中,Ki-67的定量读数作为分级标准,对后续肿瘤的治疗及预后预测起着关键的指导作用。临床实践通过人工读数Ki-67阳性的肿瘤细胞比例进行肿瘤的分级,但可重复性并不理想。
目前,针对Ki-67的IHC检测结果判读方法,包括显微镜下视觉评估、人工手动计数、采集图像半自动判读以及数字图像全自动判读。在NEN中的Ki-67数字图像与人工对比研究的结果表明,计算机辅助诊断效果要优于单纯的显微镜下人工视觉判读。在乳腺癌中,Voros等通过数字化计数方法评估乳腺癌活检数字图像上的Ki-67指数,然后在相同图像上叠加网格进行计数,结果显示通过数字图像计数可显著提高Ki-67 指数分析的可重复性。国内有研究应用Nuclear 9.0软件对细胞核的Ki-67染色进行分析,发现计算机辅助阅片与人工阅片一致性较好且具有省时、客观性好、易质控、重复性好等优势。
通过计算机辅助图像定量分析Ki-67可用于预后相关研究。Dirican等使用ML方法对Ki-67评分及预后因素进行聚类分析,表明Ki-67评分是一种与乳腺癌预后及其对新辅助化疗反应相关的实体肿瘤增殖标志物。Wang等采用人工常规方法和计算机辅助图像分析方法计算159例肺神经内分泌肿瘤手术标本Ki-67增殖指数,揭示区分低级别与高级别肺神经内分泌肿瘤的Ki-67指数临界值,用于预后预测。
由于Ki-67在肿瘤细胞及淋巴细胞、间质细胞等非肿瘤细胞中均可显示阳性。因此,计算机识别Ki-67阳性细胞类别的准确性和阳性标记自动计数是全自动判读的关键步骤。Niazi等采用迁移学习方法,通过在Ki-67染色切片图像中识别肿瘤边界,对Ki-67指数的自动判读具有较高的敏感性和特异性。Valkonen等利用细胞角蛋白(cytokeratin,CK)-Ki-67双重染色切片作为训练图像,开发了一种基于深度学习的数字掩模,用于自动检测和区分上皮细胞,具有良好的效果。计算机辅助Ki-67指数判读显示了定量分析结果和可重复性好等优势,但实现全自动分析,需要建立在良好的肿瘤细胞识别模型的基础上。
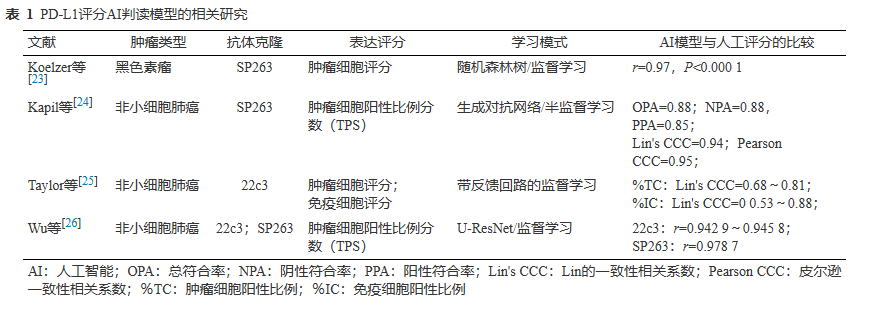
2.3 PD-L1
近年来,基于免疫检查点抑制剂的免疫治疗为肿瘤精准治疗带来了新的突破。IHC检测PD-L1的表达作为预测标志物已在国内外许多医院病理科中开展。染色结果通过病理医师半定量判读方式进行评估,以指导肿瘤患者免疫治疗获益人群筛选。由于PD-L1可在肿瘤细胞及多种免疫细胞中表达,阳性表达模式复杂,因此对PD-L1染色结果的判读具有较大的挑战性。多项实践研究表明,临床病理医师对PD-L1判读的一致性和可重复性均不足。同时,人工估算的方式常无法获取精确的PD-L1表达数值,在治疗过程中可能存在疗效的异质性差异,上述问题给目前临床免疫治疗带来了新的挑战。
相对于病理医生在光学显微镜下的视觉判读,有多项研究尝试建立一种基于数字切片和AI技术定量评估 PD-L1 表达评分的方法(表1)。Koelzer等使用随机森林树的监督学习方法,在黑色素瘤的PD-L1染色数字图像中定量分析肿瘤细胞的PD-L1评分,其结果与病理医生在显微镜下对PD-L1的评分具有高度一致性(r=0.97,P<0.0001),同时数字图像分析能够降低PD-L1人工分析的差异。Kapil等使用生成对抗网络的半监督方法通过整合人工标注以及多位病理专家评测结果构建定量评估PD-L1肿瘤细胞表达评分的模型,对270例晚期非小细胞肺癌针吸活检标本进行PD-L1表达的自动化评分,结果显示该模型与人工评分具有良好的一致性。Taylor等使用带反馈回路的监督学习在230例非小细胞肺癌中构建了肿瘤细胞和免疫细胞评分的模型,该模型在肿瘤细胞/免疫细胞评分与病理专家的评测结果方面一致性良好。肿瘤细胞评分:Lin's相关系数0.68~0.81;免疫细胞评分:Lin's相关系数0.53~0.88。Wu等通过基于U-ResNet结构的全卷积神经网络模型进行肿瘤细胞分割,建立良好的肿瘤细胞自动识别模型并进行膜阳性评估和计算,从而输出具体肿瘤细胞阳性比例评分(TPS)数值。该结果在PD-L1抗体22c3和SP263测试集中,AI系统的TPS评分结果与受培训病理医生之间具有良好一致性(22c3:r=0.9429~0.9458;SP263:r=0.9787)。同时,AI辅助诊断测试显示,在AI系统的辅助下未培训普通病理医生的组内一致性和诊断效率显著提高。
上述研究表明,DP分析及利用ML方法可以精准地获取PD-L1的染色评分,同时在可重复性和诊断效率方面显示出了优势,这或许是克服免疫治疗时代免疫病理指标判读困难的有力工具。
AI在肿瘤组织标志物诊断中的优势及挑战
随着肿瘤组织染色技术和DP的快速发展,AI在处理高通量、多维度图像信息方面的优势逐渐显现,为肿瘤诊治带来新的机遇。肿瘤伴随诊断标志物与治疗决策紧密相关,临床实践对这些标志物的判读标准通常较为严格,判读医生通常需要多次培训。尽管人为制定了一系列人工判读的阈值标准,然而传统诊断模式仍依赖于诊断医师的经验,不可避免具有一定的主观性。同时,组织标志物的判读通常比较耗时费力,极大地增加了肿瘤诊断负荷,也对诊断医师提出了较高的挑战。AI辅助的肿瘤病理诊断具有自动化、效率高和可重复性高等特点,尤其对组织病理标志物能够实现定量化判读,进而提升肿瘤伴随诊断的客观性及精确性。同时,AI图像分析结果在不同医院和检测中心更容易共享和重复,进而协助诊断医师在病理指标检测和判读方面进行标准化的制定,并减轻日常诊断负荷。因临床精准治疗的迫切需求,对组织标志物的AI辅助定量分析可能是临床执行应用的一个重要方面,很可能在不久的将来成为临床诊断辅助工具中的一部分。
AI在组织病理标记物定量分析领域实现临床应用,仍然需要解决许多问题,如模型构建过程中标注的数据量、肿瘤染色和扫描图像数据的质量控制、细胞精确分割等。DL有多种学习模式,通常包括监督学习、无监督学习和半监督学习等。目前,通过病理医生的人工标注进行有监督的ML是比较常用的方法,但这种方法需要大量高质量的专业注释图像,研究实践中有一定的困难。一些ML模式如主动学习和弱监督学习算法在减少病理图像数据对人工标注的需求方面同样取得了较大的进展。
由于DL算法模型具有“黑盒子”性质及临床疾病的复杂性,计算机模型系统目前仍不能完全代替实际临床实践。大部分现有AI模型仅限于小样本集的训练和测试。尽管这些模型在有限的数据集显示出与专家评估良好的一致性,但临床实践中,这些AI算法和诊断系统是否可行,仍有待真实世界的临床观察。针对临床应用级图像开发的计算机模型需要确切的临床流程进行验证。
结语与展望

肿瘤病理标志物评估的准确性及客观性对于肿瘤诊断及临床治疗决策至关重要。目前基于DL的AI技术与数字病理相结合,可使诊疗相关的肿瘤组织生物标记物的评估更具重复性和可靠性。将组织标记物染色切片扫描构成与精准治疗紧密相关的DP图像集合,并构建相应的AI判读系统,将是构建肿瘤智能精准诊疗体系的重要方向。计算机专家、肿瘤医生和病理医生需要紧密协作,根据临床诊疗的具体需求开发更有针对性的肿瘤分子病理标志物的模型算法,运用大样本病例数据验证并制定相应的临床质控流程,从而实现肿瘤组织标记物的智能伴随诊断模式。
引用本文:张艳辉, 吴江华, 孙保存. 人工智能在肿瘤组织病理标志物分析中的应用进展[J]. 中国肿瘤临床, 2022, 49(14): 743-747. doi: 10.12354/j.issn.1000-8179.2022.20211725
来源:病理报告
排版编辑:肿瘤资讯-Astrid











 苏公网安备32059002004080号
苏公网安备32059002004080号


