
肝细胞癌(hepatocellular carcinoma, HCC)是一种临床常见、预后极差的恶性肿瘤。手术切除是HCC患者获得根治性治疗进而实现长期生存的首选方式[1];然而,由于起病隐匿,大多数患者首诊时已经进展到中晚期,或者合并较为严重的慢性肝病、肝硬化等,首次诊断时只有不到30%的HCC患者适合接受根治性治疗[1]。对于这些中晚期HCC患者,以抗血管小分子靶向药物、免疫检查点抑制剂等为代表的系统治疗,以及与肝动脉灌注化疗(HAIC)等局部治疗的联合,是他们重获根治性手术机会、降低术后复发和改善预后的重要手段[1,2]。本期由山东大学齐鲁医院普外科李康帅医生为大家分享并解读一则病例,该病例为“替雷利珠单抗+仑伐替尼”靶免治疗联合肝动脉灌注化疗(HAIC)转化治疗IIb期HCC实现R0切除和病理学完全缓解(pCR)的真实案例,患者后续还将有望在术后辅助治疗(“替雷利珠单抗+仑伐替尼”靶免联合方案)中进一步获益。
点评专家
山东大学齐鲁医院
普外科主任 主任医师 山东大学教授
山东大学胆道肿瘤研究中心主任
山东省医学会外科学分会胆道学组组长
专家介绍
山东大学齐鲁医院
普外科
中国微循环学会肿瘤专业委员会 秘书
山东医药教育协会外科手术学专委会 委员
山东省疼痛医学会临床营养与支持治疗专业委员会 委员
主持国家自然科学基金1项,自然科学基金1项
发表第一/通讯作者SCI论文12篇
病例详情
01基本情况
患者男性,69岁。
主诉:发现肝内占位性病变1月余。
现病史:患者1月余前因厌食、纳差伴明显消瘦就诊于外院,行上腹部增强CT示:肝内占位性病变,考虑恶性肿瘤,请结合病理学检查;肝多发囊肿,左肾囊肿。现患者为求进一步治疗,来我院就诊,门诊以“肝肿瘤”收入院。患者自发病以来,睡眠可,大便正常,小便尿频,夜尿增多。
既往史:既往有慢性乙型病毒性肝炎病史10余年,未行诊治。有高血压病史多年,平时口服“硝苯地平缓释片”治疗,血压控制在160/90mmHg左右。
个人史:生于原籍,无外地久居史,未到过疫区。吸烟30余年,20支/天,适量饮酒,已戒酒2月。
家族史:否认家族性遗传病及传染病病史。
体格检查:未见阳性体征,ECOG评分:1分。
02辅助检查
入院(基线)实验室检查:
肿瘤标志物检查:甲胎蛋白:649.50ng/mL,甲胎蛋白异质体:97.01ng/mL,异常凝血酶原:>1,000,000ng/mL。
生化检查:肝肾功能均正常。
凝血功能:正常。
乙肝定性:小三阳。
2023-02-13腹部强化CT检查示:肝内多发占位性病变,考虑恶性肿瘤,肝细胞癌可能性大。
 2023-02-13腹部强化CT检查影像
2023-02-13腹部强化CT检查影像
03临床诊断
原发性肝癌(CNLC Ⅱb期)
慢性乙型病毒性肝炎
高血压病 3级 极高
肝囊肿
肾囊肿
04治疗经过
鉴于该肝癌患者有多个瘤灶,总体占位体积较大(长径达19cm),全部切除后可能发生剩余肝体积(FLR)不足,另外一方面,首选手术切除难以保证足够的手术切缘和R0切除,于是我们决定先对患者施行转化治疗,拟定治疗方案为:采取“HAIC+靶向治疗+免疫治疗”的转化治疗方案,以争取实现根治性切除。
1.转化治疗
于2023-02-13给予首次HAIC行局部治疗,同时行“仑伐替尼+替雷利珠单抗”系统治疗,具体用药为:仑伐替尼 8mg po qd+替雷利珠单抗 200mg ivgtt q3w。
随后分别于2023-03-08、2023-04-03、2023-05-14、2023-06-16多次实施上述“局部治疗+系统治疗”方案,除了在第三次治疗期间出现甲状腺功能减退(服用甲状腺素片后好转)之外,未见其他任何明显不良反应,患者耐受性良好。
治疗期间多次复查肿瘤标志物检查,见甲胎蛋白、异常凝血酶原等水平迅速下降,并维持在较低水平。

 转化治疗期间甲胎蛋白、异常凝血酶原等肿瘤标志物变化趋势
转化治疗期间甲胎蛋白、异常凝血酶原等肿瘤标志物变化趋势
2023-06-16行腹部强化CT检查示:瘤灶较治疗前明显缩小,呈大面积肿瘤坏死表现。疗效评估为部分缓解(PR)。
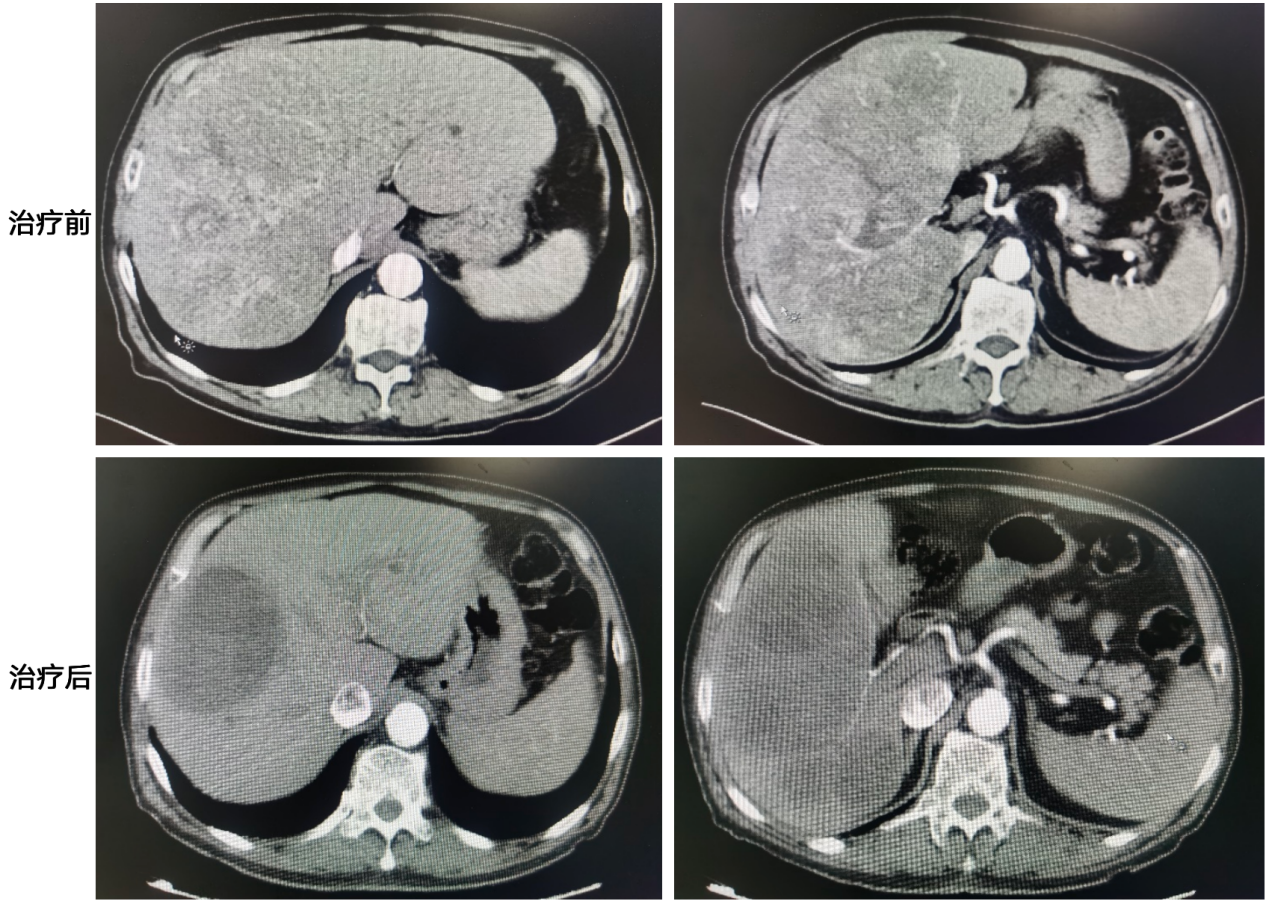 转化治疗前(2023-02-13)、治疗后(2023-06-16)腹部CT影像对比
转化治疗前(2023-02-13)、治疗后(2023-06-16)腹部CT影像对比
2.手术治疗
鉴于患者目前转化治疗效果佳,影像学疗效评估达PR,已具备R0切除的条件,遂于2023-07-18行“右半肝切除+胆囊切除术”,手术过程顺利,术后患者恢复良好,未出现任何手术并发症。
 手术标本送检图片,肿瘤多剖面剖开,肉眼观已全部坏死
手术标本送检图片,肿瘤多剖面剖开,肉眼观已全部坏死
病理化验报告示:未查见存活肿瘤细胞,切缘未查见肿瘤。提示实现了R0切除并达到pCR。
 病理化验报告单
病理化验报告单
下一步治疗计划:拟术后1月左右,肝功能恢复至正常水平后开始 “替雷利珠单抗+仑伐替尼”靶免联合术后辅助治疗,持续6个月,以求降低肿瘤复发率,争取实现患者长期无瘤生存。
从开始转化治疗到手术,再到后续治疗计划和预期结局的整体过程如下:

疗效评估:替雷利珠单抗+仑伐替尼联合HAIC转化治疗IIb期HCC实现R0切除、pCR,并有望在术后辅助治疗中实现肿瘤持续缓解、患者长期获益。
不良反应:除轻度甲状腺功能减退(服用甲状腺素片后好转)之外,患者治疗期间未出现其他任何明显不良反应,整体安全性可控。
病例总结
HCC在我国是一种高发病率(占全球的一半以上)、高致死性(仅次于肺癌)的恶性肿瘤[3]。有数据显示,中国约64%的HCC患者初诊时已至 CNLC Ⅱ期和Ⅲ期,绝大多数已不宜首选手术治疗[2,4]。HCC不可切除的原因在于不能实施安全的手术切除,包括肝功能无法耐受、FLR不足;或无法保障切缘阴性、病灶无残留[4]。而转化治疗是指对于评估为不可切除的HCC患者经干预手段转化为可切除,既包括将FLR不足等外科学意义上的不可切除转化为可切除,也包括将R1、R2切除转化为R0切除[4]。在转化治疗方案的选择中,系统治疗与局部治疗相结合的方式被认为更有利于减瘤降期、提升转化成功率[2]。此外,学者普遍认为,对于肿瘤负荷集中在肝内的HCC患者,HAIC具有更高的肿瘤缓解率,且靶向和免疫治疗联合 HAIC可获更高的转化率[2]。该例HCC患者瘤体巨大(多个瘤灶连成一大片,直径达19cm),虽然患者的肿瘤分期(IIb期)仍较早、患者一般情况良好(ECOG评分:1分),但直接行手术切除可能难以保证足够的手术切缘,而且存在FLR不足的问题。为保证手术安全性和提升R0切除率,基于上述证据,我们采取了“靶向治疗+免疫治疗”系统抗肿瘤治疗联合HAIC局部治疗的转化治疗方案。
在免疫治疗药物的选择中,国产PD-1免疫检查点抑制剂替雷利珠单抗因具有疗效突出、安全性好、价格合理、可及性高等多方面优势而得以在临床上广泛应用并深受医生、患者青睐。RATIONALE-301研究证实了替雷利珠单抗单药治疗不可切除HCC可实现强力缩瘤和深度缓解,其数据显示:替雷利珠单抗治疗组患者的中位总生存期(mOS)为15.9个月,客观缓解率(ORR)为14.3%,其中完全缓解(CR)率是索拉非尼组的10倍(2.9% VS 0.3%);替雷利珠单抗组持续缓解时间(DoR)高达36.1个月,是索拉非尼组(11.0个月)的3倍之多[5]。BGB-A317-211研究则彰显了替雷利珠单抗联合靶向药物治疗不可切除HCC的价值:在该研究中,替雷利珠单抗联合靶向药物治疗组患者的ORR约38.7%,疾病控制率高达90.3%,中位无进展生存期(mPFS)达9.6个月;且两药联合≥3级TRAEs发生率仅为28.1%[6]。
该案例中的HCC患者经过“替雷利珠单抗+仑伐替尼”联合HAIC方案的积极转化治疗,成功实现了R0切除,并达到pCR,为患者后续长期无瘤生存创造了有利条件。不仅如此,在整个治疗期间,患者除了发生轻度甲状腺功能减退,并在服用甲状腺素片后好转之外,未再出现其他任何明显不良反应,安全性可靠、患者耐受性良好。另外,为了尽可能地遏制术后复发,依据《肝癌转化治疗中国专家共识(2021版)》的推荐[2],我们拟在术后1个月左右,待肝功能恢复至正常水平后,沿用原系统治疗方案(替雷利珠单抗+仑伐替尼)实施术后辅助治疗,并将持续治疗6个月。期待见证该患者更长期的无瘤生存状态,也希望替雷利珠单抗能够在系统治疗、以及“系统治疗+局部治疗”的联合治疗中,带给更多中晚期HCC患者更显著和更持久的获益。
[1]中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(4):367-388.
[2]中国抗癌协会肝癌专业委员会转化治疗协作组, 樊嘉. 肝癌转化治疗中国专家共识(2021版)[J]. 中华消化外科杂志, 2021, 20(6):600-616.
[3]国家科技部传染病防治重大专项课题《病毒性肝炎相关肝癌外科综合治疗的个体化和新策略研究》专家组, 陈孝平, 沈锋,等. 肝细胞癌肝切除术后复发预防和治疗中国专家共识(2020版)[J]. 中国实用外科杂志, 2021,41(1):20-30.
[4]中国医疗保健国际交流促进会肝脏肿瘤分会,中国医学科学院北京协和医学院肿瘤医院消化道肿瘤多学科协作组,赵海涛,等.肝细胞癌新辅助及转化治疗中国专家共识[J].肝癌电子杂志, 2022, 9(1):23-28.
[5]Masatoshi Kudo, et al. Final analysis of RATIONALE-301: Randomized, phase III study of tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. 2022 ESMO.LBA36.
[6]Minshan Chen, et al. Efficacy and safety of tislelizumab (TIS) plus lenvatinib (LEN) as first-line treatment in patients (pts) with unresectable hepatocellular carcinoma (uHCC): a single-arm, multicenter, phase II trial. 2022 ESMO IO Abstract 165P.
排版编辑:肿瘤资讯-Riddy











 苏公网安备32059002004080号
苏公网安备32059002004080号


