
潘振宇, 宋媛媛, 姜同超, 等. 培美曲塞鞘内化疗治疗实体肿瘤脑膜转移的临床研究[J]. 中华肿瘤杂志, 2022, 44(1):112-119.
DOI: 10.3760/cma.j.cn112152-20200711-00647.
目的
探讨培美曲塞鞘内化疗治疗实体肿瘤脑膜转移的可行性、安全性及反应性。
方法
选取2017—2018年于吉林大学第一医院采用培美曲塞鞘内化疗的47例患者。培美曲塞鞘内化疗研究采用经典剂量爬坡研究模式,纳入13例既往经过鞘内化疗等多种治疗后复发难治的非小细胞肺癌脑膜转移患者。基于剂量爬坡研究,进行培美曲塞一线鞘内化疗联合放疗临床研究,纳入未接受过鞘内化疗的实体肿瘤脑膜转移患者34例。生存分析采用Kaplan-Meier法和Log rank检验,影响因素分析采用Cox回归模型。
结果
剂量爬坡研究显示,培美曲塞鞘内化疗最大耐受剂量为单次10 mg,推荐给药方案为10 mg,每周1~2次给药。10例发生不良反应,包括血液学不良反应(7例)、转氨酶升高(2例)、神经根反应(5例)及乏力和体重下降(1例);4例发生严重不良反应,包括4~5级血液学不良反应(2例)、4级神经根刺激症状(2例)和4级转氨酶升高(1例)。剂量爬坡研究治疗有效患者为4例,疾病控制患者7例,生存时间为0.3~14.0个月,中位生存时间为3.8个月。培美曲塞鞘内化疗联合放疗临床研究显示,每周1次10 mg培美曲塞鞘内化疗,联合同步受累区放疗40 Gy/4周的治疗模式具有较高的安全性及反应性。主要不良反应发生率为52.9% (18/34),包括血液学不良反应(13例)、转氨酶升高(10例)和神经根反应(4例)。研究2患者治疗反应率为67.6% (23/34),疾病控制率为73.5% (25/34),总生存时间为0.3~16.6个月,中位生存时间为5.5个月,1年生存率为21.6%。临床治疗反应、神经功能障碍改善、完成同步治疗、后续进行系统治疗与总生存有关(均P<0.05)。
结论
培美曲塞适用于鞘内化疗给药,具有较高的安全性及反应性。推荐给药方案为单次剂量10 mg,每周1~2次。血液学不良反应为影响培美曲塞鞘内化疗实施的主要因素,应用维生素补充可有效控制血液学不良反应发生。
【关键词】恶性实体肿瘤; 脑膜转移; 培美曲塞; 鞘内化疗
脑膜转移是肿瘤细胞进入蛛网膜下腔及脑脊液,造成全中枢播散的恶性肿瘤中枢转移特殊模式,是恶行肿瘤的致死性并发症。鞘内化疗是脑膜转移的主要治疗方法之一。鞘内化疗能够使用的药物有限,传统经典药物包括甲氨蝶呤、阿糖胞苷和塞替哌的疗效及安全性尚不理想。近年来有研究者使用脂质体阿糖胞苷、依托泊苷或拓扑替康等药物进行鞘内化疗,但与传统鞘内化疗药物比较,并未显示出明显优势。培美曲塞已被证实在肺癌、乳腺癌、恶性胸膜间皮瘤和中枢淋巴瘤等多种恶性肿瘤治疗中有效,为非鳞非小细胞肺癌一线化疗药物。自2017年始,我们进行了2项培美曲塞鞘内注射化疗的前瞻性临床研究,探索了其耐受性、安全性、给药方案以及临床反应性。本研中,我们通过探讨培美曲塞鞘内化疗的给药剂量以及安全性,以期推进培美曲塞鞘内化疗的临床应用开展,为恶性实体瘤脑膜转移患者带来新的治疗选择。


1.临床资料:
收集2017年3月至2018年12月于我院使用培美曲塞二钠(商品名:力比泰,ALIMTA;美国礼来公司,产地:法国)鞘内化疗患者的临床资料。研究1为培美曲塞鞘内化疗用于治疗复发难治性非小细胞肺癌脑膜转移Ⅰ期临床研究,研究2为培美曲塞鞘内化疗联合受累区放疗用于恶性实体瘤脑膜转移一线治疗的临床研究。本研究通过吉林大学第一医院医学伦理委员会批准(审批号2017-0246:18K017-001),注册于ClinicalTrials.gov (https://register.clinicaltrials.gov),注册编号分别为IPRLM,NCT03101579;IPLM,NCT03507244。
2.研究设计:
研究1为剂量爬坡研究。研究目标为观察培美曲塞鞘内化疗的耐受性和安全性,寻找耐受剂量及鞘内给药剂量方案。由于培美曲塞鞘内给药的安全性及反应性未知,因此,研究对象选择为经过鞘内化疗等多种脑膜转移治疗后进展复发难治性肺腺癌脑膜转移患者。研究1采用经典的0/3、1/6分组剂量爬坡研究模式,单次给药初始剂量为10 mg,随后每组增加5 mg,同时每次鞘内注射地塞米松5 mg。治疗方案为先行诱导治疗,每周2次,连续2周,共4次;随后行每周1次巩固治疗。鞘内化疗共不超过8次(6周)。剂量限制性不良反应规定为3级或以上中枢神经不良反应(化学性脑膜炎)及其他任何4级或以上不良反应。不良反应评价依据为常见不良反应事件评价标准4.03,治疗反应评价采用神经肿瘤评价(Response Assessment in Neuro-Oncology, RNAO)标准。自愿同意采集血液样本(用于药代动力学研究)的患者签署同意书,每次鞘内化疗前采集脑脊液以及鞘内化疗后0~24 h血液标本进行药代动力学研究。
研究2在研究1推荐的给药方案基础上,将培美曲塞作为一线鞘内化疗药物并联合放疗治疗。研究目标为观察培美曲塞鞘内化疗联合放疗治疗的耐受性、安全性及反应性。研究对象为既往未曾应用鞘内化疗的恶性实体瘤脑膜转移患者。培美曲塞鞘内化疗单次剂量为10 mg,同时给予地塞米松5 mg鞘内注射。治疗开始时肌肉注射1000 μg维生素B12,口服400 μg叶酸/d,直至末次鞘内化疗后21 d。患者首先接受诱导鞘内化疗,3 d内开始接受同步放疗,放疗区域为神经影像学证实的中枢神经系统受累区以及脑膜转移相关神经系统症状区,包括全脑或区段椎管。放疗剂量为40 Gy,20次/4周,每周5次。放疗中,给予每周1次鞘内化疗,共4次(周)。对于脑膜转移病情严重、无法耐受放疗的患者,给予每周2次诱导鞘内化疗,待症状改善后开始同步放疗。经过3次鞘内化疗后,病情仍然进展或经过4次诱导治疗后,病情仍无改善,无法接受放疗的患者,则评价为无效,患者出组。研究纳入6例患者,如2例或以上发生剂量限制不良反应,则研究终止,否则,进一步入组28例患者。不良反应评价及治疗反应评价方法同研究1。
3.随访情况:
采用院内复诊及电话方式随访,收集患者的一般情况、神经系统症状及体征变化、神经影像学检查及脑脊液相关检查结果。研究1中,患者随访时间不少于4个月;研究2中,随访时间不少于8个月。研究1随访截至2019年1月31日,研究2随访至2019年8月1日,全组患者均获得随访。
4.统计学方法:
采用SPSS 17.0软件进行统计学分析。生存分析采用Kaplan-Meier法和Log rank检验,影响因素分析采用Cox回归模型,不同因素对临床治疗反应率的影响分析采用Fisher精确检验。检验水准α=0.05。


1.研究对象及治疗情况:
研究1和研究2共纳入47例患者,其中男19例,女28例,年龄37~73岁,中位年龄56岁。全组患者共给予培美曲塞鞘内化疗237次。
研究1纳入13例复发难治非小细胞肺癌脑膜转移患者,11例患者曾接受全脑放疗及鞘内化疗同步治疗,2例患者曾分别接受阿糖胞苷和甲氨蝶呤鞘内化疗;8例患者既往接受过复发挽救鞘内化疗,且对甲氨蝶呤或阿糖胞苷鞘内化疗无效;11例患者既往接受系统治疗(静脉化疗、口服化疗药物或靶向药物),系统化疗5例,靶向治疗11例。表皮生长因子受体(epidermal growth factor receptor, EGFR)突变10例,持续应用酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗;间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)突变1例,持续应用ALK抑制剂治疗。
研究1中,13例患者接受培美曲塞鞘内化疗2~8次,中位化疗次数为6次,共72次。11例患者完成诱导治疗;2例由于严重不良反应未完成诱导治疗。4例患者接受4次(周)巩固治疗;7例患者分别由于交通性脑积水、脑实质转移病灶进展、系统肿瘤进展、3~4级不良反应或个人等原因拒绝进一步治疗,接受0~3次巩固治疗。初始10 mg剂量组5例患者中,4级转氨酶升高1例,3级血液学不良反应2例。15 mg剂量组2例患者中,4~5级血液学不良反应2例,研究1中止。修改研究方案,降低给药剂量至10 mg,同时使用叶酸及维生素B12,纳入的6例患者中,3级血液学不良反应1例,4级神经根不良反应1例。根据剂量爬坡研究方案规定完成研究,培美曲塞鞘内化疗最大单次耐受剂量为10 mg,剂量限制不良反应为血液学不良反应、神经根反应和转氨酶升高。
研究2首先入组6例患者,均无剂量限制不良反应发生,进一步纳入28例患者。21例非小细胞肺癌患者中,EGFR突变15例,既往接受TKI治疗13例,包括第一代TKI治疗12例,第二代TKI治疗1例,第一代及第三代TKI治疗5例。接受培美曲塞鞘内化疗2~8次,中位化疗次数为5次,共165次。22例患者接受1次诱导鞘内化疗,随后开始同步治疗;12例患者由于中枢神经系统症状严重,接受2次或以上诱导鞘内化疗,其中,6例接受2次诱导化疗,4例接受3次诱导化疗,2例接受4次诱导化疗。10例患者症状改善,进一步接受同步放疗;2例患者接受了3~4次诱导鞘内化疗后病情未缓解,停止治疗,3~5 d死亡。32例接受同步放疗,其中,31例患者接受了全脑放疗,3例接受了区段椎管放疗。25例患者完成同步治疗,1例患者因3级血液学不良反应中断治疗5 d。7例患者分别由于原发或转移性肿瘤进展(3例)、原发或转移性肿瘤及脑膜转移进展(1例)、恶化脑水肿(1例)以及持续3级血液学不良反应(2例),未能完成同步治疗。研究2患者的临床特征见表1。

全组患者(研究1和研究2)中,入组前已持续应用分子靶向治疗药物的患者,在研究期间继续应用靶向治疗药物。具有严重神经系统症状的患者,接受了包括糖皮质激素、降颅压、营养支持等对症治疗。
2.不良反应发生情况:
研究1患者中(13例),10例发生不良反应,包括血液学不良反应(7例)、转氨酶升高(2例)、神经根反应(5例)及乏力和体重下降(1例);4例发生严重不良反应,包括4~5级血液学不良反应(2例)、4级神经根刺激症状(2例)和4级转氨酶升高(1例)。其中,10 mg剂量组未给予维生素治疗的5例患者中,4例发生不良反应,包括3级血液学不良反应(2例)、4级神经根反应及转氨酶升高(1例)、1~2级神经根反应(1例)和1级血液学不良反应(1例)。15 mg剂量组未给予维生素治疗的2例患者均发生4~5级血液学不良反应。10 mg剂量组给予维生素治疗的6例患者中,4例发生不良反应,包括4级神经根反应和2级血液学不良反应(1例),1~2级神经根反应(1例)、3级血液学不良反应和2级神经根不良反应(1例)及2级转氨酶升高(1例)。
研究2中的34例患者中,18例发生不良反应,包括血液学不良反应(13例)、转氨酶升高(10例)和神经根反应(4例)。研究2中全组患者均使用了维生素补充治疗。除10例患者因病情严重无法口服补充叶酸,其余24例患者均在治疗开始时补充维生素,仅1例发生4级血液学不良反应。
研究1和研究2结果显示,血液学不良反应为影响治疗方案实施的主要不良反应,包括白细胞减少及血小板减少。研究1中,白细胞减少7例,血小板减少6例;研究2中,白细胞减少8例,血小板减少11例。血液学不良反应主要发生于第1~4次鞘内化疗后。白细胞减少应用重组人粒细胞生长集落刺激因子对症治疗,血小板减少应用重组人白介素11及重组人血小板生成素对症治疗。80.0%(16/20)的血液学不良反应在对症治疗后1~2周内恢复;8例患者发生3级或以上血液学不良反应,4例暂停治疗,4例由于严重或持续的血液学不良反应治疗终止。研究2中,2例素食患者因持续性3级或以上血液学不良反应>10 d终止治疗。2例素食患者随后增加叶酸的补充剂量至800 μg/d,血液学不良反应在3~4周恢复。
转氨酶升高多发生于2~3次鞘内化疗后。对于2级以上转氨酶升高,给予还原型谷胱甘肽、甘草酸铵及双环醇治疗,转氨酶在1~2个月恢复至正常,并未影响治疗实施。值得注意的是,研究2中,1例乳腺癌患者完成放疗同步鞘内化疗后2周,出现2级转氨酶升高,给予对症治疗后恢复。3例患者发生3级转氨酶升高,其中2例接受了每周2次的诱导鞘内化疗3~4次。6例患者接受3~4次诱导鞘内化疗,其中2例发生3级转氨酶升高。28例接受不超过2次诱导鞘内化疗患者中,仅1例发生3级转氨酶升高。
研究1中,神经根反应发生者5例,研究2中为4例。研究1中的3~4级神经根刺激症状为2例,高于研究2(1例)。值得说明的是,研究1中1例患者第7次鞘内化疗后1 h出现4级神经根反应,表现为双侧髋部以下触觉及痛温觉(深浅感觉)丧失,肌力0级,病理征未引出,症状持续约2 h后开始自行缓解,感觉及肌力逐渐恢复,约5 h后恢复正常。随访3个月无远期相关不良反应发生,考虑为化疗药物造成的一过性神经功能障碍。
全组(研究1和研究2)患者中,无一例发生化学性脑膜炎,无腰椎穿刺所致感染性脑膜炎、出血和低颅压等并发症的发生。
3.治疗反应:
研究1中,治疗前患者卡氏体力状态评分(Karnofsky performance scale, KPS)为20~70分,中位KPS为40分;治疗后KPS评分为20~90分,中位KPS为70分。3例患者神经功能障碍改善,9例稳定,1例进展;11例患者神经系统症状缓解;10例患者治疗后复查脑脊液细胞学,均未转阴性。13例患者治疗后复查神经影像学检测显示,2例改善,6例稳定或无法确定,1例恶化,4例无法评价。根据神经功能障碍改善,脑脊液及神经影像学检查结果,按照RNAO脑膜转移评价标准,治疗有效患者为4例,疾病控制患者7例。给予和不给予维生素补充患者(分别为6和7例)治疗有效例数均为2例,疾病控制患者例数分别为3和4例。
研究2中,治疗前患者KPS为10~90分,中位KPS为40分;治疗后KPS评分为10~90分,中位KPS评分70分。18例患者治疗后神经功能障碍改善,12例稳定,4例恶化;28例患者原有神经系统症状改善。25例患者治疗后复查脑脊液细胞学检查,8例转阴性,17例稳定。25例患者治疗后复查神经影像学检查示,9例神经影像学结果改善,16例稳定或难以判定,其中包括4例治疗前后均未见脑膜转移相关神经影像学异常表现的患者。研究2患者治疗反应率为67.6%(23/34),疾病控制率为73.5%(25/34)。按照原发肿瘤病理类型分类,非小细胞肺癌治疗反应14例,小细胞肺癌为4例,乳腺癌为3例,其他肿瘤为50.0%(2/4)。疾病稳定2例均为非小细胞肺癌。4例患者疾病进展,包括非小细胞肺癌2例,乳腺癌1例,胃癌1例。
4.预后:
研究1中,7例患者治疗后继续应用原靶向药物,1例患者应用抗血管生成靶向药物治疗进展性系统肿瘤无效,1例患者应用贝伐单抗治疗脑水肿。研究1患者无神经系统进展生存时间为0.3~12.5个月,中位无神经系统进展生存时间为2.5个月,总生存时间为0.3~14.0个月,中位生存时间为3.8个月。12例患者死亡,其中,10例死因为肿瘤进展,包括脑膜转移和系统肿瘤进展9例,单纯原发或转移灶肿瘤进展1例;1例患者死因为治疗相关不良反应;1例患者死因为非肿瘤疾病。
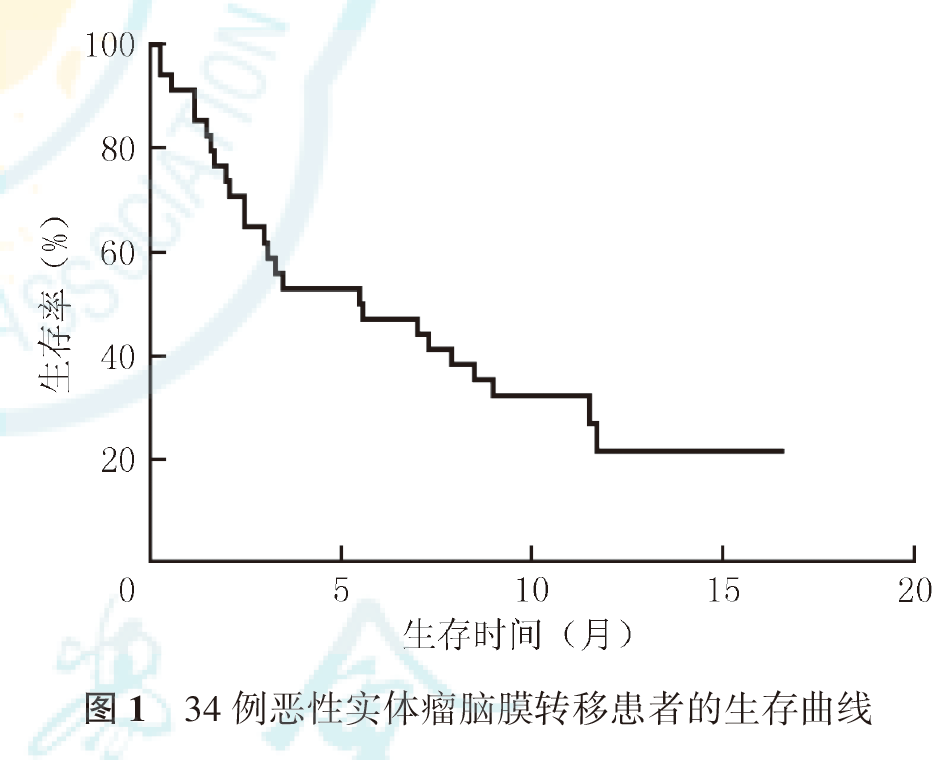
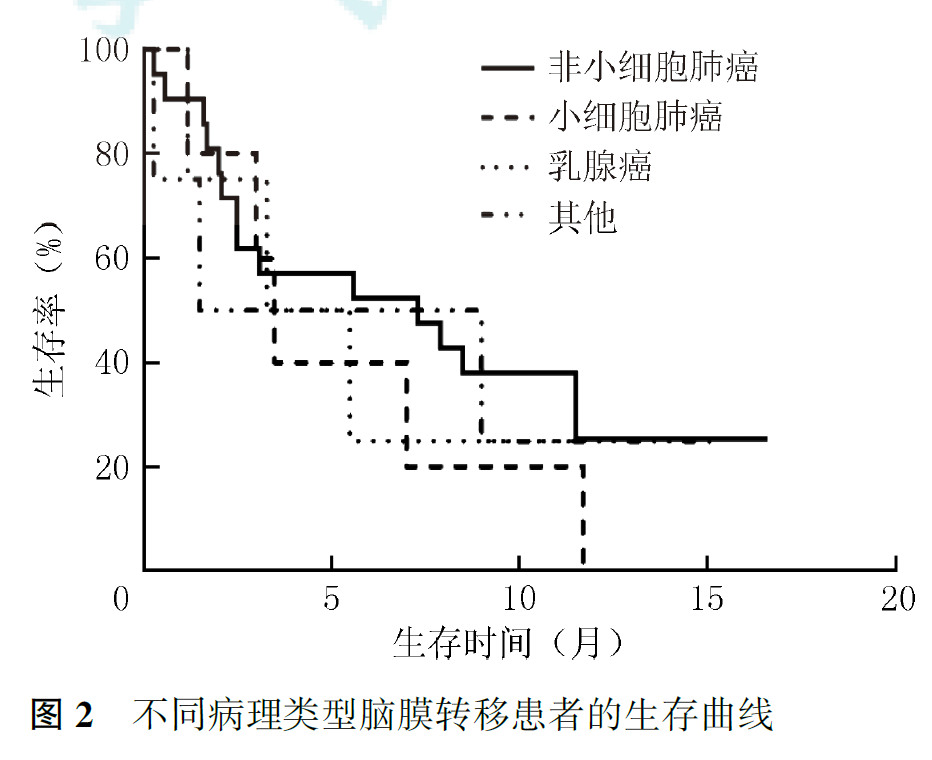
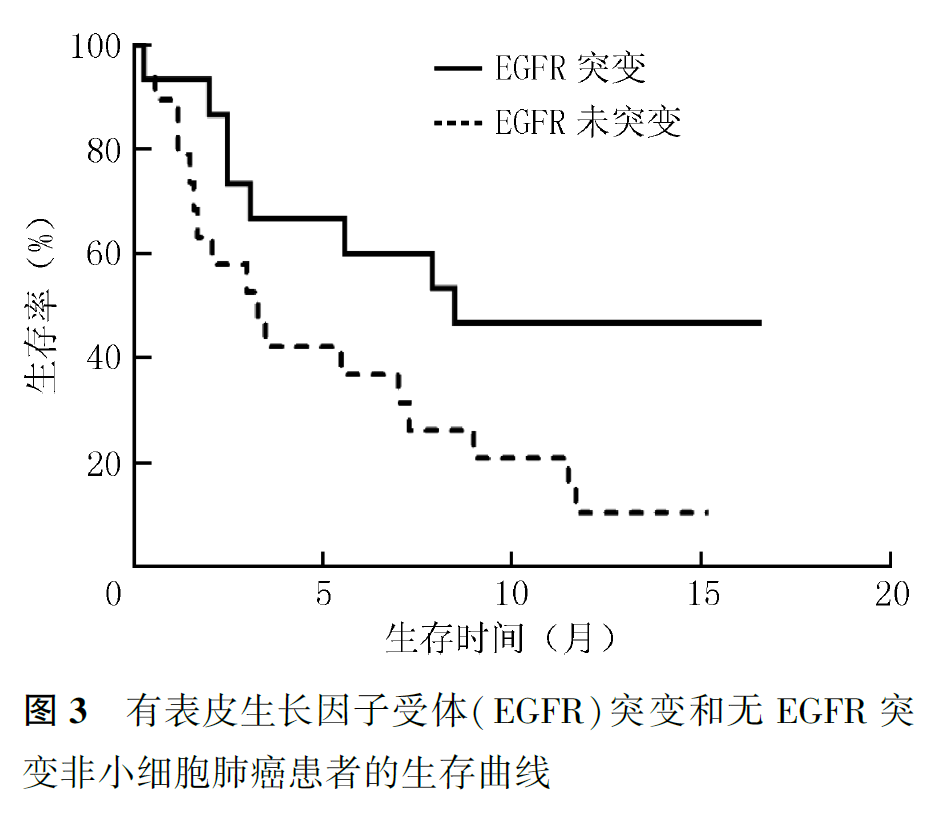
研究2中,21例患者接受后续治疗,其中6例接受系统化疗,15例接受靶向治疗,1例乳腺癌接受内分泌治疗。11例评价治疗有效的患者发生脑膜转移复发,其中6例患者接受挽救治疗(挽救鞘内化疗3例,更换第三代分子靶向药物3例),挽救性鞘内化疗首先选用甲氨蝶呤,治疗无效后,改用培美曲塞,病情缓解。采用靶向药物挽救治疗的3例患者应用160 mg奥希替尼治疗,2例无效,1例缓解。研究2患者无神经系统进展患者生存时间为0.3~15.2个月,中位无神经系统进展生存时间为3.5个月,总生存时间为0.3~16.6个月,中位生存时间为5.5个月(图1)。研究2患者1年生存率为21.6%,25例死亡,其中,23例死因为肿瘤进展,包括3例脑膜转移和原发或转移性肿瘤进展,12例脑膜转移进展,8例原发或转移性肿瘤进展;2例患者死因为非肿瘤疾病。非小细胞肺癌患者中位总生存时间为7.3个月,小细胞肺癌患者为3.5个月,乳腺癌患者为3.3个月,其他类型患者为1.5个月(P=0.826, 图2)。伴EGFR突变非小细胞肺癌患者与其他患者中位生存时间分别为8.5和3.3个月(P=0.052,图3)。
5.培美曲塞鞘内化疗药代动力学研究结果:
研究1全组患者均接受脑脊液药物浓度检测。脑脊液中培美曲塞浓度随着鞘内化疗进行呈现下降趋势。
6例接受10 mg剂量的患者在第3次或第5次鞘内化疗后,采集不同时段血液样本进行药物浓度检测,结果显示,血浆中药物浓度峰值出现在鞘内化疗后4.0~12.0 h,2例出现在鞘内化疗后4.0 h,2例患者在鞘内化疗后6.0 h,1例出现在鞘内化疗后9.0 h,1例出现在鞘内化疗后12.0 h。采用其中3例患者的结果进行计算显示,在鞘内化疗后,培美曲塞在血浆中的终末段半衰期分别为11.5、5.2和8.4 h。
6.影响因素分析:
单因素分析显示,临床治疗反应、神经功能障碍改善、完成同步治疗、后续进行系统治疗与总生存时间有关(均P<0.05,表2)。
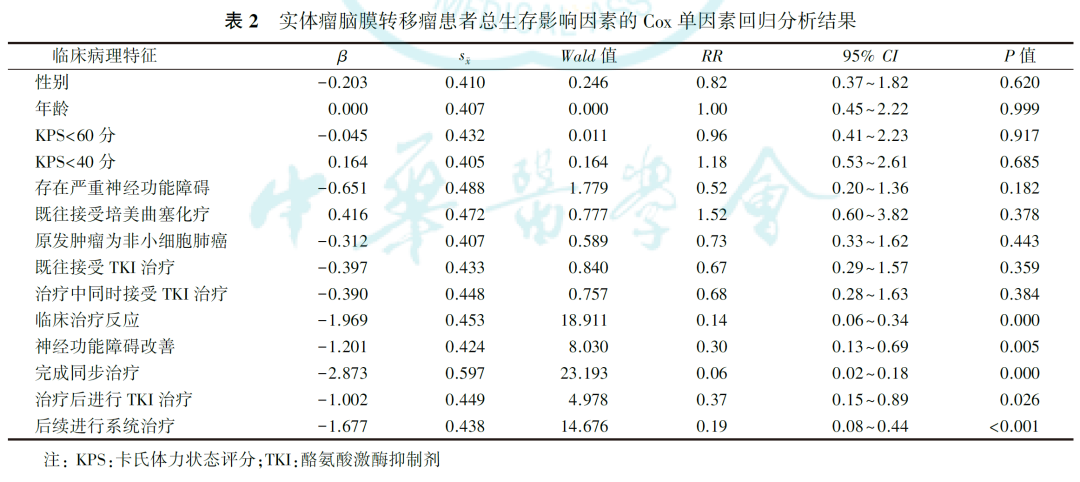
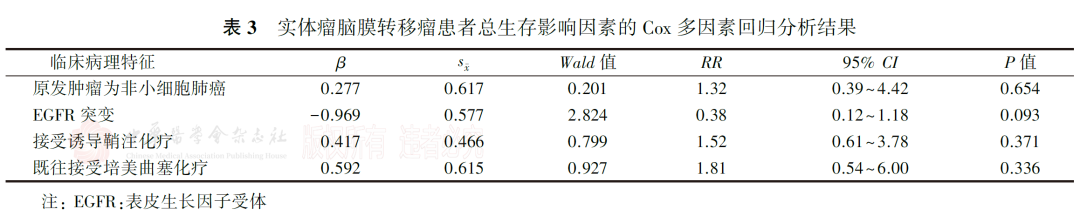
12例病情严重的患者接受了>1次诱导鞘内化疗,其生存时间短于仅接受1次诱导鞘内化疗的患者(分别为3.3和5.6个月, P=0.351)。脑脊液转阴及影像学转阴与总生存无关(均P>0.05)。多因素分析显示,原发肿瘤为非小细胞肺癌、EGFR突变、接受诱导鞘注化疗和既往接受培美曲塞化疗对患者总生存的影响差异无统计学意义(均P>0.05,表3)。


本研究采用经典的剂量爬坡模式观察培美曲塞鞘内化疗的耐受剂量及相关剂量限制不良反应,结果显示,培美曲塞鞘内化疗的单次给药剂量为10 mg,每周1~2次,对于实体瘤脑膜转移患者具有可接受的耐受性、安全性以及较好的治疗疗效。培美曲塞在脑脊液中显示出良好的抗肿瘤活性,无明显蓄积性。培美曲塞鞘内化疗,对于具有不良预后因素以及曾经接受过其他治疗后复发进展的难治性脑膜转移仍有疗效。
有研究者建立了培美曲塞鞘内化疗的大鼠动物模型,采用每周2次连续2周的给药模式,结果显示,5~10 mg为人体研究的起始给药剂量。培美曲塞静脉给药常规推荐剂量为500 mg/m2,血浆峰浓度为100~200 μg/ml。非小细胞肺癌细胞系体外研究显示,半数抑制浓度(half inhibition concentration, IC50)值为0.191 μmol/L(114 μg)。蛛网膜下腔容积固定且密闭,鞘内给药时,药物很少在脑脊液中发生代谢失活,主要从脑脊液直接清除。鞘内给药应根据脑脊液容积和药物浓度进行剂量计算,而不采用体表面积计算。实体瘤脑膜转移患者的中位年龄为55~60岁,蛛网膜下腔容积随年龄增长而增加,对于40~55岁患者,蛛网膜下腔容积约为250 ml。当10 mg培美曲塞鞘内注入250 ml脑脊液中,药物在蛛网膜下腔中充分弥散的状态下,峰浓度的理论值≤40 μg/ml,不足IC50值或推荐静脉给药剂量的血浆药物峰浓度的一半。为获得潜在抗肿瘤有效性,因此,将10 mg设定为人体研究的初始剂量。
本研究显示,10 mg剂量为培美曲塞鞘内化疗的最大耐受剂量及毒性限制剂量。该剂量下,结合补充维生素,显示出可控的不良反应以及良好的临床疗效。研究1所纳入的患者均属于治疗后复发耐药难治性脑膜转移患者,无其他治疗方案可用。本研究2纳入患者,KPS评分10~30分者占47.1%(16/34)。研究2患者的中位生存时间(5.5个月)短于既往应用甲氨喋呤鞘内化疗同步放疗的临床研究结果(6.5个月),1年生存率分别为21.6%和21.3%。值得注意的是,研究2中,脑膜转移复发后,采用甲氨蝶呤挽救性鞘内化疗无效,改用培美曲塞后再次取得疾病缓解,提示培美曲塞具有更好的鞘内化疗疗效。
有研究显示,甲氨蝶呤鞘内化疗同步放疗用于实体肿瘤脑膜转移的临床研究证实,该模式可以改善有不良预后因素脑膜转移患者的生存时间。本研究中,31例患者具有不良预后因素,再次证实同步治疗模式的临床疗效。理论上,培美曲塞与放射治疗的同步治疗模式具有协同效应,培美曲塞为多靶点叶酸抑制剂,通过靶向不同的酶,影响肿瘤细胞生长和分裂所必需的底物合成,使细胞在G1期发生蓄积,导致细胞周期停滞。G1期是放射治疗的敏感细胞周期时相,由此可见,同步治疗模式是具有疗效优势的治疗模式。
血液学不良反应是培美曲塞系统给药时最常见的不良反应,需要预防性使用维生素。鞘内给药剂量约为系统给药的1/100,为减低干扰因素,研究1初始未应用维生素补充预防血液学不良反应,10 mg剂量时,3例患者发生血液学不良反应,2例为3级血液学不良反应。15 mg剂量组中,纳入的2例患者均出现严重(4~5级)血液学不良反应。给予维生素补充后,血液学不良反应控制良好。这进一步证实,维生素补充可以有效控制血液学不良的发生。值得注意的是,素食患者应该考虑在培美曲塞应用前更早的补充维生素。
马尾神经刺激是经腰椎穿刺给药常见的不良反应。研究1中,神经根反应发生情况高于研究2(分别为5例和4例),其主要是由于研究1纳入的患者既往已经接受过多次鞘内化疗,发生4级神经根反应的患者均已接受总计超过15次的鞘内化疗,可见反复多次鞘注内化疗可以增加神经根不良反应的发生。然而,神经根不良反应短时间可自行缓解,未见长期相关并发症。需要注意的是,应严格注意鞘注给药操作规范,切记避免将药物注入硬膜外,造成神经根的严重化学性损伤从而引发长期的肢体活动及感觉障碍。
培美曲塞系统给药时,转氨酶升高是除血液学不良反应外最常见的不良反应。研究1和研究2中,3级转氨酶升高发生率相似,并与系统给药时发生率相似,可见培美曲塞相关肝脏损害不具有剂量梯度效应。研究2中,转氨酶升高发生患者例数(10例)高于研究1(2例)和既往报道的系统给药发生情况。但是,1~2级不良反应无明显临床症状,不影响治疗实施,且多在2~3周后恢复。研究2中,3例患者发生3级转氨酶升高,其中2例接受了每周2次的诱导鞘内化疗3~4次。另外,6例患者接受3~4次诱导鞘内化疗,其中2例发生3级转氨酶升高。28例接受不超过2次诱导鞘内化疗患者中,仅1例发生3级转氨酶升高,这说明,转氨酶升高的发生与鞘内给药频率有关,这可能是由于给药间隔时间短,损害了肝脏代谢功能。每周2次给药连续超过3次时,中度转氨酶升高发生率升高,应避免连续长期每周2次诱导给药方案。本研究中,1例患者发生迟发转氨酶升高,应注意培美曲塞鞘内给药后需要监测肝功至停药后至少2周。
与甲氨蝶呤、阿糖胞苷等经典鞘内化疗药物比较,培美曲塞的血液学不良反应发生率较高,但维生素补充可以有效控制血液学不良反应的发生。另外,培美曲塞未见明显皮肤损害及黏膜炎的发生。与拓扑替康及依托泊苷鞘内化疗药物比较,培美曲塞未见化学性脑膜炎发生。联合同步放疗时,严重不良反应发生率仅为2.9%(1/34),明显低于既往其他药物鞘内化疗研究报道(20.3%, 12/59)。
综上所述,培美曲塞鞘内化疗具有良好的耐受性、较高的安全性及反应性,为恶性肿瘤脑膜转移患者提供了新的治疗方案选择,值得临床应用,并进一步进行了临床研究。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


