

薛丽燕, 李印, 黄镜, 等. 中国食管癌PD-L1蛋白表达检测临床病理专家共识[J]. 中华肿瘤杂志, 2023, 45(4):291-297.
DOI: 10.3760/cma.j.cn112152-20221129-00792
近年来,以程序性死亡受体1(PD-1)免疫检查点抑制剂为代表的免疫治疗在食管癌治疗领域取得了巨大进展,并逐步改写着全球食管癌的治疗模式。但仅有部分食管癌患者能从免疫治疗中显著获益,因此如何筛选出PD-1抑制剂的潜在获益人群是目前面临的重要挑战。食管癌程序性死亡受体配体(PD-L1)蛋白表达水平与PD-1抑制剂疗效密切相关,是目前最重要的疗效预测标志物。随着不同PD-1抑制剂和PD-L1蛋白表达检测平台的临床应用,明确食管癌PD-L1蛋白表达检测的临床意义、检测时机、建立规范化和标准化检测流程有助于提高检测结果的准确性和降低室间差异性,使患者获益更大。结合相关文献、专家经验、委员会成员内部讨论和投票最终达成中国食管癌PD-L1蛋白表达检测临床病理专家共识,以期为临床医师决策提供准确可靠的依据。
【关键词】食管肿瘤;程序性死亡受体配体1;检测;专家共识
食管癌是我国常见的恶性肿瘤之一,恶性程度高、预后差,患者5年生存率约为20%~30%。我国食管癌以鳞状细胞癌(以下简称鳞癌)为主。近年来,大量研究结果显示,程序性死亡受体1(programmed cell death-1, PD-1)抑制剂单药或联合化疗能显著延长晚期食管癌患者的总生存时间(overall survival, OS)和无进展生存时间(progression free survival, PFS)。此外,纳武利尤单抗可显著提高新辅助放化疗后R0手术切除且病理学可见癌残留的食管癌或食管胃交界部癌患者的PFS。基于上述研究结果,中国国家药品监督管理局(National Medical Products Administration, NMPA)、美国食品药品监督管理局(Food and Drug Administration, FDA)和欧洲药品管理局(European Medicines Agency, EMA)已批准多种PD-1抑制剂用于晚期食管癌一线治疗、二线及以上治疗和术后辅助治疗。然而,并非所有食管癌患者均能从免疫治疗中获益。多项研究结果及荟萃分析显示,肿瘤程序性死亡受体配体1(programmed cell death-Ligand 1, PD-L1)蛋白表达水平与PD-1抑制剂的疗效和患者生存获益密切相关,PD-L1蛋白表达检测是目前指导临床筛选免疫治疗获益人群最有效的指标。既往研究中,不同PD-1抑制剂对应的PD-L1蛋白检测抗体不尽相同,PD-L1阳性的评估方法亦不相同。目前,国内已有部分大型医院开展PD-L1免疫组化检测工作,但在标本选择、抗体选择、检测平台、检测流程和结果判读缺乏统一的规范,对于不同克隆号抗体之间的判读结果能否相互替代尚存在疑问。针对上述问题,我们通过结合相关文献、专家经验、委员会成员内部讨论和投票,最终达成此共识,以期规范化PD-L1在食管癌中的检测,进而能够更好地预测食管癌患者对PD-1抑制剂治疗的反应和指导临床用药。
以下为共识要点推荐等级标准:(1)强推荐:基于高或中级别证据,可信度高;(2)推荐:基于中级别或低级别证据,但具有一定局限性,专家组同意推荐;(3)弱推荐:基于低级别证据或缺乏证据,但专家组统一意见。
PD-L1蛋白表达检测在食管癌免疫治疗中的临床意义
共识意见 1
PD-L1蛋白表达检测可作为伴随诊断指导PD-1抑制剂(帕博利珠单抗)在晚期食管癌中的治疗决策(推荐级别:强推荐)。
共识意见 2
PD-L1蛋白表达检测可协助筛选其他PD-1抑制剂的潜在获益人群及接受PD-1抑制剂治疗非晚期食管癌的潜在获益人群(推荐级别:强推荐)。
KEYNOTE-181研究结果显示,在PD-L1 联合阳性评分(combined positive score, CPS)≥10分的患者中,帕博利珠单抗较化疗可显著延长患者的OS,尤其是鳞癌患者;中国亚组分析结果显示,在PD-L1 CPS≥10分的鳞癌患者中,帕博利珠单抗组死亡风险降低66%。基于这一结果,NMPA和FDA均批准帕博利珠单抗用于治疗PD-L1阳性(CPS≥10分)、经一线治疗失败的晚期或转移性鳞癌,同时批准PD-L1(22C3)作为伴随诊断指导帕博利珠单抗的决策。KEYNOTE-590研究结果显示,帕博利珠单抗联合化疗较单纯化疗可显著提高整体食管癌患者的OS和PFS,其中鳞癌 PD-L1 CPS≥10分者生存获益最为显著。基于这一结果,NMPA、FDA和EMA均批准帕博利珠单抗联合化疗作为不可切除的晚期、复发性或转移性食管癌的一线治疗,其中EMA增加了PD-L1 CPS ≥10分的限制性条件。故PD-L1蛋白表达检测可作为伴随诊断指导帕博利珠单抗在晚期食管癌中的治疗决策。
Checkmate-648研究结果显示,PD-L1肿瘤细胞阳性评分(tumor positive score, TPS)≥1%的晚期鳞癌患者中,纳武利尤单抗联合化疗组较纳武利尤单抗联合伊匹木单抗组、单纯化疗组更能获益。基于这一结果,EMA批准纳武利尤单抗联合化疗或伊匹木单抗作为PD-L1(28-8) TPS≥1%、不可切除的晚期、复发性或转移性鳞癌的一线治疗。但目前NMPA尚未批准PD-L1(28-8)在食管癌中的适应证。
虽然NMPA批准卡瑞利珠单抗和替雷利珠单抗二线单药治疗晚期鳞癌,无需考虑PD-L1蛋白的表达情况,但批准所基于的ESCORT研究和RATIONALE-302研究结果均显示PD-L1高表达患者的临床获益更大。
此外,基于CheckMate-577研究结果,NMPA、FDA和EMA均已批准纳武利尤单抗用于食管癌辅助免疫治疗,无需考虑PD-L1蛋白表达水平。但CheckMate-577亚组分析结果显示,术后肿瘤组织内PD-L1 CPS≥5分者获益更为显著。因此,PD-L1蛋白表达检测亦可协助筛选其他PD-1抑制剂的潜在获益人群及接受PD-1抑制剂治疗的非晚期食管癌的潜在获益人群。
食管癌PD-L1蛋白表达检测适用人群及检测时机
共识意见 3
晚期食管癌患者计划接受帕博利珠单抗或纳武利尤单抗治疗之前推荐检测PD-L1蛋白表达(推荐级别:强推荐)。
共识意见 4
晚期食管癌患者在接受其他PD-1抑制剂治疗之前推荐检测PD-L1蛋白表达(推荐级别:弱推荐)。
共识意见 5
经新辅助放化疗及R0手术切除后仍有病理学残留的食管癌患者在辅助免疫治疗之前推荐检测PD-L1蛋白表达(推荐级别:弱推荐)。
基于共识意见1所列证据,对于不可切除的晚期食管癌患者,计划接受帕博利珠单抗或纳武利尤单抗治疗时,强推荐检测PD-L1蛋白表达;计划接受其他PD-1抑制剂治疗时,专家组也推荐检测PD-L1蛋白表达。
基于共识意见1所列证据,对经新辅助放化疗R0手术切除后仍有病理学癌残留的食管癌患者,计划接受辅助免疫治疗时,专家组推荐检测PD-L1蛋白表达。
对于可切除的局部进展期食管癌,新辅助(放)化疗联合免疫治疗的多项临床试验已完成或在进行中。由于PD-L1对新辅助(放)化疗联合免疫治疗效果的预测作用结果不一致,且专家组对食管癌患者在新辅助(放)化疗联合免疫治疗前进行PD-L1蛋白表达检测未达成共识,故本共识暂不推荐对食管癌患者在新辅助(放)化疗联合免疫治疗前检测PD-L1蛋白表达。
食管癌PD-L1蛋白表达检测标本选择
共识意见 6
推荐用经4%甲醛固定、石蜡包埋的肿瘤组织进行PD-L1蛋白表达检测(推荐级别:强推荐)。
共识意见 7
对于拟用PD-1抑制剂治疗的晚期食管癌患者,建议内镜医师在检查时进行多点取材以减少肿瘤异质性的影响(推荐级别:推荐)。
共识意见 8
肿瘤原发灶及转移灶均可用于PD-L1蛋白表达检测。由于转移灶和原发灶PD-L1蛋白表达可能存在差异,建议临床可及的情况下对原发灶和转移灶均进行PD-L1蛋白表达检测(推荐级别:弱推荐)。
共识意见 9
新辅助治疗前及治疗后的标本均可用于PD-L1蛋白表达检测。由于新辅助治疗前后PD-L1表达可能存在差异,基于治疗后肿瘤组织更能反映现状,故推荐对治疗后的肿瘤组织进行PD-L1蛋白表达检测(推荐级别:弱推荐)。
共识意见 10
如果有多个肿瘤组织蜡块,应择取最具代表性的蜡块进行PD-L1蛋白表达检测(推荐级别:弱推荐)。
共识意见 11
不推荐使用脱钙标本进行PD-L1蛋白表达检测(推荐级别:弱推荐)。
推荐用经4%甲醛固定、石蜡包埋的肿瘤组织进行PD-L1蛋白表达检测。不建议用其他固定液处理的标本。由于肿瘤内部PD-L1蛋白表达存在空间异质性,对于拟用PD-1抑制剂治疗的食管癌患者,建议内镜医师在检查时能够进行多点取材以减少肿瘤异质性的影响。
有研究显示,PD-L1在原发灶和转移灶中的表达存在一定的差异,当原发灶及转移灶标本均可获得时,建议对二者均进行PD-L1蛋白表达检测,并分别报告检测结果。一项研究比较了不同保存时间的晚期非小细胞肺癌肿瘤组织中PD-L1的表达情况,结果显示,3个月以上、3年以内获取与3个月以内获取的肿瘤组织中PD-L1高表达(TPS≥25%)率较高,而存储时间3年以上的标本中PD-L1高表达率明显下降。对于复发或转移性食管癌患者,如果原发肿瘤组织不可及或者存储时间过长(>3年),可用近期获取的转移性肿瘤组织检测PD-L1蛋白表达;如果复发灶或转移灶肿瘤组织不可及,可用存档的原发灶肿瘤组织检测PD-L1蛋白表达,如果检测结果为阴性,需备注可能为存储时间过长导致的假阴性结果。
新辅助化疗和新辅助放化疗均可上调食管癌PD-L1蛋白的表达,且术后肿瘤组织内PD-L1高表达者更能从辅助免疫治疗中获益,可能因为新辅助治疗后残留的肿瘤组织更能反映现状,故推荐用新辅助治疗后的肿瘤组织检测PD-L1蛋白表达。如果有多个肿瘤组织蜡块,应择取最具代表性的蜡块进行检测。应避免选择含有坏死、细胞挤压严重及固定不佳等情况的蜡块。目前尚无脱钙标本对PD-L1免疫组化检测结果影响的研究数据,根据试剂使用说明,暂不推荐在骨转移脱钙标本中检测PD-L1蛋白表达。
食管癌PD-L1免疫组化检测抗体克隆号和检测平台
共识意见 12
食管癌患者进行PD-L1蛋白表达检测时使用22C3抗体和Dako AutoStainer Link 48检测平台(推荐级别:强推荐)。
目前,NMPA批准可用于实体肿瘤PD-L1检测的免疫组化试剂盒有5种,其克隆号分别为22C3、28-8、SP263、SP142和E1L3N;检测平台包括Dako Autostainer Link 48和Ventana Benchmark Ultra。基于共识意见1所列证据,食管癌患者进行PD-L1蛋白表达检测时,强烈推荐使用22C3抗体和Dako AutoStainer Link 48检测平台。
食管癌PD-L1 22C3免疫组化检测过程中的质控标准
共识意见 13
PD-L1抗体进行每轮免疫组化染色时,需要同时对试剂盒内对照细胞系切片进行染色(推荐级别:强推荐)。
共识意见 14
进行PD-L1免疫组化染色时,需在待检切片上设置内部阳性对照组织和阴性对照组织(推荐级别:强推荐)。
共识意见 15
进行PD-L1免疫组化染色时,需同时用连续切片进行HE染色和阴性对照试剂染色(推荐级别:强推荐)。
每批次免疫组化染色应添加一张细胞系质控切片用于PD-L1 抗体染色。细胞系质控切片含PD-L1阳性细胞系点和PD-L1阴性细胞系点。PD-L1阳性质控细胞系染色合格标准:≥70%的细胞呈现膜染色,平均染色强度≥2+,非特异性染色强度<1+。PD-L1阴性质控细胞系染色合格标准:无特异性染色,非特异性染色强度<1+。
需在PD-L1免疫组化染色待检切片上设置内部阳性对照和阴性对照组织。内部阳性对照和阴性对照组织需选用经4%甲醛固定、石蜡包埋的鳞癌组织。内部阳性对照组织:肿瘤细胞及肿瘤相关单核炎症细胞(mononuclear inflammatory cells, MICs)显示弱至中等强度的特异性细胞膜染色,非特异性背景染色强度≤1+。内部阴性对照组织:肿瘤细胞无细胞膜染色(可接受一些MICs染色),非特异性背景染色强度≤1+。
每个待检样本必须制备3张连续切片,HE染色切片、阴性试剂对照染色切片和 PD-L1 免疫组化染色切片各1张。为保证染色质量与检测结果的准确性,推荐使用新鲜切取的白片进行免疫组化检测,尽量避免使用长时间(室温条件下>1个月或2~8 ℃条件下>4.5个月)存储的白片。
食管癌PD-L1免疫组化结果判读及报告
共识意见 16
PD-L1免疫组化检测结果需严格按照其判读流程进行判读(推荐级别:强推荐)。
共识意见 17
推荐采用CPS评分评估PD-L1(22C3)在食管癌中的表达水平(推荐级别:强推荐)。
共识意见 18
推荐使用PD-L1免疫组化检测结果报告模板(推荐级别:强推荐)。
PD-L1免疫组化检测结果判读目前是通过人工半定量判读,具有一定主观性,应在有资质的实验室由经过PD-L1判读培训的病理医师进行诊断。PD-L1 (22C3)判读流程见图1。
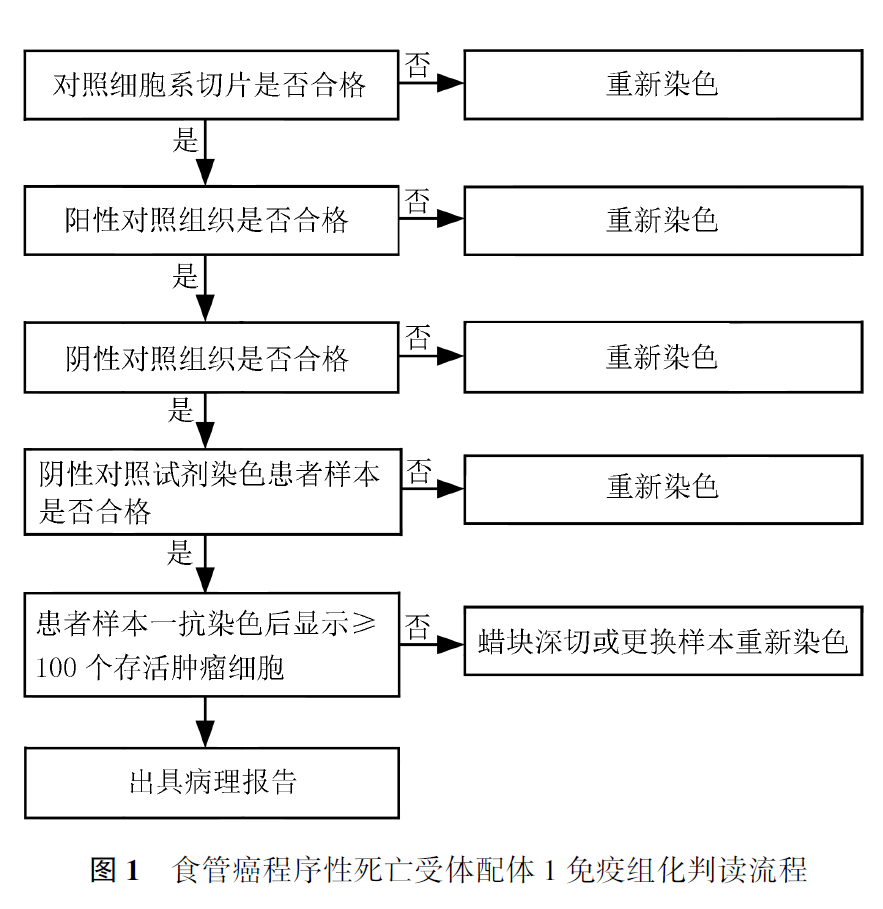
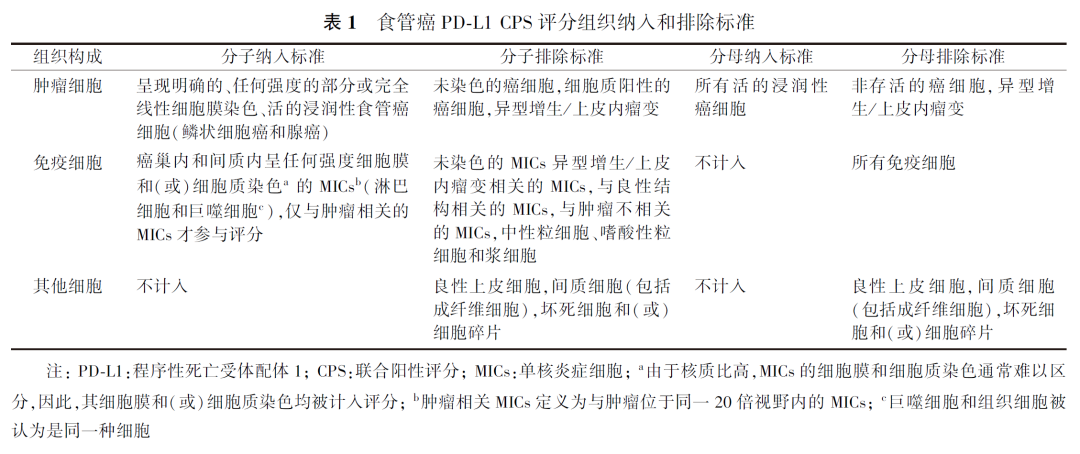
目前,食管癌免疫治疗临床研究中使用的PD-L1评分体系包括CPS、TPS和PD-L1阳性肿瘤面积(tumor area positivity, TAP)评分。CPS是指阳性活肿瘤细胞(任何强度的部分或完全膜染色)及阳性淋巴细胞、巨噬细胞(任何强度的细胞膜或细胞质染色)占所有活肿瘤细胞的百分比,再乘以100,结果采用0~100数值来表示(图2)。TPS是指肿瘤细胞在任何强度下显示部分或完整膜染色的细胞数占总肿瘤细胞数的百分比,结果采用0~100%来表示。TAP 是指阳性肿瘤细胞(任何强度的部分或完全膜染色)及阳性淋巴细胞、巨噬细胞(任何强度的细胞膜或细胞质染色)占肿瘤区域的总百分比,结果采用0~100%来表示。PD-L1(22C3)免疫组化检测作为帕博利珠单抗的伴随诊断,其在鳞癌中采用CPS评分,其分子、分母纳入及排除标准见表1。鉴于其他克隆号目前尚未在国内获批食管癌的适应证,本共识暂不推荐TPS等其他评分方法。

PD-L1检测结果报告除包含常规病理报告的基本内容和患者基本信息外,还应包括但不限于以下内容:抗体克隆号、检测平台、内部阳性对照和阴性对照评估结果、阴性试剂对照评估结果、具体的CPS数值以及必要的注释。具体参考报告模板见表2。

食管癌PD-L1蛋白表达检测的质控要点
共识意见 19
实验室内部定期进行抽检、比对及性能验证(推荐级别:强推荐)。
共识意见 20
实验室应定期参加室间质评活动,每年至少2次(推荐级别:强推荐)。
为确保准确规范地进行PD-L1蛋白检测,实验室应在项目开展前建立规范化的操作流程并进行必要的性能验证,切实做好质控工作,包括内部质控和外部质控。
1. 内部质控:内部质控的目的是确保检验步骤的准确性、检测结果的准确性和可重复性。检测前确保样本处理达到要求,检测中常规设立阳性及阴性对照,定期进行抽检,对不同检测人员进行比对,对新试剂盒/试剂进行性能验证等。进行规范的、必要的实验记录以便溯源,定期进行人员培训、考核和再培训工作,定期进行数据总结和分析,定期维护仪器设备等。
2. 外部质控:参与室间质评活动是外部质控的主要方式。实验室应定期参加PD-L1检测室间质评活动,每年至少2次。室间质评可通过参加国内权威机构举办的室间质评活动来完成,也可通过与其他实验室(如已获得资格认可的实验室、使用相同检测方法的实验室等)比对来确定检测结果的可信度。
食管癌各种PD-L1抗体的一致性研究及实验室自建检测方法(laboratory developed tests, LDT)的研发
共识意见 21
不同克隆号之间PD-L1检测结果一致性较高,但尚缺乏足够的前瞻性临床研究结果,应用22C3之外的克隆号需谨慎(推荐级别:弱推荐)。
共识意见 22
由于国内缺乏LDT相关的实践经验,开展PD-L1 LDT需谨慎(推荐级别:弱推荐)。
目前,关于PD-L1不同克隆号抗体在食管癌中的一致性研究较少。一项国内单中心研究选用3种抗体(28-8、SP263和22C3)对324例鳞癌进行染色,采用CPS评分进行评估,分别以截断值1和50进行比较,结果显示,无论截断值为1还是50,28-8和22C3之间一致性均较高(分别为93.5%和99.1%);当截断值为1时,SP263与22C3的一致率为81.5%;当截断值为50时,SP263与22C3的一致率为96%。但是该研究未比较截断值为10时三者之间的一致性。虽然上述研究结果提示不同克隆号之间PD-L1检测结果一致性较高,但尚缺乏足够的前瞻性临床研究结果。
LDT是指医疗机构检验部门自行研发、验证和使用的检测方法,仅在医学检验部门内部使用,不作为商品出售给其他医学检验部门、医院及个人。2021年6月1日起新修订版的《医疗器械监督管理条例》为国内LDT的开展提供了法律依据。但严格来讲,开展LDT实验室需经过相关医学实验室质量和能力认可(如ISO15189认可或CAP认证等),在完成必要的抗体性能确认和免疫组化实验室检查能力考核合格后,实验操作人员方能授权上岗。现阶段,国内在PD-L1免疫组化检测LDT方面尚处于初期阶段,需不断积累相关临床实践数据及经验。
如必需开展22C3外其他克隆号抗体的检测和LDT,实验室需提供技术验证和使用相关参比标准品进行间接临床验证。
食管癌免疫治疗的其他生物标志物
共识意见 23
暂不推荐肿瘤突变负荷(tumor mutation burden, TMB)作为食管癌免疫治疗的生物标志物(推荐级别:弱推荐)。
共识意见 24
推荐dMMR/MSI-H作为食管癌免疫治疗的生物标志物(推荐级别:弱推荐)。
TMB指肿瘤细胞基因组中所评估基因的外显子编码区每兆碱基中发生错义突变的总数。相关研究结果显示,TMB高的食管癌患者在接受免疫治疗后生存获益较为显著,且对免疫治疗的反应也更显著,但目前缺乏高级别证据,且费用高昂、普及率低、有效截断值不确定等因素,故暂不推荐TMB作为食管癌免疫治疗的生物标志物。
微卫星不稳定是由DNA错配修复缺陷(different mismatch repair, dMMR)引起的。研究显示,dMMR/微卫星高度不稳定(microsatellite instability-high, MSI-H)是非常好的泛瘤种疗效预测标志物,但dMMR/MSI-H在食管鳞癌中罕见。
小结
作为晚期食管癌免疫治疗的伴随诊断,建立规范化的PD-L1蛋白检测流程至关重要。本专家共识从适用人群、检测时机、标本处理、蜡块选择、免疫组化染色流程、判读方法及质控等方面对食管癌PD-L1蛋白表达检测提出了严格的要求。但需注意的是,PD-L1蛋白检测的过程中存在各种客观复杂的因素且国内PD-L1蛋白检测尚处于临床应用初期,此专家共识部分内容尚存在不足之处,期待未来有更多高质量证据将其进一步完善。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


