编者按:2023年3月4~5日,由中山大学肿瘤防治中心主办的“研究者发起临床研究实施管理研讨培训班暨临床医学研究中心-临床研究质量保证部成立仪式”在花城广州隆重举行。本次大会围绕“研究者发起临床研究(IIT)” 的方方面面,从项目管理、质量管理、受试者管理、立项审查和科学审查、伦理审查、人类资源管理到财务管理等,打造了一场全方位的视听盛宴。会中,中山大学孙逸仙纪念医院临床研究中心临床研究设计部的副主任张怡医生,就“临床研究注册和备案管理要求”做了精彩分享。
中山大学孙逸仙纪念医院临床研究中心临床研究设计部副主任

临床研究注册
什么是临床研究注册?
临床研究注册是指一项临床研究在开展前(第一例受试者入组前),在公认的机构如WHO一级注册机构或国际医学期刊编辑委员会(ICMJE)批准的注册平台进行登记,公开研究内容,并跟踪、公布研究结果。
临床研究注册是医学研究伦理的需要,也是临床试验研究者的责任和义务。临床研究注册对研究者、医疗机构而言都非常重要。
临床研究注册的重要事件
临床研究注册的概念最早于1970年由美国提出,并于1977年在美国成立了第一个临床试验注册中心——癌症临床试验注册中心。1997年,美国FDA第一次从立法层面要求临床试验必须注册。2000年,ClinicalTrials.gov通过互联网向公众开放;2004年,ICMJE将临床试验注册作为试验结果在成员期刊发表的先决条件;2005年,中国临床试验注册中心(ChiCTR)正式运行;2007年,WHO建成国际临床试验注册平台(WHO ICTRP)、ICMJE宣布承认在WHO ICTRP中一级注册机构注册的临床试验。
值得注意的是,临床研究注册在部分国家是有法律层面的强制要求的,如美国,而我国暂未有;在期刊层面,ICMJE为强制要求,其基本覆盖了国内外的期刊,包括中华医学会下等中文期刊。
哪些研究需要注册?
ICMJE规定:任何前瞻性、涉及人的干预性研究必须注册,不管是否设置试验组或对照组;非实验设计的研究则鼓励注册。
中国临床试验注册中心规定:所有临床试验均应注册——包括干预性临床试验和观察性研究。在人体上或取自人体的标本包括组织、血液、体液、毛发、细胞等进行的研究,无论采用什么设计方案均应注册。
如何进行临床研究注册?
任何WHO一级注册机构或ICMJE批准的注册中心均可以注册试验(共18个),且仅需注册一次。
临床试验注册平台
 国内一般推荐在如下两个注册中心注册:中国临床试验注册中心(ChiCTR)https://www.chictr.org.cn;
国内一般推荐在如下两个注册中心注册:中国临床试验注册中心(ChiCTR)https://www.chictr.org.cn;
美国临床试验注册库(Clinical Trial)https://clinicaltrials.gov。
ChiCTR与Clinical Trial对比
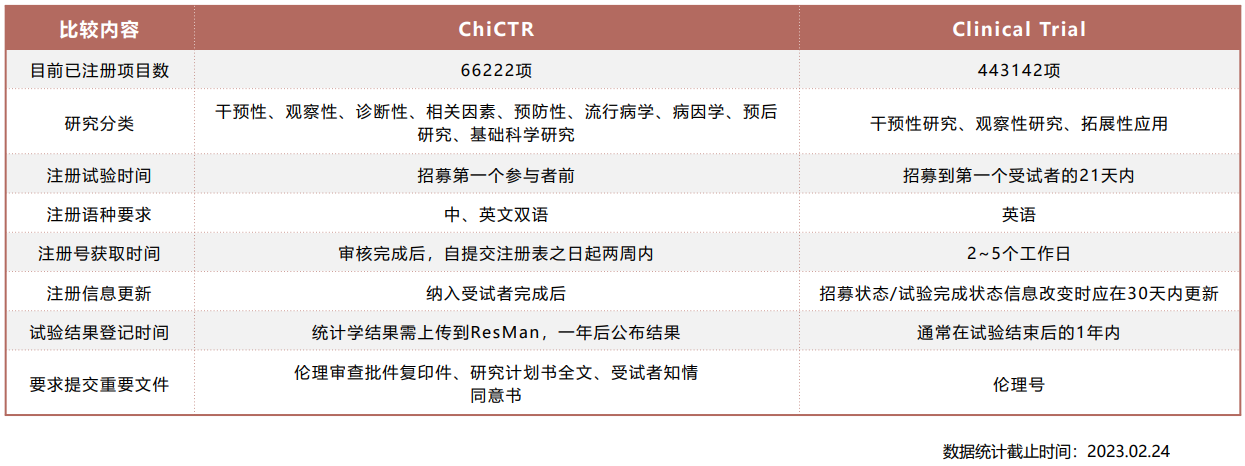 中国临床试验注册中心(ChiCTR)
中国临床试验注册中心(ChiCTR)
中国临床试验注册中心(ChiCTR)是世界卫生组织国际临床试验注册平台的一级注册机构,注册指南详见https://www.chictr.org.cn/registry.aspx。提醒两点注意事项:①为了防止信息泄露,避免填写手机号码,可填工作电话。②接受补注册(纳入第一例受试者后注册),但补注册成功并不意味着就能被医学期刊接受。因此,建议在纳入第一例受试者前注册——预注册。
中国临床试验注册中心注册指引

美国临床试验注册库(Clinical Trial)
美国临床试验注册库是美国国立图书馆与FDA共同开发,符合ICMJE基本要求,是国际上影响力较大的注册机构之一。注册指南详见https://clinicaltrials.gov/ct2/manage-recs/how-register。
虽然中国有自己的临床试验注册中心,但中国的研究在Clinical Trial的注册数仍高居世界第二,原因之一为科技量值STEM目前仅纳入Clinicaltrial的数据。
Clinical Trial注册使用指引
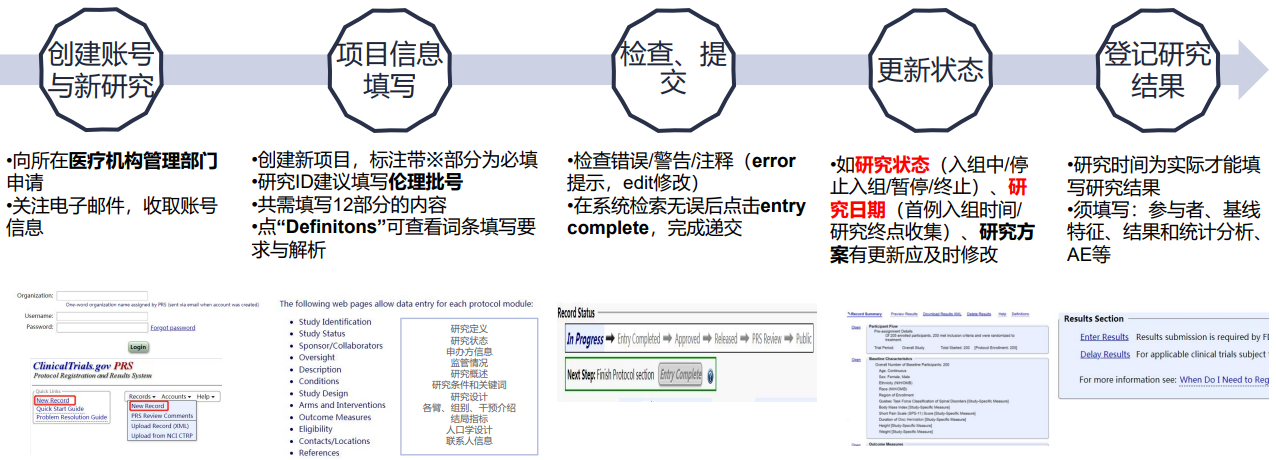 总体来讲,临床研究注册需要注意两点:一是事先注册,二是及时更新。
总体来讲,临床研究注册需要注意两点:一是事先注册,二是及时更新。
注册流程总结
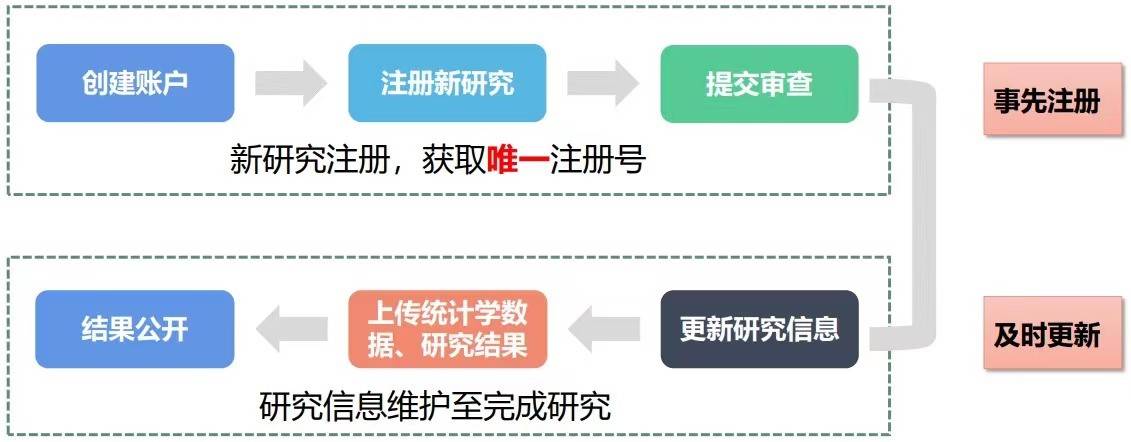
什么是研究信息更新?
临床研究信息更新包括两点内容:
一是研究状态、研究开始/结束日期等进程的更新。通常需要30天内完成。
研究状态通常包括: ①尚未招募(Not yet recruiting:participants are not yet being recruited);②招募中(Recruiting);③指定招募(Enrolling by invitation),即受试者由预定人群中遴选而出;④试验进行中,但目前不招募(Active,not recruiting);⑤招募已结束(Completed);⑥招募暂停(Suspended);⑦招募中止(Terminated);⑧招募取消(Withdrawn),即在招募首位受试者之前,研究即已停止。
需注意的是,STEM对招募状态为“Not yet recruiting”或“Withdraw”或“unknown”的临床试验不予纳入。
二是研究方案的修订更新。要求在获得方案修订伦理审查意见后30天内完成。注册网站允许方案修订,但所有的修订均会被完整记录。假如非修改不可,应尽量详尽、如实地解释修改的理由。因此,应避免一切非必要的更新。
关于临床研究数据共享
编委会提出:2018年7月及以后提交到ICMJE期刊的临床试验报告,必须包含数据共享声明。2019年1月1日后开始入组受试者的临床试验,必须在临床试验注册平台上提交数据共享计划。如果数据共享计划有变化或更改,应在注册平台上进行更新,并在提交论文时加以说明。
数据共享声明需要包含以下内容:
1. 是否共享研究对象的个体数据(包括变量清单);
2. 会共享哪些数据;
3. 研究相关的文档(研究方案、统计分析计划)是否共享;
4. 数据将什么时间可获取以及可开放获取多长时间;
5. 对共享试验数据的入选要求(包括谁能获取数据、试验数据可用于什么分析)。
上述五点是对数据共享声明的最低要求,ICMJE的某些期刊会要求更为严格的试验数据共享。期刊编辑会参考研究者提供的数据共享声明来做出编辑对稿件是否刊出的决定。
Q:我的研究是否可以不注册?
答:除非研究尚未启动且不打算发表(包括但不限于期刊、口头汇报、会议展板等)。前瞻性干预性研究,尤其是RCT,必须注册,不注册几乎无法发表;观察性研究,如横断面等,建议注册。
Q:我只是对病人实施护理教育,在正常诊疗的基础上进行,或只是实施饮食干预等,是否可以不注册?
A:前瞻性干预研究必须注册。干预包括药物、手术、器械、行为治疗、教育计划、饮食干预、质量改进干预和护理过程的改变。
Q:我只准备发中文期刊,是否可以不注册?
A:可参考https://icmje.org/journals-following-the-icmje-recommendations/中杂志列表,目前已有超过5570种杂志遵守ICMJE要求,主流的中文核心期刊通常强制要求注册。
Q:我想发sci,是否一定要在clinicaltrial注册?
A:不一定,在中国临床试验注册中心注册也可以。
Q:会不会两个网站同时注册更保险?
A:应避免重复注册,临床试验注册后资料均送WHOICTRP,并能在其一站式检索入口(Search Portal)检索到。但如果是跨国多中心试验,可同时在实施试验的多个所在国同时注册,但需先在WHO ICTRP申请唯一识别码(UniqueTrialNumber,UTN)。
Q:是否需要在获得伦理批件前注册?
A:不一定,只需在招募第一例受试者前注册即可。建议可先通过伦理审查,获得批件后注册。如果在获得批件前注册,请在获得批件后及时更新网站信息。
Q:我的一项RCT研究在开展前忘了注册,现在已经准备发表了,怎么办?
A:对于遵守ICMJE要求的主流杂志,只能放弃发表。尽管中国临床试验注册中心允许补注册,但通常可能被拒稿。
Q:那我改成回顾性来发表可以吗?
A:ICMJE未强制要求回顾性研究注册,但此举一来大大降低证据等级,二来可能涉及科研诚信问题。
Q:我注册的方案中涉及若干个次要结局,但最终只有其中1个次要结局有统计学意义,能否只在文章中仅报告有统计学意义的结局,不提及其他?
A:不可以,这是典型的选择性报告,注册的目的之一就是为了避免选择性报告。应报告所有研究结局的完整统计分析结果。只要是注册方案中提及的内容,均应完整如实地进行报告。
Q:我注册时没有提及会收集某项指标,但我在研究时“顺手”收集了并进行分析,发现有统计学意义,可以写到文章里吗?
A:可以是可以,但属于“事后分析”,证据级别低。
Q:我注册时涉及的样本量是200例,但我只完成了100例就发表了、或进行了非预期的期中分析,是否可以?
A:类似的情况应进行方案修订,说明清楚修改的必要性,并更新注册信息,但不建议频繁修订方案。当文章内容与注册内容不符,或修改次数过多,会严重降低审稿人对文章结果的信心。
临床研究注册小结
临床研究注册不是为了发表文章,而是研究者的伦理责任和义务。主要还是要做好三点:首先要提高注册意识,在入组第一例受试者前完成注册;第二,内容填写要准确,不漏填、不填错;第三,完成注册后要及时更新注册信息,但要避免不必要、频繁地修订。
临床研究备案
临床研究备案是法规的要求。如2015年的《干细胞临床研究管理办法(试行)》、2021年《医疗卫生机构开展研究者发起的临床研究管理办法》(试行)、2023年2月新出台的《涉及人的生命科学和医学研究伦理审查办法》,均对临床研究备案提出了明确的要求。需要指出的是,备案的流程跟注册的流程非常类似,因此,在法规出台的时候,《国家卫生健康委关于开展医疗卫生机构临床研究规范管理试点工作的通知》中明确指出:“要积极推进备案系统与国内临床研究注册平台的对接,减少医疗卫生机构和研究者信息填报工作量”。非常期待这项工作能够尽快落实,减少研究者重复登记的工作量,但目前还是两项分开的工作。
建议临床研究注册与备案同步进行,英文题目应确保一致。
临床研究备案的法规要求


国家医学研究登记备案信息系统的网址为https://www.medicalresearch.org.cn/login。
登录界面有使用指南、网页下方有相应的QQ群和邮箱,可对用户的疑问进行一一解答。
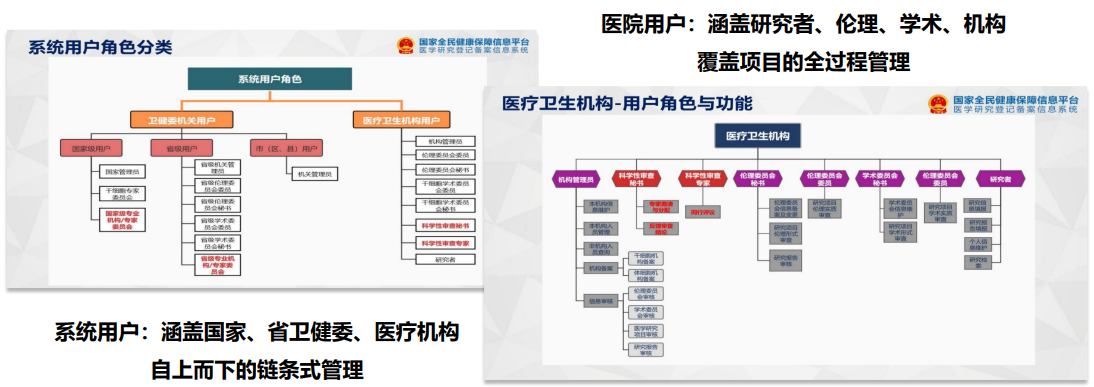
 在用户角色的分类上:系统用户涵盖了国家、省卫健委、医疗机构,是自上而下的链条式管理,登录上去的信息国家卫健委能够直接看到;医院用户涵盖了研究者、伦理、学术、机构,覆盖项目的全过程管理。对于医疗机构来说,学术审查、科学性审查、伦理审查,全过程的流程都会在上面显示上传的流程。
在用户角色的分类上:系统用户涵盖了国家、省卫健委、医疗机构,是自上而下的链条式管理,登录上去的信息国家卫健委能够直接看到;医院用户涵盖了研究者、伦理、学术、机构,覆盖项目的全过程管理。对于医疗机构来说,学术审查、科学性审查、伦理审查,全过程的流程都会在上面显示上传的流程。
用户角色
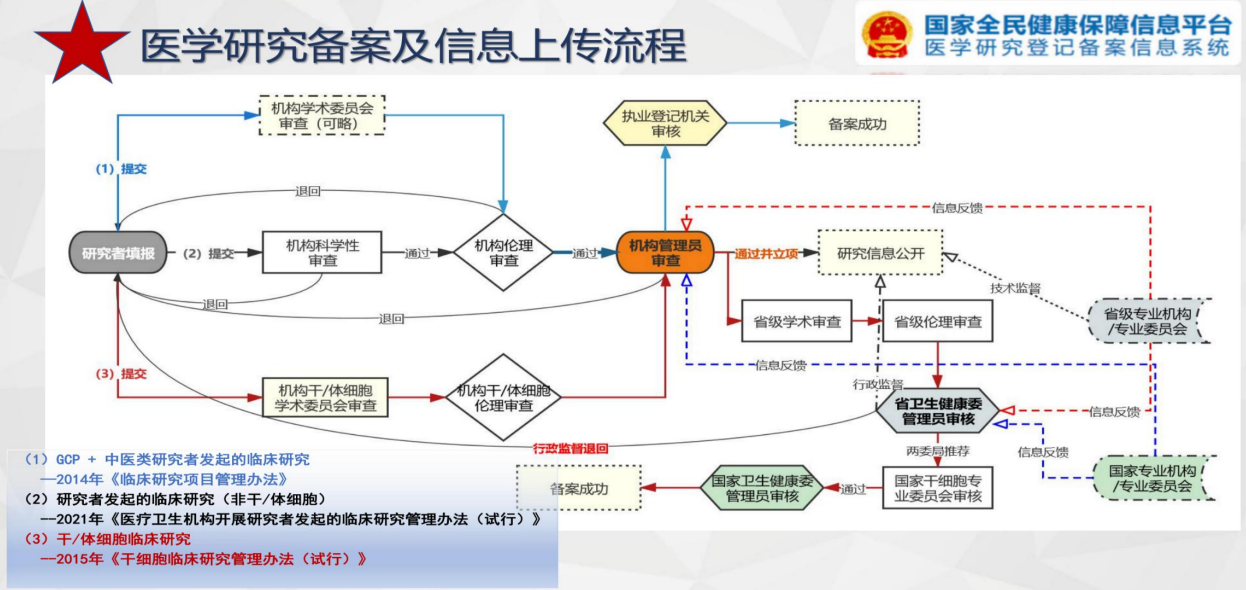
下图是GCP项目、研究者发起的临床研究(非干/体细胞)、干/体细胞临床研究的备案及信息上传流程。
医学研究备案及信息上传流程
Q:医疗新技术项目和相应的伦理委员会是否需要备案或上传?
A:不需要——因为这是医学研究登记备案信息系统。诸如器官移植、生殖医学等技术相关的不需要备案或上传。
Q:“修改后同意”、“修改后重审”的区别?
A:修改后同意/修改后备案:退回至项目负责人,负责人修改后直接回到当前操作。
修改后重审/退回修改:退回至项目负责人,负责人修改后重新全流程审查。
Q:备案与注册的关系?
A:目前是两项独立的工作。
备案是法律强制要求,是国家监督管理的抓手。期待尽快实现两项工作的对接,减少工作量。
目前建议完成注册的同时尽快完成备案,并注意注册所用的题目与备案题目相同。
排版编辑:Linda











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


