请注意:本文为2020年4月发表,请结合新版防控方案、临床和流行病学实际,以免结论误用。

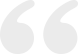
朱闻捷, 王洁, 何小慧, 等. 新型冠状病毒肺炎疫情期间肿瘤患者肺部浸润鉴别诊断[J]. 中华肿瘤杂志, 2020, 42(4):305-311.
DOI: 10.3760/cma.j.cn112152-20200303-00166
目的
结合化疗后出现肺内磨玻璃影淋巴瘤患者的临床特征,分析新型冠状病毒肺炎(COVID-19)疫情期间肿瘤患者出现肺内浸润的鉴别诊断和临床处理思路。
方法
2020年2月13—28日就诊于中国医学科学院肿瘤医院内科的139例患者中,8例患者提示肺内新发浸润性病灶。回顾性分析8例患者的基线人口学特征、临床表现、流行病学史、实验室检查和胸部CT扫描影像学资料,在Pubmed、Embase、CNKI等数据库中检索分析肿瘤患者肺部浸润相关文献。
结果
在139例行化疗前胸部CT检查的患者中,8例(5.8%)患者提示肺内新发浸润性病灶,其中5例(3.6%)以肺内磨玻璃影为主要表现,3例行2019新型冠状病毒(2019-nCoV)核酸检测均为阴性。其中1例为老年男性,诊断为淋巴瘤,采用CHOP方案(环磷酰胺+多柔比星+长春新碱+强的松)化疗后,无发热和呼吸道症状,血常规示淋巴细胞减少,胸部CT示双肺多发磨玻璃密度影,否认COVID-19流行病学史,经核酸检测排除COVID-19,诊断为病毒性肺炎,给予经验性抗感染治疗。
结论
在COVID-19疫情期间,肿瘤患者新发以磨玻璃影为主的肺内浸润时,应结合流行病学史、临床症状、CT表现、实验室检查结果等综合判断,适当放宽2019-nCoV核酸检测范围,考虑感染性疾病时应在启动经验性抗感染治疗的前提下,密切观察病情和胸部影像学变化。
【关键词】COVID-19;肿瘤;肺部浸润;病毒性肺炎;药物性肺损伤
2019年12月以来,武汉陆续发现多例不明原因肺炎病例,在各级疾病控制中心、医疗单位和科研机构通力协作下,确定其病原体为2019新型冠状病毒(2019-nCoV),该病原体感染所致的肺炎称为新型冠状病毒肺炎(COVID-19)。在疫情期间我们收治化疗患者时,化疗前常规行影像学检查发现肺内磨玻璃影,但患者无发热和呼吸道症状。肿瘤患者免疫功能低下,治疗后常发生中性粒细胞减少,治疗史复杂,这些特殊因素均给鉴别诊断带来困难。本研究中,我们结合化疗后出现肺内磨玻璃影淋巴瘤患者的临床资料,探讨COVID-19疫情期间肿瘤患者出现肺内浸润的鉴别诊断和临床处理思路。
资料与方法
1.临床资料:
自2020年2月13—28日,我院内科共有139例肿瘤患者接受化疗前胸部CT检查,8例(5.8%)提示肺内新发浸润性病灶,其中5例(3.6%)以肺内磨玻璃影为主要表现。5例患者的年龄为35~66岁,均为多疗程化疗后,就诊于我院前均无发热和呼吸道症状,否认COVID-19流行病学史,3例患者血常规提示淋巴细胞比例减少,行2019-nCoV核酸检测均为阴性,5例患者均接受了经验性抗感染治疗。
2.研究方法:
通过病例查阅回顾性分析患者的基线人口学特征和临床病理资料,包括年龄、性别、居住地、职业、教育程度、病理诊断、肿瘤分期、抗肿瘤治疗史(尤其是化疗方案和剂量)、疗效、治疗相关不良反应、既往病史、个人史、婚育史和家族史,通过电话调查和病例查阅收集患者就诊时症状、体格检查、流行病学史、实验室检查[包括血常规、血液生化、C-反应蛋白(C-reactive protein, CRP)和病原学检测等]和胸部CT影像学资料。以肿瘤、肺内浸润、社区获得性肺炎、病毒性肺炎、肺孢子菌肺炎、卡氏肺孢子虫肺炎、间质性肺炎和药物性肺损伤等为关键词在Pubmed、Embase、UpToDate和CNKI等数据库中查阅相关文献。
结果
一、患者的临床特征
例1 患者男,66岁,北京市大兴区离退休人员,确诊非霍奇金淋巴瘤2个月余,化疗3个周期后。患者于2019年10月中旬发现双侧颈部、颌下多发肿物,较大的肿物直径约2 cm,质韧,无压痛。2019年11月就诊我院,行PET-CT检查,提示双侧颈部、双侧腋窝、胸骨上方、纵隔、双肺门、双侧髂外血管旁、双侧腹股沟区多发淋巴结,伴代谢增高,最大标准摄取值(max standard uptake value, SUVmax)为8.3,较大的淋巴结约2.1 cm×1.6 cm,符合淋巴瘤表现。鼻咽顶后壁软组织增厚,伴代谢增高,SUVmax为5.8。口咽摄取增高,SUVmax为7.6,考虑淋巴瘤侵犯可能大。颈部淋巴结活检病理示,外周T细胞淋巴瘤,富于上皮样组织细胞(淋巴上皮样淋巴瘤);骨髓穿刺未见骨髓受侵,诊断为非霍奇金淋巴瘤(淋巴上皮样淋巴瘤,ⅢA期,外周T细胞淋巴瘤预后指数1分,国际预后指数2分),制定CHOP方案,具体为:环磷酰胺0.6 g,静脉滴注,第2~3天;长春新碱2 mg,静脉滴注,第1天;多柔比星脂质体60 mg,静脉滴注,第4天;泼尼松100 mg,口服第1~5天,每21 d为1个周期。拟化疗6个周期,2019年12月6日开始化疗,共3个周期,末次化疗结束时间为2020年1月26日。2个周期化疗后CT评价为完全缓解,患者化疗后出现Ⅰ度口腔溃疡,无骨髓抑制等其他严重不良反应。2020年2月13日患者来我院完善第4个周期治疗前检查,2月13日胸部平扫CT显示,与1月15日CT对比,双侧腋窝、纵隔、肺门多发小淋巴结,同前相仿,较大淋巴结短径为0.5 cm,双肺新见多发磨玻璃密度影及斑片影,考虑炎症(图1);2月13日血常规示,白细胞为4.59×109/L,中性粒细胞计数为2.35×109/L,中性粒细胞百分比51.1%,淋巴细胞为1.15×109/L,淋巴细胞百分比为25.1%,单核细胞计数为0.81×109/L,单核细胞百分比为17.6%,血红蛋白为145 g/L,血小板为226×109/L,肝肾功能未见明显异常。患者近2周无发热、乏力、咳嗽、咳痰、呼吸困难、胸痛、心悸、腹痛和腹泻等不适。既往史包括反流性食管炎、慢性萎缩性胃炎和副银屑病病史,其中副银屑病病史10余年,病情稳定,未接受糖皮质激素类制剂治疗。吸烟3支/d,共25年,戒烟10年。流行病学史为末次化疗结束(1月26日)后,患者和妻子一直居家,期间曾自驾到外院就诊接受外周静脉置入中心静脉导管(peripherally inserted central catheter, PICC)护理,就诊医院无COVID-19确诊病例,患者否认湖北和其他疫区旅居史,否认COVID-19确诊或疑似病例接触史,否认湖北等疫区人员接触史,否认所在小区聚集性发病史。体温36.5℃,脉搏75次/min,呼吸17次/min,血压116/72 mmHg,血氧饱和度(SpO2)为99%(未吸氧),双肺呼吸音清,未闻及明显干湿性啰音、胸膜摩擦音,余查体无阳性体征,PICC置管处无明显红肿、压痛。
2月13日下午我院组织多学科会诊,结合例1患者肺部影像学表现、当前COVID-19流行病学和感染特征,患者虽无明确流行病学史,无发热、乏力和呼吸道症状,血常规未见淋巴细胞减少,但患者胸部CT表现符合病毒性肺炎影像学特点,且患者合并淋巴瘤,多疗程化疗后免疫功能受抑制,不能完全排除2019-nCoV无症状感染的可能,嘱患者于定点医院就诊完善2019-nCoV核酸检测。患者2月13日就诊北京大学第一医院急诊,先后于2月13日、14日2次行鼻拭子2019-nCoV核酸检测,结果均为阴性。2月14日血常规示,白细胞为5.03×109/L,中性粒细胞计数为2.62×109/L,中性粒细胞百分比为52.0%,淋巴细胞计数为0.88×109/L,淋巴细胞百分比为17.5%,单核细胞计数为1.22×109/L,单核细胞百分比为24.3%,血红蛋白为139 g/L,血小板为256×109/L,CRP为20 mg/L;肝肾功能无异常,甲型流感病毒抗原、巨细胞病毒抗体、呼吸道病原谱筛查(病原体IgM)均为阴性,因患者病情平稳,未行1,3-β-D葡聚糖检测/半乳糖甘露醇聚糖抗原检测(G试验/GM试验),未再复查胸部CT,北京大学第一医院诊断考虑社区获得性肺炎(病毒性肺炎可能性大),暂不支持COVID-19诊断。给予磷酸奥司他韦75 mg口服,2次/d,共5 d;莫西沙星0.4 g口服,1次/d,治疗14 d,患者目前居家治疗中,一般情况可,无发热、乏力、呼吸道及消化道症状,拟于2周后再次复查胸部CT。
二、COVID-19典型影像学表现和诊断标准
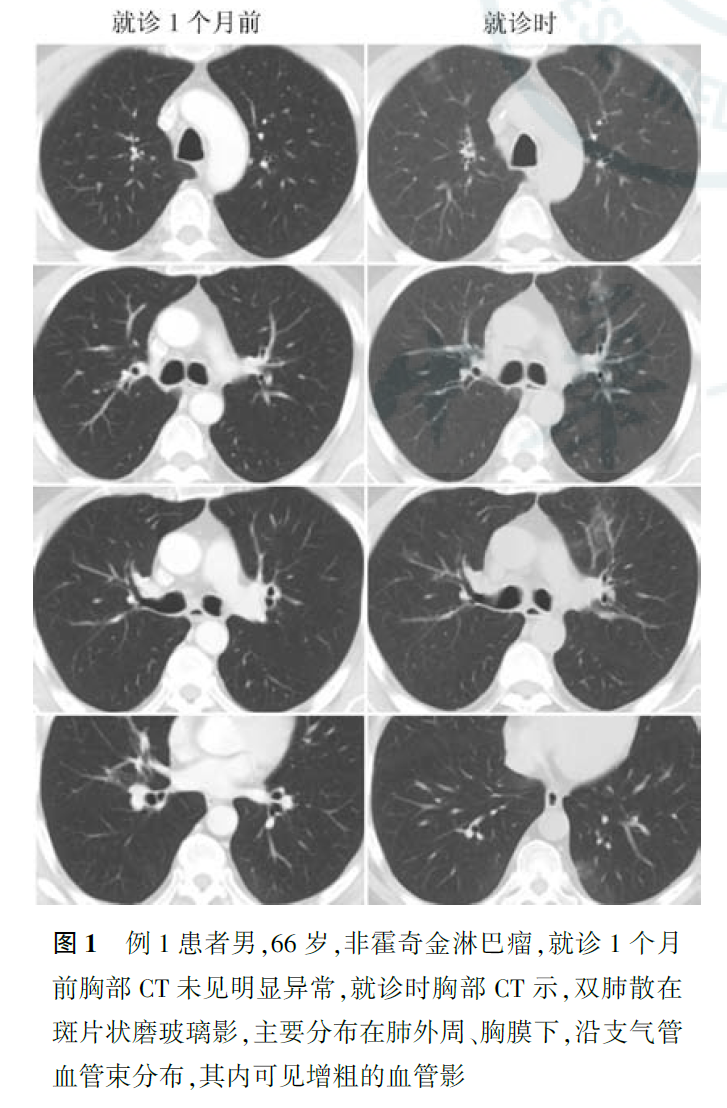
COVID-19胸部影像学典型表现:早期表现为多发小斑片影和间质性改变,以肺外带明显,进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见(图2)。根据国家卫生健康委员会第六版《新型冠状病毒肺炎诊疗方案》,目前COVID-19统一分为疑似病例和确诊病例两类。疑似病例分两种情形,一是有流行病学史中的任意1条,且符合临床表现[发热和(或)呼吸道症状;具有上述肺炎影像学特征;发病早期白细胞总数正常或降低,淋巴细胞计数减少]中任意2条;二是无明确流行病学史的,且符合临床表现中3条。确诊病例需有病原学证据阳性结果:实时荧光定量聚合酶链反应检测2019-nCoV核酸阳性;或病毒基因测序,测序结果与已知的2019-nCoV高度同源。
三、患者肺部浸润的鉴别诊断
(一)感染性疾病
1.病毒感染:
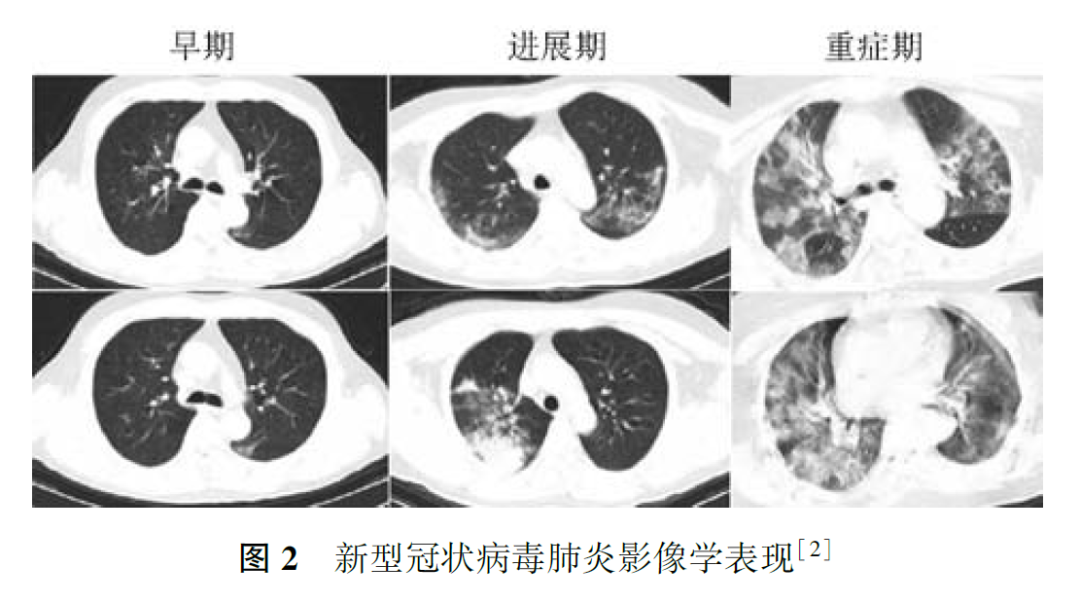
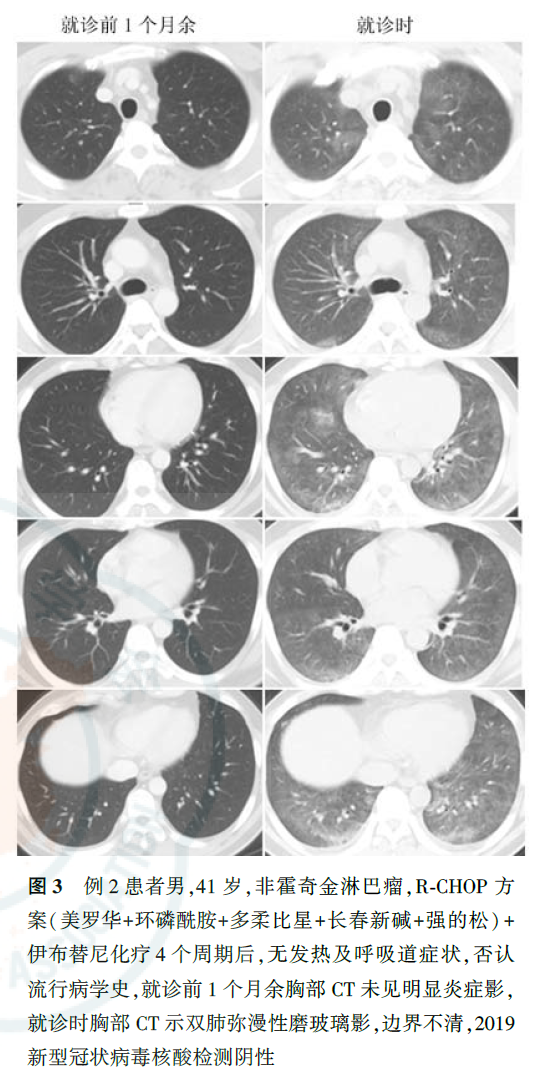
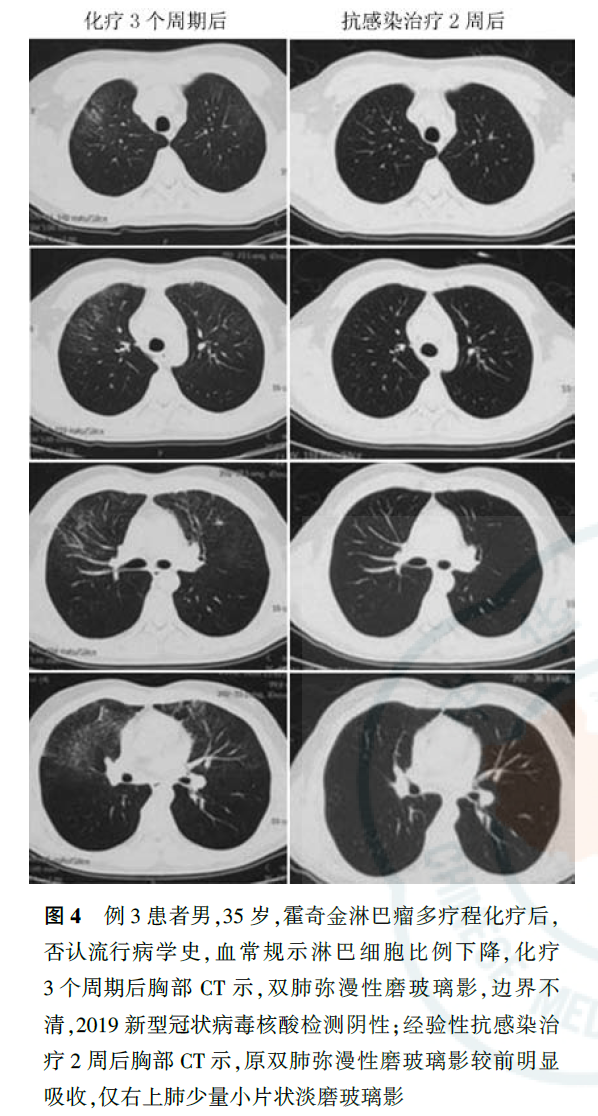
与正常人群相比,肿瘤患者感染社区获得性呼吸道病毒,如流感病毒、人副流感病毒(human parainfluenza virus, HPIV)、呼吸道合胞病毒(respiratory syncytial virus, RSV)、腺病毒、人偏肺病毒(human metapneumovirus, HMPV)等,出现肺内浸润的风险明显增加。肿瘤患者感染呼吸道病毒的季节性变化与一般社区人群相同,不同病毒科感染肺部影像学检查特征不同,如腺病毒感染以双侧多灶性磨玻璃影(ground-glass opacity, GGO)伴斑片状实变影为主,HMPV和HPIV感染会出现与细菌性肺炎相似的多灶性斑片状实变影伴GGO。在免疫明显缺陷的肿瘤患者中还可出现巨细胞病毒感染,其影像学表现为双侧不对称GGO、小的边界不清楚的中央小叶结节。COVID-19临床表现以中低热、呼吸道症状为主,白细胞计数可以正常或降低,淋巴细胞计数降低,胸部CT早期呈现多发小斑片影及间质改变,以肺外带明显,进而发展为双肺多发GGO、浸润影,严重者可出现肺实变,确诊仍需依据2019-nCoV核酸检测或病毒基因测序,恶性肿瘤患者感染2019-nCoV后出现急性呼吸窘迫综合征、脓毒症休克等重症的风险更高,病情恶化更快,应引起临床工作者重视。对于各种呼吸道病毒感染,应尽快通过痰标本、鼻咽拭子、血液、支气管肺泡灌洗液等行病毒抗原核酸检测获得病原学证据,但在判断启动治疗的时机时,个体病情较病原学检测结果更为重要。例1患者肺部影像学表现符合病毒性肺炎特点,血常规提示淋巴细胞计数下降,但无流行病学史、无临床症状,不符合COVID-19疑似病例标准,但考虑到淋巴瘤患者多疗程化疗后,免疫力低下,可能导致无症状感染,遂进行了2019-nCoV核酸检测,虽然连续2次检测结果均为阴性,但结合目前存在核酸检测假阴性的情况,仍应在启动经验性抗病毒治疗的前提下密切观察病情变化、动态监测胸部影像学改变。在疫情期间,2例化疗后新发肺内磨玻璃影患者的CT表现符合病毒性肺炎特点(图3、图4),2例患者均已行2019-nCoV核酸检测,结果为阴性。
2.肺孢子菌肺炎:
肺孢子菌肺炎(pneumocystis pneumonia, PCP)是由肺孢子菌引起的间质性浆细胞性肺炎,多见于免疫低下的疾病或状态。非获得性免疫缺陷综合征(human immunodeficiency virus, HIV)感染免疫功能受损患者未接受预防性治疗时PCP的发生率为5%~12%。非HIV患者合并PCP多为急性病程,可迅速出现显著的低氧血症、呼吸困难和咳嗽,但目前轻症PCP也在逐渐增多。本病症状严重,但肺部体征较少。胸部CT可见双肺斑片状或弥漫性GGO,可伴小叶间隔增厚(铺路石征),双肺另可见散在薄壁圆形囊腔,上述病变均以双肺上叶为著。由于痰找病原体阳性率极低,PCP确诊仍基于支气管肺泡灌洗液真菌染色和聚合酶链式反应(polymerase chain reaction, PCR),但由于该病进展迅速,多数情况下不必获得病原学确诊,如果临床和影像学表现支持PCP就应启动经验性治疗。
(二)非感染性疾病
肿瘤患者出现非感染性疾病所导致的肺部浸润亦很常见,包括肺栓塞、放射性肺炎、药物相关性肺损伤和肺出血等。有研究显示,因肺内浸润灶接受开胸肺活检的患者,肺内浸润中33%由感染引起,包括药物肺损伤和机化性肺炎等在内的炎症性疾病和肿瘤转移则占67%。肺栓塞、放射性肺炎因其诊断线索和影像学特征比较明确,鉴别时不易混淆。
接受化疗的肿瘤患者出现以肺内GGO为主的肺内浸润时,还应明确有无药物相关肺损伤。化疗药物肺损伤发生率约为10%,临床和病理改变多样且无特异性,可表现为过敏性肺炎、非特异性间质性肺炎、肺间质纤维化、弥漫性肺泡损伤和肺出血等症状。实验室检查多无特异性,胸部CT征象包括单侧、双侧非特定区域斑片状或弥漫性GGO、结节或实变影、网格状影、小叶间隔增厚等。肺功能可表现为弥散功能降低和限制性通气功能障碍。支气管肺泡灌洗和肺活检多用于排除其他感染、肺出血、恶性淋巴管炎等诊断。总的来说,药物性肺损伤属于排他性诊断。环磷酰胺导致的肺部不良反应<1%,且与药物累积剂量无关,可出现在用药后1~6个月内,影像学表现为弥漫性的肺间质改变,对于长期(半年以上)低剂量应用环磷酰胺的患者,迟发性的肺部不良反应以慢性肺间质纤维化为主。环磷酰胺所致早发性肺损伤可在停药后逐渐恢复,预后较好,但迟发性肺间质纤维化多为不可逆;长春新碱很少引起肺部不良反应;多柔比星引起肺损伤的资料有限,该药与肺损伤的因果关系尚不明确;而吉西他滨、紫杉类抗肿瘤药物亦可致急性肺损伤和间质性肺炎。
讨论
例1患者为老年男性,诊断为淋巴瘤并给予CHOP方案化疗2个月余,化疗后无明显骨髓抑制,常规胸部CT平扫发现双肺多发磨玻璃密度影,以外周为主,血常规单核细胞升高、淋巴细胞减少,CRP升高,既往无放疗史及心肺基础疾病。
肿瘤患者出现肺部浸润时,鉴别诊断需要考虑多方面病因。一方面,肿瘤患者特别是血液及淋巴系统恶性肿瘤和老年患者,往往自身免疫系统功能低下,发生社区获得性和医源性感染的风险高于正常人,而全身抗肿瘤治疗包括细胞毒性药物、生物制剂等还会进一步导致继发性免疫缺陷,化疗后出现中性粒细胞减少,均可增加机会性感染的风险。在COVID-19疫情背景下,作为易感人群,肿瘤患者出现肺内新发磨玻璃影更应注意排除COVID-19;另一方面,肿瘤患者治疗史复杂,除了心肺疾病、自身免疫性疾病等内科疾病外,化疗药物导致的不良反应、放射性肺炎均是肿瘤患者出现肺内浸润时应考量的因素。
肿瘤患者患感染性疾病的病因呈现多样化,细菌感染比例占37%,真菌感染占14%,病毒感染占15%,耶氏肺孢子菌感染占8%,结核分枝杆菌感染占1%,约20%患者有混合或序贯感染。需注意的是,肿瘤患者由于免疫功能低下,感染后免疫应答水平下降,有相当一部分患者病程中可无发热、咳嗽和呼吸困难等肺部浸润相关症状,这也使得早期诊断出现困难。
感染性疾病方面,例1患者胸部CT提示双肺多发斑片状磨玻璃影,主要分布在肺外周、胸膜下,沿支气管血管束分布,其内可见增粗的血管影,符合病毒性肺炎影像学特征。(1)在COVID-19疫情背景下,应首先结合其流行病学史、临床症状、CT表现和血常规予以排查COVID-19,确诊需要病原学2019-nCoV核酸检测,例1患者CT表现与COVID-19早期病例的影像学特点基本一致,血常规白细胞计数正常,淋巴细胞计数下降,但该患者无相关流行病学史,无发热、乏力、呼吸困难等症状,2次鼻拭子2019-nCoV核酸检测阴性,不支持COVID-19诊断。目前,对于普通人群来说,符合疑似病例标准者再进行2019-nCoV核酸检测,但考虑到肿瘤患者的易感性较高、无症状感染比例高、感染2019-nCoV后重症风险高,建议在实际临床工作中对肺内新发浸润病灶的肿瘤患者,特别是淋巴瘤、多疗程化疗后、以肺外周分布的斑片状磨玻璃影为主要表现的患者应适当放宽2019-nCoV核酸检测范围。另外,即使2019-nCoV核酸检测阴性,结合目前存在检测结果假阴性的可能,仍应在启动经验性抗病毒治疗的前提下密切观察病情及胸部影像学改变,如患者病情迅速进展,还应考虑再次行2019-nCoV核酸检测以排除COVID-19。(2)目前是流感的高发季节,流感病毒及其他社区获得性病毒性肺炎常见病原体(HPIV、鼻病毒、腺病毒、HMPV和RSV等)感染均应注意排除,单纯从影像学上难以鉴别,主要应结合症状、病原学检测进行判断。例1患者血常规单核细胞计数升高、淋巴细胞计数下降,但缺乏发热畏寒、肌肉酸痛、流涕、咽痛和咳嗽等流感常见症状,完善甲型流感病毒抗原、呼吸道病原谱筛查均为阴性,尚不能确诊为流感相关肺炎。(3)淋巴瘤患者接受化疗期间免疫力低下,还应注意排除机会性感染如PCP,主要从症状、SpO2、CT表现进行鉴别,非HIV感染PCP症状一般较重,呼吸困难明显,大多合并低氧血症,且病情进展迅速,胸部CT可见双肺上叶为著的斑片状或弥漫性磨玻璃影,可伴小叶间隔增厚(铺路石征)、薄壁圆形囊腔,确诊需要支气管肺泡灌洗液、肺活检组织染色或PCR。临床上对于症状和影像学表现符合PCP的患者,如病原学检测确诊不可行,可考虑做G试验、乳酸脱氢酶(lactate dehydrogenase, LDH)检测提供诊断线索,但应注意淋巴瘤等恶性肿瘤本身就可出现LDH升高,G试验也存在一定的假阳性,因此,主要还应从临床和CT影像学表现进行鉴别。例1患者接受了多疗程化疗,有一定的肺孢子菌感染风险,但患者起病隐匿,无呼吸道症状,SpO2不低,目前尚无有力证据支持该病的诊断。除PCP外,当经验性抗感染治疗失败时,还应注意排除隐球菌、诺卡菌、分枝杆菌、巨细胞病毒和带状疱疹病毒感染等机会性感染。
引起肺内浸润的非感染性疾病也很常见,对于化疗后出现以间质性改变为主的肺内浸润应注意排除药物性肺部损伤,发生率约为10%。某些化疗方案如含博来霉素方案[BEP方案(博来霉素+依托泊苷+顺铂)化疗3个周期以上或ABVD方案(阿霉素+博来霉素+长春花碱+氮烯咪胺)化疗4个周期以上,发生率>10%]、吉西他滨联合紫杉烷类(10%~33%)、甲氨蝶呤等肺损伤发生率较高。药物性肺损伤发生时间、症状和实验室检查均无特异性,CT早期表现可为单侧或双侧非特定区域斑片状、弥漫性磨玻璃影、结节或实变影,迟发性肺损伤则以肺间质纤维化为主,肺功能检查多提示弥散功能下降和限制性通气功能障碍。例1患者单用化疗药物时出现肺损伤的风险较低,但不能完全除外联合化疗导致肺损伤的可能。需注意药物性肺损伤属于排他性诊断,应在规范抗感染治疗无效时再考虑该诊断。
结合目前病例资料,例1患者初步诊断为病毒性肺炎,虽病原学证据不足,但考虑到肿瘤患者免疫功能低下、病情恶化风险较高,应积极启动经验性抗感染治疗。有研究显示,病毒感染的5.8%~65.7%可合并细菌或非典型病原体感染。例1患者目前口服奥司他韦和莫西沙星治疗可以覆盖社区获得性肺炎的常见病原体,拟于2周后复查CT评价疗效。如患者病情迅速进展,则应考虑PCP的可能性,必须重新检测2019-nCoV核酸,再次排查COVID-19;如肺部浸润情况无明显变化,则需考虑包括药物性肺损伤在内的非感染性疾病,停用化疗后监测CT虽可提供药物性肺损伤的诊断依据,但是否停药还应权衡患者化疗获益和药物不良反应后慎重决定。当前COVID-19疫情为肿瘤患者合并肺部浸润性改变的鉴别诊断增加了难度,期望本研究的诊疗思路能为广大医师提供参考。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


